На сегодняшний день сердечно-сосудистые заболевания (ССЗ) являются самой распространенной патологией и занимают лидирующую позицию среди причин инвалидизации и смертности населения. При этом наиболее широко встречающаяся нозология среди ССЗ – ишемическая болезнь сердца (ИБС) [1].
На сегодняшний день «золотым стандартом» профилактики сердечно-сосудистых катастроф считается терапия ацетилсалициловой кислотой (АСК) в кардиопротективных дозах, чья эффективность (в том числе для профилактики острых сердечно-сосудистых событий и смертности на фоне ИБС) неоспорима доказана в многочисленных исследованиях [1, 2]. Применение АСК как антиагреганта включено в рекомендации профессиональных сообществ кардиологов, неврологов и врачей других специальностей (Американской коллегии кардиологов, Американской кардиологической ассоциации, Европейского общества по артериальной гипертонии, Американской диабетологической ассоциации, Европейского общества кардиологов, Американской коллегии торакальных хирургов, Российского кардиологического общества).
Однако существует клиническая проблема возникновения побочных действий на фоне неопределенно долгого приема АСК. В первую очередь это касается развития эрозивно-язвенных поражений слизистой оболочки желудочно-кишечного тракта (ЖКТ) и желудочно-кишечных кровотечений (ЖКК) [3].
Патогенез развития поражений слизистой оболочки ЖКТ при приеме АСК к настоящему времени до конца не изучен. Главным механизмом возникновения таких побочных эффектов считается блокирование конституционального фермента циклооксигеназы 1 (ЦОГ 1). Последняя отвечает за выработку защитных простагландинов в слизистой оболочке ЖКТ, которые, в свою очередь, стимулируют выработку слизи, поддерживают нормальную микроциркуляцию, нейтрализуют действие пепсина, желчных кислот и соляной кислоты.
Кроме того, АСК обладает прямым раздражающим действием на слизистую оболочку желудка и кишечника, которое проявляется во время всасывания. При этом происходит обратная диффузия ионов водорода, проникновение натрия и инфекционных агентов в подслизистый слой ЖКТ, а также местное подавление выработки простагландинов [4].
На сегодняшний день изучается и третий, иммунологический механизм неблагоприятного влияния АСК на слизистую оболочку ЖКТ. Блокируя ЦОГ 1, АСК переключает метаболический путь арахидоновой кислоты с простагландинового на липоксигеназный. При этом повышается выработка провоспалительных цитокинов – фактора некроза опухоли-α (ФНО-α), интерлейкина-1β (ИЛ-1β) и ИЛ-6. По некоторым данным, на механизм ульцерогенеза может влиять взаимодействие и каскадная активация этих цитокинов [5].
В связи с этим в настоящее время ведется активный поиск путей защиты слизистой оболочки ЖКТ от негативного воздействия АСК и других НПВП.
Чаще всего для профилактики аспирин-индуцированных гастроэнтеропатий (АИГЭП) используются различные блокаторы желудочной секреции. Лидирующие позиции в лечении любых эрозивных и язвенных поражений желудка и кишечника, включая НПВП-гастропатии, занимают ингибиторы протонной помпы (ИПП) [6]. Однако их положительный эффект при индуцированных НПВП-энтероколопатиях вызывает дискуссию: клинические исследования не подтвердили эффективность ИПП в отношении данной патологии [7].
Перспективным направлением профилактики и лечения НПВП-гастроэнтеропатий является применение лекарственных средств из группы стимуляторов выработки эндогенных простагландинов. В 2016 г. в России появился препарат ребамипид («PRO.MED.Cs Praha a.s.»), который обладает многоплановым фармакологическим действием, определяющим его эффективность в качестве гастро- и энтеропротектора.
Наиболее ценное свойство ребамипида – стимуляция выработки эндогенных простагландинов в слизистой оболочке ЖКТ [8]. Препарат повышает образование макромолекулярного гликопротеинового комплекса (определяющего защитные свойства поверхностной слизи), связывает активные формы кислорода и тормозит перекисное окисление липидов, стимулирует экспрессию факторов роста [9]. Кроме того, есть зарубежные исследования, свидетельствующие, что ребапимид уменьшает воспалительную реакцию, связанную с повышенной выработкой провоспалительных цитокинов [10]. В российских клинических рекомендациях «Рациональное использование нестероидных противовоспалительных препаратов» ребамипид рекомендован для профилактики осложнений, связанных с приемом НПВП, со стороны верхних отделов ЖКТ, тонкой и толстой кишки [5].
Цель предлагаемого исследования – с позиции патогенетических подходов оценить терапевтическую эффективность ребамипида в лечении АИГЭП у пациентов с хронической ишемической болезнью сердца (ХИБС).
Материал и методы
Исследование одобрено Локальным этическим комитетом Нижегородской государственной медицинской академии (протокол № 10 от 25.12.2017). Работа проводилась на базе кардиологического и гастроэнтерологического отделений Нижегородской областной клинической больницы им. Н.А. Семашко в период с 2017 по 2019 г. В исследовании участвовали подписавшие информированное согласие пациенты с подтвержденным диагнозом ХИБС, получавшие терапию АСК не менее 12 мес.
Диагноз ХИБС подтверждался с помощью клинико-инструментальных методов. Всем участникам исследования проводились электрокардиограмма, холтеровское мониторирование, эхокардиография и селективная коронарография. В исследование не включались курящие больные, лица с язвенным анамнезом, тяжелой соматической патологией, тяжелым ожирением, также пациенты, получающие двойную антиагрегантную терапию, сопутствующую терапию НПВП, терапию антикоагулянтами, глюкокортикостероидами и цитостатиками.
Изначально в исследование вошли в общей сложности 340 пациентов с ХИБС; всем им были выполнены фиброэзофагогастродуоденоскопия (ФГДС) и быстрый уреазный тест с целью диагностики инфекции Helicobacter pylori. Наличие эндоскопических признаков эрозивно-язвенных поражений слизистой оболочки ЖКТ и отсутствие инфекции H. pylori расценивали как АИГЭП. Именно больные ХИБС с АИГЭП (n=51) стали основным объектом дальнейшего исследования.
Всех пациентов с ХИБС и АиГЭП с помощью рандомизации разделили на две группы, сопоставимые по возрасту, полу, длительности течения ХИБС и длительности терапии АСК. Первой группе пациентов (n=25) в качестве средства лечения АИГЭП был назначен ИПП пантопразол в суточной дозе 40 мг. Во второй группе (n=26) вместе с пантопразолом применялся стимулятор выработки эндогенных простагландинов ребамипид в суточной дозе 300 мг. Лечение и наблюдение происходило в течение двух месяцев.
По окончании терапии всем пациентам проводили контрольную ФГДС. До и после лечения всем больным с ХИБС и АИГЭП определяли уровень простагландина Е2 (ПГЕ2) в сыворотке венозной крови (иммуноферментным методом с использованием наборов фирмы RiD systems, Inc, США) и уровни провоспалительных цитокинов ФНО-α, ИЛ-1β и ИЛ-6 (иммуноферментным методом с использованием наборов фирмы «Вектор БЕСТ»). Группу контроля составили 26 пациентов с ХИБС, у которых отсутствовали патологические изменения слизистой оболочки ЖКТ.
Статистическая обработка данных проводилась в программе STATISTICA 10.0. Статистически значимыми считались различия при р <0,05. Проверка распределения на нормальность проводилась с помощью критерия Колмогорова–Смирнова и Шапиро–Уилка. Количественные признаки сравнивались при помощи знакового рангового теста Вилкоксона, У-критерия Манна–Уитни и Т-критерия Стъюдента.
РЕЗУЛЬТАТЫ
Среди 340 больных ХИБС, изначально включенных в исследование, АиГЭП были выявлены у 51 (15%) пациента – 30 мужчин (59%) и 21 женщины (41%).
Эндоскопическая характеристика АИГЭП выглядела следующим образом: в 43% случаев были обнаружены эрозии тела и антрума желудка, в 21,5% – эрозии двенадцатиперстной кишки (ДПК), в 15,8% – одновременно эрозии желудка и ДПК. Еще у 11,7% пациентов была выявлена геморрагическая гастропатия, у 8% – язвенная болезнь желудка и/или ДПК.
Через 2 мес терапии в первой группе исследования, получавшей только пантопразол, у 6 пациентов из 25 оставались эндоскопические признаки АИГЭП. Во второй группе, получавшей пантопразол вместе с ребамипидом, у всех пациентов определялась слизистая оболочка без патологических изменений.
Согласно используемой методике, в норме содержание ПГЕ2 сыворотки крови составляло 409 пг/мл, ФНО-α – 0,5 пг/мл, ИЛ-1β – 1,6 пг/мл, ИЛ-6 – 2,0 пг/мл. У пациентов с ХИБС без признаков эрозивно-язвенных поражений ЖКТ эти лабораторные показатели практически не отличались от нормальных значений, тогда как у пациентов с ХИБС и АИГЭП ПГЕ2 был значительно снижен, а провоспалительные цитокины повышены (табл. 1).
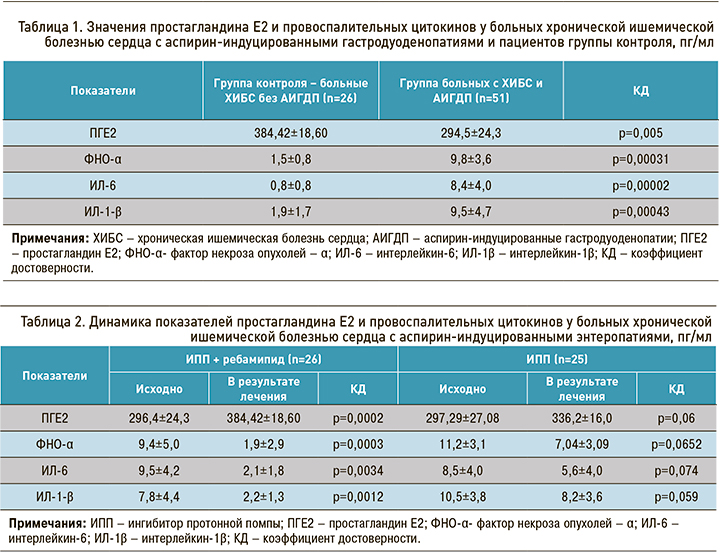
В результате лечения пациентов с ХИБС и АИГЭП только с помощью ИПП наблюдалась положительная динамика лабораторных показателей, однако разница между ними до начала лечения и после его окончания оказалась статистически недостоверной. У больных, которые наряду с ИПП получали ребамипид, были выявлены более заметные изменения: лабораторные показатели после лечения имели практически нормальные значения (табл. 2).
Стоит отметить, что среди пациентов с ХИБС и АИГЭП до начала терапии только 35% предъявляли какие-либо гастроэнтерологические жалобы. После лечения в обоих группах жалоб со стороны ЖКТ никто не предъявлял.
ОБСУЖДЕНИЕ
В настоящем исследовании у 15% больных ХИБС (n=51), длительно получающих АСК, были выявлены эрозивно-язвенные поражения ЖКТ, не связанные с инфекцией H. pylori. Их расценивали как АИГЭП. В целом, согласно данным литературы, в основном посвященной изучению НПВП-гастроэнтеропатий, на фоне регулярной терапии НПВП, поражения ЖКТ выявляются в 15–40% случаев [5]. Однако к настоящему времени недостаточно исследований, посвященных именно АИГЭП. Вместе с тем имеющиеся сведения позволяют утверждать, что по частоте они не уступают другим НПВП-гастропатиям [11].
В ходе работы среди нозологических форм АИГЭП выявлено преобладание поражений желудка. По данным литературы, преобладание именно таких форм АИГЭП является характерной особенностью НПВП-гастроэнтеропатий [12].
По нашим данным, среди пациентов с АиГЭП в 65% случаев отсутствовали жалобы со стороны ЖКТ. Некоторые авторы объясняют отсутствие гастроэнтерологической симптоматики при терапии АСК и другими НПВП формированием более высоких сенсорных порогов, связанных с основным заболеванием и наличием противовоспалительного и обезболивающего эффекта у этого класса лекарственных средств. Кроме того, рядом исследователей замечен дисбаланс между жалобами и выраженностью эндоскопической картины: часто у пациентов с эрозивно-язвенными поражениями ЖКТ отсутствует какая-либо симптоматика, и напротив, у больных, предъявляющих жалобы на диспепсию и боли в эпигастрии, при ФГДС не выявляются патологические изменения слизистой оболочки. Это еще раз подтверждает сложность диагностики НПВП-гастропатий. Осложнения в виде желудочно-кишечных кровотечений встречаются все же чаще при имеющемся эрозивно-язвенном процессе слизистой оболочки ЖКТ [13]. Этот факт показывает важность раннего выявления и лечения такой патологии.
Главный механизм повреждающего действия АСК на слизистую оболочки ЖКТ заключается в снижении выработки защитных простагландинов путем блокирования ЦОГ 1. Однако в целом патогенез повреждающего действия АСК до конца не изучен. Известно, что, кроме блокирования выработки простагландинов, АСК изменяет метаболический путь арахидоновой кислоты, переключая его с простагландинового на липоксигеназный путь. Под действием липоксигеназы происходит стимуляция NF-каппа-В и повышение выработки провоспалительных цитокинов (ФНО-α, ИЛ-1β, ИЛ-6), которые, в свою очередь, токсически воздействуют на слизистую оболочку ЖКТ [13].
Исходя из результатов настоящего исследования, можно констатировать, что повышение уровня провоспалительных цитокинов играет свою роль в развитии АИГЭП у пациентов с ХИБС. При этом терапия такой патологии с использованием ребамипида патогенетически оправданна и более эффективна, чем лечение только ИПП.
ЗАКЛЮЧЕНИЕ
Сердечно-сосудистая смертность в России в значительной степени обусловлена ИБС. Для профилактики сердечно-сосудистых событий на фоне ХИБС необходим длительный прием АСК. Однако нередко на фоне приема АСК возникают АиГЭП. По данным настоящего исследования, АиГЭП у пациентов с ХИБС выявлена в 15% случаев. В их структуре превалировали эрозивные процессы тела и антрума желудка. При этом язвенные дефекты слизистой оболочки ЖКТ встречались реже. Особо следует подчеркнуть, что в большинстве случаев пациенты с АиГЭП не предъявляли жалоб со стороны ЖКТ.
В исследовании показано, что у пациентов с ХИБС и АиГЭП снижается уровень ПГЕ2 и повышаются показатели провоспалительных цитокинов сыворотки крови. По всей видимости, это может играть определенную роль в развитии поражений слизистой оболочки ЖКТ на фоне приема АСК.
Стимулятор выработки эндогенных простагландинов ребамипид в комплексной терапии с ИПП показал хорошую эффективность при лечении АиГЭП у больных ХИБС.
Накопленная доказательная база позволяет рекомендовать ребамипид для профилактики и лечения осложнений, обусловленных приемом НПВП (в том числе аспирин-индуцированных патологий), со стороны верхних отделов ЖКТ, тонкой и толстой кишки.



