К антигипертензивным препаратам (АГП) первой линии в настоящее время относятся ингибиторы ангиотензинпревращающего фермента (иАПФ), антагонисты рецепторов ангиотензина II первого типа (АРА), β1-адреноблокаторы, блокаторы медленных кальциевых каналов и диуретики [1]. ИАПФ и АРА являются наиболее часто используемыми препаратами с доказанным кардио-, нефро- и церебропротективными свойствами [1]. Ряд клинических исследований, в частности ONTARGET [2] и VALIANT [3], продемонстрировали равную эффективность иАПФ и АРА в первичной и вторичной профилактике ассоциированных с артериальной гипертензией (АГ) кардиоваскулярных событий. Схожесть фармакологических эффектов, показаний к применению и клинической эффективности ставит вопрос о необходимости выбора между иАПФ и АРА у конкретного пациента.
Цель исследования – анализ клинических особенностей и эффективности антигипертензивной терапии (АГТ) у амбулаторных пациентов, получающих иАПФ и АРА.
МАТЕРИАЛ И МЕТОДЫ
В одномоментное исследование было включено 135 пациентов, обратившихся на амбулаторный прием врача-терапевта в Екатеринбурге. Критериями включения были наличие установленного диагноза АГ, информированное добровольное согласие на участие в исследовании.
Опрос пациентов проводился с помощью специально разработанной анкеты. У всех обследуемых по единой схеме собран анамнез, учитывавший наличие факторов кардиоваскулярного риска, признаков бессимптомного поражения органов-мишеней (ПОМ), ассоциированных клинических состояний и других соматических заболеваний [1]. Получены данные о принимаемых АГП, уточнен фармакотерапевтический анамнез. Всем пациентам была проведена антропометрия, рассчитано среднее значение артериального давления (АД) по трем измерениям [1]. Общий уровень мультиморбидности определялся с помощью индекса Чарлсон [4, 5].
В зависимости от состава базисной АГТ пациенты были разделены на 2 группы:
- группа 1 – больные, принимающие иАПФ;
- группа 2 – больные, принимающие АРА.
Статистическая обработка результатов исследования проводилась с помощью пакета Statistica 13.0 (лицензия № JPZ904I805602ARCN25ACD-6). Данные описаны с помощью медианы и квартилей (25÷75%). Различие независимых выборок оценивалось с помощью критерия Манна–Уитни. Анализ таблиц сопряженности проводился с помощью двустороннего точного критерия Фишера и критерия χ2 Пирсона. Для исследования взаимодействия факторов на проявление признака проводился логлинейный анализ многовходовых таблиц сопряженности. Различия считались статистически значимыми при достижении уровня p <0,05.
Проведение исследования было одобрено локальным этическим комитетом ФГБОУ ВО «Уральский государственный медицинский университет» Минздрава России на заседании № 5 от 18.05.2018.
РЕЗУЛЬТАТЫ
Выборка из 135 человек включала 99 (73,3%) женщин и 36 (26,7%) мужчин. Медиана возраста составила 68 (61÷76) лет.
На момент осмотра иАПФ в качестве базисной терапии получали 54 респондента (группа 1, 40,0%), АРА – 63 (группа 2, 46,7%). 18 человек (13,3%) не получали ингибиторы ренин-ангиотензин-альдостероновой системы (РААС). В группе иАПФ было 33 женщины (61,1%), в группе АРА – 52 (82,5%); различие значимо (р=0,013).
АГ без ПОМ была диагностирована у 24 (17,8%) больных, с ПОМ – у 12 (8,9%), ассоциированные состояния – у 99 (73,3%). Не было обнаружено значимого различия частот выявления бессимптомного ПОМ и ассоциированных состояний у получавших иАПФ и АРА (χ2=1,2; с.с.=2; р=0,537). АГ 1 степени была выявлена у 16 (11,9%) пациентов, 2 степени – у 48 (35,6%), 3 степени – у 71 (52,6%). По степени АГ группы не различались (χ2=2,3; с.с.=2; р=0,320). К категории умеренного сердечно-сосудистого риска было отнесено 18 (13,3%) пациентов, высокого – 32 (23,7%), очень высокого – 85 (63,0%). Уровни кардиоваскулярного риска у больных групп 1 и 2 не отличались (χ2=1,0; с.с.=2; р=0,609).
Общая характеристика пациентов указанных групп приведена в таблице 1.
Не было обнаружено различий антропометрических показателей между обследованными больными обеих групп. Уровень мультиморбидности получавших как иАПФ, так и АРА был одинаковым. Частота выявления основных заболеваний представлена в таблице 2.
У пациентов, получавших АРА чаще, чем у принимавших иАПФ, выявлялись стабильная стенокардия напряжения и остеоартроз.
Медиана количества компонентов АГТ составила 3 (2–3), пациенты группы АРА принимали большее количество АГП (3 [2–4]) по сравнению с больными группы иАПФ (2 [2–3]); различие значимо (р=0,019).
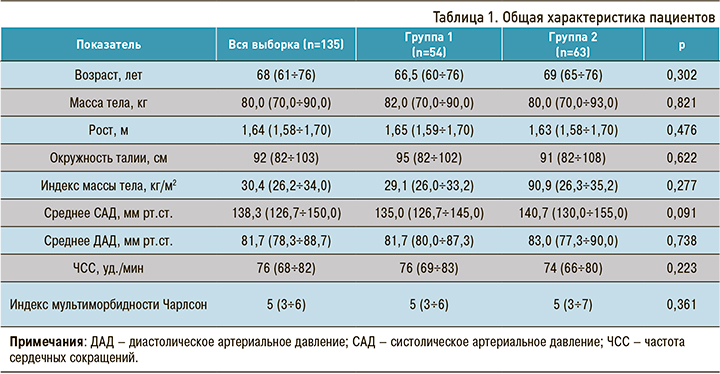
На рисунке представлены иАПФ и АРА, получаемые пациентами на момент осмотра.
Целевые значения АД были достигнуты у 32 (59,3%) больных, принимавших иАПФ, и у 25 (39,7%) принимавших АРА; различие значимо (р=0,042).
Наличие у пациентов остеоартроза было ассоциировано со снижением эффективности АГТ. Целевой уровень АД был достигнут у 12 пациентов с остеоартрозом (30,8%) и у 54 без него (56,3%) (р=0,008). Также отмечена значимая разница во влиянии остеоартроза на эффективность терапии исследуемыми классами ингибиторов РААС. Не было обнаружено различий в частоте достижения целевых значений АД у принимавших иАПФ больных с артрозом (50,0%) и без него (60,4%) (р=0,678), однако выявлено снижение эффективности АГТ у пациентов с артрозом, принимавших АРА (целевой уровень у 50,0% у больных без артроза и 21,7% с ним; р=0,034). Значимость разницы тенденций подтверждена логлинейным анализом: χ2=9,446; с.с.=2; р=0,009.
Из 117 пациентов, получавших ингибиторы РААС, оригинальные препараты принимали 22 человека (18,8%). На льготных условиях пациенты чаще получали АРА (18 человек, 28,6%), чем иАПФ (7 человек, 13,0%); различие значимо (р=0,045, двусторонний точный критерий Фишера). Среди пациентов, получавших ингибитор РААС на льготных условиях, целевые значения АД были достигнуты у 5 человек (20,0%), а среди больных, получавших препарат на общих основаниях, – у 53 (57,0%) (р=0,001). Уровень мультиморбидности пациентов, имевших право на льготное обеспечение АГТ, был значимо выше (р=0,038).
Ингибитор РААС никогда не получали 7 пациентов (5,2%). ИАПФ когда-либо принимали 103 пациента выборки, у 49 (47,6%) из них препарат был отменен. АРА когда-либо получали 85 человек, препарат был отменен у 22 (25,9%) из них. Ингибитор РААС чаще отменялся у пациентов, получавших иАПФ, чем БРА (р=0,003).
Причину отмены иАПФ удалось восстановить в 38 случаях: у 24 человек был зарегистрирован сухой кашель, у 12 терапия была неэффективной, у одного пациента развился ангионевротический отек, еще у одного препарат был отменен на фоне развития опухолевого процесса неуточненной локализации. Сухой кашель был наиболее частым побочным эффектом иАПФ и развился у 35 пациентов (34,0% случаев терапии), однако не всегда был поводом для отмены препарата.
Причина отмены АРА, в свою очередь, была установлена у 18 пациентов. Наиболее часто терапия прекращалась в связи с неэффективностью препарата (17 случаев), еще в одном случае – из-за развития сухого кашля.
ИАПФ чаще отменялись у больных остеоартрозом (р=0,001). Частота отмены АРА не зависела от наличия у больного поражения суставов (р=0,182).
ОБСУЖДЕНИЕ
Вопрос о сравнительной эффективности иАПФ и АРА в лечении как АГ, так и других сердечно-сосудистых заболеваний возник достаточно давно. Первоначально лидирующее в области АГТ положение иАПФ, в сравнении с АРА, было обусловлено более ранним их появлением на фармацевтическом рынке [6]. Первый иАПФ – каптоприл – начал использоваться для терапии АГ еще в 1978 г., а первый АРА – лозартан – только в 1995 г. [6].
Постепенное увеличение частоты использования АРА для лечения больных АГ четко прослеживается при анализе результатов двух крупных фармакоэпидемиологических исследований – ПИФАГОР III [7] и ПИФАГОР-IV [8]. В 2008 г. частота назначения пациентам с АГ иАПФ варьировала от 26,0 до 57,4% в зависимости от режима терапии, в то время как аналогичный показатель для АРА составлял лишь 2,0–4,5% [7]. Исследование ПИФАГОР-IV продемонстрировало существенное возрастание доли АРА (до 16,0%) и практически не изменившуюся частоту назначения врачами иАПФ (24,2%) [8].
В настоящем исследовании частота приема пациентам АРА составила 46,7% и превысила частоту использования иАПФ (40,0%). С одной стороны, такой результат соответствует общероссийским тенденциям [7, 8, 9], с другой – отражает особенности АГТ в Екатеринбурге. Известно, что имеются региональные отличия в частоте назначения тех или иных классов АГП [9]. Так, в Санкт-Петербурге, Новосибирской, Ульяновской и Томской областях лидирующей группой являются иАПФ, в Ярославской области и Самаре – бета-адреноблокаторы [9].
Повышение частоты назначения АРА, по сравнению с иАПФ, может быть частично объяснено тем, что при сопоставимой эффективности АРА обладают лучшей переносимостью [1, 6, 10]. Проведенный в рамках исследования ПИФАГОР -III анализ побочных эффектов АГП показал, что наибольшая доля сообщений о нежелательных лекарственных реакциях была зарегистрирована со стороны иАПФ – 48,0%, тогда как со стороны БРА всего 2,0% [11]. Способность иАПФ блокировать распад брадикинина приводит, с одной стороны, к усилению антигипертензивного эффекта, а с другой – к формированию нежелательных брадикинин-зависимых реакций. Наиболее частым (до 71,6%) в структуре всех нежелательных эффектов иАПФ является сухой кашель [11], частота развития которого, по данным литературы, варьирует от 0,7 до 44% [6, 9, 12]. В данном исследовании она составила 34,0%. Нежелательные реакции были наиболее частой причиной отмены иАПФ в текущем исследовании (25 из 38 случаев отмены иАПФ с восстановленной причиной). АРА обладают значительно лучшим профилем безопасности [1, 6, 9, 11], что также было подтверждено в текущем исследовании: лишь в 1 случае из 18 причиной отмены препарата стал побочный эффект (сухой кашель).
Соматический статус пациентов, принимавших иАПФ и АРА, был сопоставим по ряду показателей антропометрии и наличию основных сердечно-сосудистых заболеваний. В целом данное наблюдение соответствует результатам исследований, где была показана одинаковая эффективность иАПФ и АРА в отношении органопротекции на различных этапах сердечно-сосудистого континуума [1, 2, 3, 6, 10]. Действующие клинические рекомендации по диагностике и лечению АГ [1] в большинстве ситуаций не отдают какого-либо предпочтения иАПФ или АРА, за исключением сочетания АГ и бронхиальной астмы, когда терапия иАПФ сопряжена с повышением вероятности бронхоспазма, усилением сухого кашля и снижением приверженности терапии [1].
В настоящем исследовании остеоартроз был ассоциирован со снижением частоты достижения целевых значений АД у пациентов, принимавших АРА. Наличие остеоартроза не влияло на эффективность терапии иАПФ, однако было ассоциировано с более частой их отменой в анамнезе. Хронический болевой синдром, в том числе при остеоартрозе, определяет потребность пациента в нестероидных противовоспалительных препаратах (НПВП). Сложным является вопрос о совместном назначении НПВП и АГП [13]. Известно, что НПВП, с одной стороны, выступают факторами ухудшения течения АГ [14, 15], а с другой – снижают эффективность средств, влияющих на РААС [14]. Альтернативой НПВП служит использование анальгетиков смешанного опиоидного и неопиоидного действия, к которым относится трамадол, обладающий наименее выраженным прогипертензивным эффектом [13].
Также было показано, что АГТ была менее эффективна у пациентов, получавших ингибитор РААС на льготных условиях. Частично это объясняется тем, что больные с правом на льготное обеспечение имели более высокий уровень мультиморбидности, ассоциирующийся с увеличением числа компонентов антигипертензивной терапии и снижением ее эффективности [16]. Кроме того, на льготных основаниях пациенты чаще получают воспроизведенные препараты, что также может сказываться на эффективности терапии [17].
ЗАКЛЮЧЕНИЕ
- Особенностью амбулаторной клинической практики Екатеринбурга является превалирование назначения АРА над назначением иАПФ.
- В большинстве клинических ситуаций выбор между иАПФ и БРА остается эмпирическим и определяется переносимостью и эффективностью терапии.
- Фармакотерапия хронического болевого синдрома у пациентов с АГ требует рационального подхода, поскольку использование НПВП сопряжено со снижением эффективности как иАПФ, так и АРА.
Авторы выражают благодарность Д.А. Акуловой, К.Е. Волковой, М.В. Вьюхиной, Е.В. Гамзовой, Т.В. Гладких, И.Р. Исламову, Е.М. Красулину, М.В. Мещеряковой, В.В. Чечель за большую помощь в наборе данных наблюдения больных.



