ВВЕДЕНИЕ
Синдром задней обратимой энцефалопатии (СЗОЭ; posterior reversible encephalopathy syndrome – PRES) – это остро/подостро возникающие клинико-радиологические нарушения, морфологической основой которых является вазогенный отек головного мозга. Термин СЗОЭ был введен в клиническую практику в 1996 г. Hinchey J. et al. [1]. Авторы описали 15 пациентов с разными заболеваниями/патологическими состояниями (эклампсия, волчаночный нефрит, печеночная и почечная недостаточность, применение иммуносупресивной терапии по поводу онкологических процессов или пересадки органов), но с одинаковой клинико-радиологической картиной, включавшей обратимые (при условии адекватного лечения) неврологические и нейровизуализационные симптомы. К настоящему времени установлено, что факторами риска развития СЗОЭ служат различные заболевания, эндогенные и экзогенные токсические воздействия, прием лекарственных средств с цитотоксическим и/или иммуносупрессивным эффектом и др. [2]. Несмотря на многочисленность факторов риска, СЗОЭ в МКБ-10 отнесен к разделу «Болезни системы кровообращения» (I67.83), а в МКБ-11 включен в раздел цереброваскулярных заболеваний (блок 8B22 – «Некоторые уточненные цереброваскулярные болезни», код 8В22.Y), так как в большинстве случаев его развитие происходит вследствие внезапного и значительного повышения артериального давления (АД) – гипертонического криза [1, 3].
КЛИНИЧЕСКИЕ И НЕЙРОВИЗУАЛИЗАЦИОННЫЕ ПРОЯВЛЕНИЯ СИНДРОМА ЗАДНЕЙ ОБРАТИМОЙ ЭНЦЕФАЛОПАТИИ
Ведущими клиническими симптомами СЗОЭ выступают расстройства сознания (снижение его уровня, эпизоды психомоторного возбуждения), эпилептические приступы, интенсивная головная боль, зрительные нарушения (нечеткость зрения, гемианопсия, зрительная агнозия) и др., которые часто развиваются на фоне внезапного подъема АД [2, 4, 5]. При тяжелом течении СЗОЭ в клинической картине доминируют угнетение сознания вплоть до комы и очаговые симптомы [1, 6]. При легкой форме синдрома может наблюдаться только один клинический симптом, например, головная боль или однократный эпилептический приступ [7].
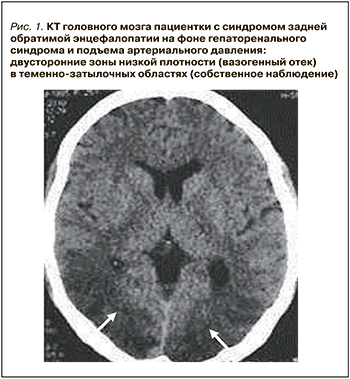
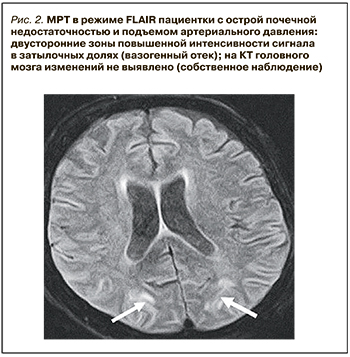
Компьютерная томография (КТ) или магнитно-резонансная томография (МРТ) являются необходимыми методами диагностики СЗОЭ, позволяющими выявить его морфологическую основу – вазогенный отек головного мозга. При классическом варианте СЗОЭ (до 70% всех наблюдений) вазогенный отек мозга локализуется в теменно-затылочных отделах больших полушарий. На КТ он представлен зонами низкой плотности (рис. 1). Методом выбора для окончательной диагностики СЗОЭ служит МРТ. Вазогенный отек головного мозга хорошо визуализируется в режиме МРТ FLAIR (инверсия–восстановление с подавлением сигнала от воды) в виде гиперинтенсивного сигнала (рис. 2) [8, 9].
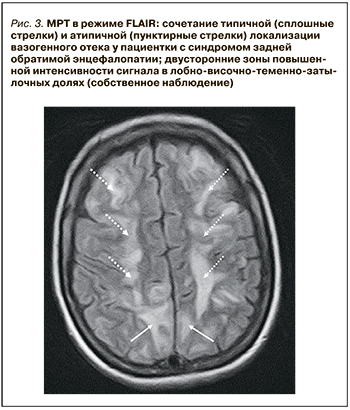
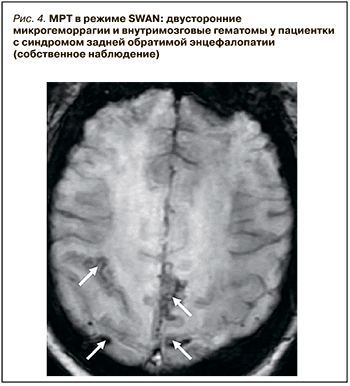
Активное применение КТ и МРТ позволило расширить представления о нейровизуализационных особенностях СЗОЭ. Так, к настоящему времени установлена возможность вовлечения в патологический процесс не только белого (лейкоэнцефалопатия), но и серого вещества головного мозга. Кроме классической локализации, изменения при СЗОЭ могут быть и в других отделах больших полушарий, подкорковых структурах, стволе и мозжечке (рис. 3) [10–12]. Значительно реже наблюдается односторонняя или асимметричная локализация СЗОЭ [13, 14]. Возможно также изолированное поражение ствола головного мозга или подкорковых структур без вовлечения классических зон [15, 16]. Кроме этого, показана возможность развития цитотоксического отека и ишемических изменений [9], микрокровоизлияний, внутримозговых и субарахноидальных кровоизлияний (рис. 4) [17]. Согласно данным Liman T.G. et al. [18], существует положительная связь между обширностью вазогенного отека головного мозга и вероятностью развития геморрагических осложнений.
ПАТОГЕНЕЗ СИНДРОМА ЗАДНЕЙ ОБРАТИМОЙ ЭНЦЕФАЛОПАТИИ
Патогенез СЗОЭ до конца не изучен. Синдром развивается на фоне различных заболеваний/патологических состояний, механизмы действия которых объединены в три гипотезы: вазогенную, токсическую и иммунную [19, 20]. Эти механизмы отдельно или в сочетании друг с другом приводят к эндотелиальной дисфункции мелких сосудов [21] и повышению проницаемости гематоэнцефалического барьера (ГЭБ) с формированием вазогенного отека головного мозга [7].
АУТОРЕГУЛЯЦИЯ МОЗГОВОГО КРОВОТОКА
В физиологических условиях у нормотоников стабильный мозговой кровоток сохраняется в пределах ≈60–150 мм рт.ст. среднего АД. Ниже и выше этих значений в большинстве случаев происходит срыв ауторегуляции, и мозговой кровоток соответственно уменьшается или возрастает. У лиц, страдающих артериальной гипертензией (АГ), нижние и верхние границы ауторегуляции могут смещаться вправо. В основе ауторегуляции мозгового кровотока лежат метаболический, миогенный и нейрогенный механизмы. Изменение АД сначала активирует гладкие мышцы сосудов, которые изменяют сосудистое сопротивление посредством вазодилатации (при снижении АД) или вазоконстрикции (при повышении АД) [22]. При недостаточности этого механизма активируется нейрогенный компонент, чья эффективность зависит от степени симпатической иннервации сосудов [22, 23].
НЕВРОЛОГИЧЕСКИЕ ОСЛОЖНЕНИЯ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
АГ относится к основным факторам риска развития сосудистых осложнений, а головной мозг – это одна из главных мишеней при этом заболевании [24]. Поражение мозга при АГ представлено как хроническими, так и острыми состояниями; последние включают острую гипертоническую энцефалопатию (код МКБ 10 – I67.4), одним из проявлений которой может быть СЗОЭ (рис. 5).
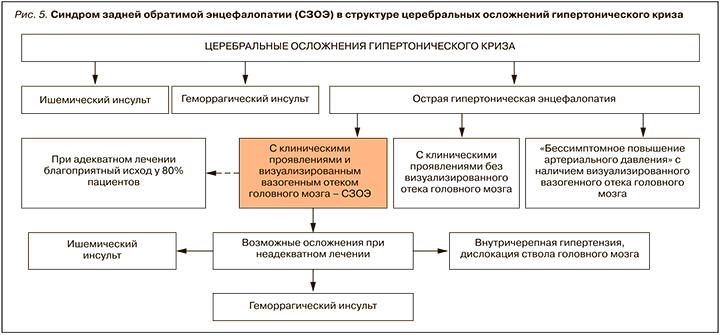
АГ у пациентов с СЗОЭ отмечается в 70–80% наблюдений [1, 2]. Важным как для лечения, так и предупреждения рецидивов СЗОЭ видится выявление и установление причины АГ. Иллюстрацией может служить наблюдение Babici D. et al. [25], в котором рецидив СЗОЭ вследствие высокого и плохо контролируемого АД наблюдался у пациентки со стенозом почечной артерии.
При анализе роли АГ в развитии СЗОЭ также следует учитывать не только абсолютные показатели АД, но и скорость его повышения. У лиц без анамнестических указаний на АГ особое внимание необходимо обращать на впервые в жизни развившийся гипертонический криз. В этих случаях срыв ауторегуляции мозгового кровотока возможен при менее значительном подъеме АД [26].
В ряде исследований указывается на связь между фоновым заболеванием/патологическим состоянием и степенью повышения АД, которое вызывает вазогенный отек головного мозна. Так, по данным Liman T.G. et al. [18], более высокие показатели среднего АД при развитии СЗОЭ регистрируются у больных с инфекционными осложнениями, эклампсией и аутоиммунными нарушениями, по сравнению с пациентами, получающими химио- или иммуносупрессивную терапию. Возможно, это обусловлено тем, что у пациентов на химио- или иммуносупрессивной терапии менее высокое, но индивидуально значимое повышение АД может играть роль триггера, активируя фоновую дисфункцию эндотелия, вызванную токсическими, иммунными и иными процессами.
Обширность отека головного мозга при СЗОЭ может быть в определенной степени связана с показателями АД до развития СЗОЭ. Так, Lee M.K. et al. [27] отмечают, что у пациентов с рабочими значениями среднего АД ≥99,7 мм рт.ст. площадь отека мозга при развитии СЗОЭ была достоверно больше, чем у пациентов с более низким средним АД (<99,7 мм рт.ст.). Также выявляется связь между степенью повышения систолического АД во время развития СЗОЭ, обширностью вазогенного отека головного мозга и последующим регрессом радиологических изменений [18].
МЕХАНИЗМ РАЗВИТИЯ СИНДРОМА ЗАДНЕЙ ОБРАТИМОЙ ЭНЦЕФАЛОПАТИИ ПРИ ГИПЕРТОНИЧЕСКОМ КРИЗЕ
Быстрый и значительный подъем АД приводит к нарушению компенсаторных вазоконстрикторных механизмов и вызывает пассивное растяжение мелких церебральных сосудов [22, 23]. Это способствует повышению проницаемости ГЭБ и развитию вазогенного отека головного мозга [28]. При этом имеется положительная корреляция между быстротой и степенью подъема АД и повышением проницаемости ГЭБ [29]. В тяжелых случаях ГЭБ становится проницаем и для форменных элементов крови, что влечет за собой кровоизлияния.
Согласно результатам ряда исследований [3, 30], быстрое и значительное повышение АД играет роль разрешающего фактора не только при вазогенном, но и при токсико-иммунологическом механизме формирования СЗОЭ. Это подтверждается тем, что снижение АД в большинстве случаев приводит к быстрому регрессу или исчезновению клинических проявлений СЗОЭ, несмотря на сохранение фонового заболевания. В то же время важно отметить, что развитие СЗОЭ, включая геморрагические осложнения, может наблюдаться и у пациентов без повышения АД.
Несмотря на системное повышение АД, различные отделы головного мозгв при СЗОЭ страдают избирательно: изменения выявляются преимущественно в задних отделах больших полушарий, что связывают с особенностями симпатической/парасимпатической иннервации вертебробазилярных сосудов по сравнению с сосудами каротидной системы [31, 32].
ОСНОВНЫЕ НАПРАВЛЕНИЯ ЛЕЧЕНИЯ БОЛЬНЫХ В ОСТРОМ ПЕРИОДЕ СИНДРОМА ЗАДНЕЙ ОБРАТИМОЙ ЭНЦЕФАЛОПАТИИ
При описании первых пациентов с СЗОЭ Hinchey J. et al. [1] подчеркивали, что его лечение должно состоять из выявления и коррекции/устранения факторов риска, а также симптоматической терапии, включая нормализацию АД.
Снижение АД – основное направление неотложного лечения СЗОЭ, развившегося вследствие гипертонического криза (рис. 6). В этом случае рекомендуется снижение среднего АД на 20–25% от исходного уровня в первые 2–4 ч и дальнейшее постепенное его снижение на протяжении 24 ч до оптимальных для пациента показателей [33]. Следует иметь в виду, что более быстрое снижение АД может привести к гипоперфузии и ишемии головного мозга.

До настоящего времени вследствие редкости СЗОЭ не проведено клинических исследований относительно эффективности отдельных групп антигипертензивных средств при этом синдроме. В связи с этим рекомендуются препараты, применяемые для купирования гипертонического криза [33, 34]. Во всех случаях необходимо выполнять поиск причин АГ.
Наряду с этапным снижением АД, чрезвычайно значимы контроль и максимальная коррекция фонового заболевания, приема химиотерапевтических, иммуносупрессивных и иных препаратов. Также обязательно симптоматическое лечение: проведение противосудорожной терапии при эпилептических приступах, купирование головной боли и иных клинических проявлений (см. рис. 6).
Несвоевременная диагностика и неадекватное лечение СЗОЭ может сопровождаться развитием стойких осложнений в виде ишемического или геморрагического инсульта, дислокации ствола головного мозга, а также летального исхода. По данным Hefzy H.M. et al. [17], неблагоприятный исход СЗОЭ отмечается в 20–25% случаев и в большинстве наблюдений обусловлен усугублением фонового заболевания, включая развитие/нарастание полиорганной недостаточности.
ЗАКЛЮЧЕНИЕ
СЗОЭ, выступая проявлением острой гипертонической энцефалопатии, может быть одним из серьезных осложнений гипертонического криза. Морфологической основой этого синдрома служит вазогенный отек головного мозга, который может иметь как типичную, так и атипичную локализацию. Основным направлением неотложной терапии при развитии СЗОЭ на фоне гипертонического криза является этапная нормализация АД. Серьезными осложнениями СЗОЭ могут быть геморрагические и/или ишемические инсульты, внутричерепная гипертензия, выраженный отек с дислокацией ствола головного мозга, усугубление течения основного заболевания и летальный исход.


