Кафедра военно-полевой терапии военно-медицинского факультета Белорусского государственного медицинского университета более 20 лет занимается изучением наследственных нарушений соединительной ткани (ННСТ). Результатами многолетней работы кафедры стало издание и утверждение в 2016 г. двух международных наднациональных рекомендаций «Аортопатии при наследуемых нарушениях соединительной ткани» [1] и «Структурные аномалии сердца» [2], включающие в том числе и научные результаты рассматриваемой темы [3, 4].
В представленном исследовании изучается особая группа популяции: лица молодого возраста с патологией или дисплазиями соединительной ткани – синдромом Марфана (СМ) и марфаноподобным фенотипом (МПФ). Хронический гастрит в таких группах пациентов ранее не изучался, так как пристальное внимание медицинской общественности было обращено на жизнеугрожающую патологию аорты. До сих пор нет согласительных документов, указывающих, что на данные группы распространяются классические представления об известных формах хронического гастрита. В современной классификации особый тип гастрита при ННСТ отсутствует.
СМ является классической «моделью» расстройства структуры и функции соединительной ткани, которое наследуется по аутосомно-доминантному типу. В классических случаях лица с СМ имеют высокий рост, удлиненные конечности, вытянутые пальцы (арахнодактилия) и недоразвитие жировой клетчатки. Наравне с характерными изменениями в органах опорно-двигательного аппарата (удлиненные трубчатые кости скелета) при этом синдроме наблюдается патология в органах зрения (эктопия хрусталика) и сердечно-сосудистой системы (патология грудной аорты), что составляет классическую триаду СМ.
В патогенезе СМ ключевое значение придают белку фибриллину-1 (FBN-1), который выполняет не только структурную, но и функциональную роль во внеклеточном матриксе. Указанный коллагеноподобный белок регулирует ТФРβ-сигнализирующие функции, играя важнейшую роль в модуляции и биодоступности трансформирующего фактора роста β (ТФРβ). Вопреки ожиданиям при СМ и «марфаноподобных» состояниях потеря функции и мутации в гене, который кодирует фибриллин, связывающий ТФРβ, приводят к повышению, а не уменьшению внеклеточного уровня ТФРβ – так называемому ТФРβ-парадоксу [5].
Изучение экспрессии ТФРβ1 в крупных научно-клинических центрах с фокусом в стенке аорты обусловлено причастностью этой молекулы к жизненно угрожающему состоянию – разрыву/эластолизу аорты, имеющему высокое медико-социальный значение. В связи с этим пациенты с СМ чаще всего наблюдаются врачами-кардиологами. Однако с развитием высокотехнологичных методов профилактики и благодаря своевременной установке аортальных аллографтов продолжительность жизни таких пациентов может достигать среднепопуляционной.
В 2017 г. в престижном журнале British Medical Journal была опубликована статья по изучению ассоциации злокачественных новообразований с СМ в тайваньской популяции [6]. Анализ более одного миллиона (1 153 137) случаев заболевания раком позволил впервые установить, что при СМ отмечается высокий риск наличия всех видов злокачественных опухолей (OR=3,991). Примечательно, что при этом было выявлено резкое увеличение вероятности рака пищевода и рака желудка – в 10 и в 5 раз соответственно.
Современные представления о развитии рака желудка базируются на модели Correa P. (1985) [7] и представляют собой каскад морфологических последовательных изменений слизистой оболочки желудка от нормального ее состояния до ракового фенотипа, включающих хронический активный гастрит, атрофический гастрит, метаплазию и дисплазию с высоким риском трансформации в рак.
Данные Киотского глобального консенсуса [8] свидетельствуют о существовании более 25 форм гастрита (радиационный, химический, H. pylori-ассоциированный гастрит, аутоиммунный, при васкулитах, при системных заболеваниях и др.), причем риск трансформации в рак желудка особых форм гастрита в каждом конкретном случае индивидуален.
При СМ основным патогенетическим звеном выступает усиление активности ТФРβ в тканях (в связи с генетическим дефектом фибриллина-1), в то же время экспрессия ТФРβ нарастает и на этапах каскада Корреа. Изучение роли ТФРβ1, ассоциированного с ННСТ, которая до настоящего времени не проводилась, является важной задачей для понимания фундаментальных основ прогрессирования и прогноза хронического гастрита.
В ряде исследований показано влияние ННСТ как дополнительного фактора на процесс формирования гастроинтестинальной патологии, протекающей с атипичной клинической картиной, патоморфологическими особенностями (ранний атрофический гастрит), относительной ролью инфекции H. pylori, однако влияние ННСТ на развитие предраковых состояний желудка в должной мере не изучалось.
Целью нашего исследования стало выявление патогенетических механизмов развития предраковых изменений в слизистой оболочке желудка у пациентов с СМ и марфаноподобными состояниями на основе молекулярно- морфологических особенностей хронического гастрита.
МАТЕРИАЛ И МЕТОДЫ
Исследование являлось одномоментным по типу «случай–контроль» с применением направленного отбора пациентов с признаками ННСТ и хроническим гастритом.
Критерии включения – молодой возраст, стационарные или амбулаторные пациенты с ранее установленным и подтвержденным диагнозом СМ, МПФ с различными вариантами хронического гастрита.
Критерии исключения – сопутствующие заболевания, которые могли оказывать влияние на течение и прогрессирование хронического гастрита, органическая патология органов желудочно-кишечного тракта (в том числе аутоиммунный гастрит), систематическое и/или эпизодическое применение препаратов, не входящих в стандарты лечения хронического гастрита и потенциально способных повлиять на результаты исследования, наличие признаков иного моногенного заболевания соединительной ткани (синдрома гипермобильности суставов, синдрома пролапса митрального клапана, синдрома Элерса–Данло и др.) либо неклассифицированного/гипермобильного фенотипа.
Было обследовано 89 пациентов, находящихся на лечении в гастроэнтерологическом отделении ГУ «432 Главный военный клинический медицинский центр». Пациенты с хроническим гастритом были распределены в три группы:
- 1-я группа – пациенты с СМ (n=23; 33,3±10,6 лет; соотношение женщин и мужчин 8/15);
- 2-я группа – пациенты с МПФ (n=28; 28,4±9,3 лет; соотношение женщин и мужчин 6/22);
- 3-я группа – контрольная группа (n=38; 30,4±11,0 лет; соотношение женщин и мужчин 10/28), включившая пациентов с минимальной частотой проявлений ННСТ, не превышающих таковую в популяции (1–2 признака).
Диагностика СМ проводилась на основе Гентских критериев 2010 г. с учетом оценки размера корня аорты по Z-критерию [9]. Для дифференциальной диагностики с другими заболеваниями соединительной ткани применяли критерии диагностики синдрома гипермобильности суставов Бейтона в редакции Грэхема (2003), синдрома Элерса–Данло (1998), Билса и др. Оценивались внешние фены, включающие малые аномалии развития (стигмы дисэмбриогенеза), и внутренние (висцеральные) фены ННСТ.
Диагностика МПФ производилась на основании Национальных клинических рекомендаций Республики Беларусь (2014). В ряде случаев СМ подтверждался молекулярно-генетическим анализом патологических мутаций в гене FBN1 с использованием технологии высокоэффективного секвенирования.
В группе участников с СМ 11 пациентам (47,8%) были выполнены различные виды оперативных вмешательств по протезированию аорты, аортального клапана в период с 2007 по 2013 г. В группах пациентов с МПФ и в контрольной группе анамнестические данные об оперативных вмешательствах были отрицательными. Обращает внимание, что семейный анамнез заболеваемости раком желудка у родственников первой степени (братьев и сестер, родителей) во всех группах пациентов был отрицательным.
Лабораторные методы исследования включали общий анализ крови, общий анализ мочи, биохимический анализ крови, пробу Реберга, липидограмму, копрограмму, анализ кала на скрытую кровь. Активную инфекцию Н. pylori подтверждали серологическим методом с определением титра антител к Н. pylori, превышающем 30 EUI. Всем пациентам проводили иммуноферментный анализ (DRG ELISA № EIA3607) на наличие антител к париетальным клеткам желудка с целью исключения из групп исследования лиц с аутоиммунным гастритом.
Из инструментальных методов исследования использовались электрокардиография (ЭКГ), эхокардиография (ЭхоКГ), ультразвуковое исследование (УЗИ) органов брюшной полости, почек, щитовидной железы, брахиоцефальных артерий, брюшного отдела аорты.
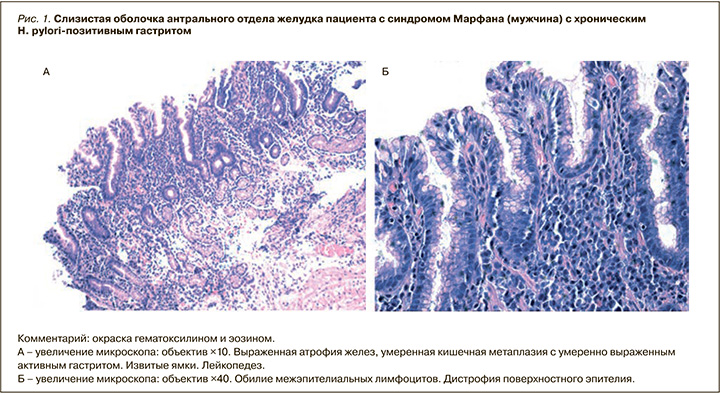
Гастроскопия выполнялась на аппарате Olympus GIF V70 с прицельной биопсией слизистой оболочки желудка (по 2 кусочка из антрального и фундального отделов, а также 1 из угла желудка). Оценку гистологических препаратов проводили в соответствии с Сиднейской системой с применением визуально-аналоговой шкалы с полуколичественной оценкой степени выраженности инфицированности Н. pylori, активности и выраженности воспаления. Степень тяжести хронического атрофического гастрита определялась в зависимости от стадии по градационной системе OLGA: легкий атрофический гастрит – стадия I; умеренный атрофический гастрит – стадия II; тяжелый атрофический гастрит – стадии III, IV.
Для количественной оценки соединительнотканных компонентов слизистой оболочки применили окраску по Массону.
Окраску гастробиоптатов проводили иммуногистохимическим методом с использованием антител к α-гладкомышечному актину (αГМА), коллагену III типа, ТФРβ1. В качестве позитивного контроля использовали ткани и органы, рекомендованные фирмой-производителем, в качестве негативного контроля – исключение первичного антитела. Микропрепараты фотографировали в 5 полях зрения (объектив×40). Оценка морфологических особенностей, а также иммуногистохимической реакции осуществлялась с использованием алгоритмов расчета показателя экспрессии, равного отношению числа позитивных пикселей к их общему числу.
В исследовании использовали стандартные пакеты программ Microsoft Excel 2007, STATISTICA 10 (StatSoft Inc.). Доверительный интервал рассчитывали методом Клоппера–Пирсона. Для сравнения частот бинарных признаков применяли метод двухпольной таблицы с расчетом отношения шансов.
При частоте изучаемого события менее 5 наблюдений использовали точный критерий Фишера или χ2 с поправкой Йетса на непрерывность. При множественном сравнении применяли метод Краскела–Уоллиса (H). Сравнение двух независимых групп проводили с помощью U-критерия Манна–Уитни. Анализ взаимосвязей между признаками осуществляли с помощью корреляционного анализа. При нелинейной связи между качественными (порядковыми) признаками, небольшом числе наблюдений сравниваемых пар признаков использовали вычисление коэффициента ранговых корреляций Спирмена (rS). При расчете корреляционной связи между качественными и количественными признаками использовали метод Кендалл–Тау (τ). Результаты признавались статистически значимыми при p <0,05.
Результаты
Анализ частоты атрофических изменений антральной/фундальной слизистой оболочки желудка представлен в виде таблицы 1.
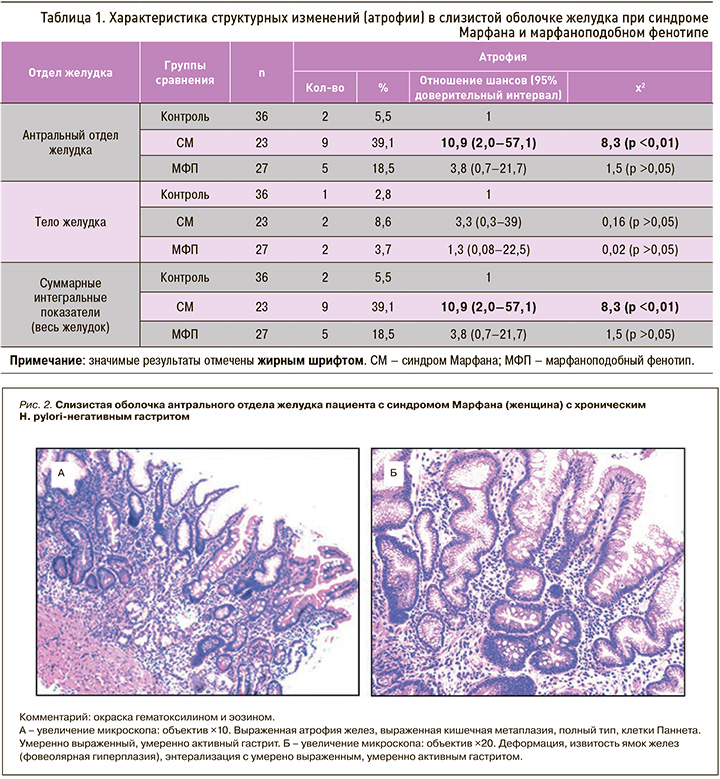
Максимальная частота встречаемости атрофических изменений отмечалась в антральной слизистой оболочке в 1-й группе – до 39,1%, что было значительно (в 2 раза) выше, чем во 2-й группе (18,5%; χ2=1,5; p >0,05), и высоко достоверно выше, чем в группе контроля (5,5%; χ2=8,3; p <0,01) (см. табл. 1, рис. 1).
Характер хронического атрофического гастрита носил мультифокальный характер (с поражением фундальной и антральной слизистой оболочки желудка) в 8,6% случаев у лиц с СМ: этот показатель в 2,5 и 3 раза превышал аналогичные значения во 2-й группе и контроле (3,7 и 2,8% соответственно).
Результаты оценки степени тяжести хронического атрофического гастрита в зависимости от стадии по градационной системе OLGA представлены в таблице 2.
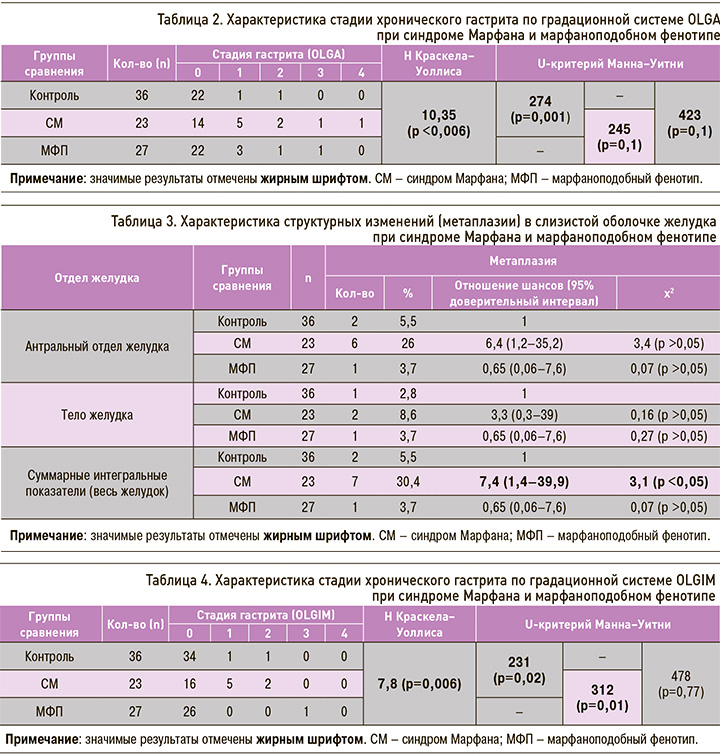
Анализ, представленный в таблице 2, демонстрирует достоверные различия в степени тяжести хронического гастрита в сравниваемых группах (H-критерий Краскела–Уоллиса = 10,35; р <0,006). При погрупповом сравнении методом Манна–Уитни выявлено более тяжелое течение хронического гастрита в 1-й группе в сравнении со 2-й (U=245; р=0,1) и 3-й группами (U=274; р=0,001). У пациентов в группе с МФП также отмечалось более тяжелое течение хронического гастрита, нежели в группе контроля (U=423; р=0,1).
Анализ частоты выявления кишечной метаплазии антральной/фундальной слизистой оболочки желудка представлен в таблице 3 и на рисунке 2.
Изучение более глубоких структурных изменений в ходе общего морфологического исследования при СМ выявило тенденцию к нарастанию частоты кишечной метаплазии в слизистой оболочке антрального отдела и тела желудка – до 30,4 и 8,6% против 5,5 и 2,8% в группе контроля соответственно. При этом значимость интегральных показателей кишечной метаплазии в слизистой оболочке желудка у пациентов с СМ возрастала (χ2=3,1; p <0,05) (рис. 3). Различий в частоте и распространенности метаплазии у лиц с МФП в сравнении с контролем выявлено не было (p <0,05).
Проведена оценка степени тяжести хронического гастрита с кишечной метаплазией желудочного эпителия в зависимости от стадии по градационной системе OLGIM (табл. 4).
Анализ результатов, представленных в таблице 4, демонстрирует достоверные различия в степени тяжести хронического гастрита, определяемой в зависимости от стадии по градационной системе OLGIM в сравниваемых группах (H-критерий Краскела–Уоллиса = 7,8; р=0,006). При межгрупповом сравнении методом Манна–Уитни степень тяжести хронического гастрита в 1-й группе значимо превышала таковую во 2-й (U=312; р=0,01) и 3-й группах (U=231; р=0,02) при отсутствии различий между 2-й и 3-й группами (U=478; р=0,77).
В нашем исследовании на фоне СМ выявлена крайне высокая частота встречаемости кишечной метаплазии слизистой оболочки желудка – до 30 против 7,4% в контроле (p <0,05); при этом выявлялась сильная ассоциативная связь между наличием атрофии и метаплазии в гистологических препаратах слизистой оболочки желудка (коэффициент Спирмена rS =0,74; p <0,05). У 77% (7/9) пациентов с СМ с атрофическим гастритом была выявлена кишечная метаплазия, что убедительно свидетельствует об определенности (истинности) атрофии в этих случаях.
У пациентов с СМ 1-я стадия, соответствующая легкому атрофическому гастриту, была выявлена в 21,7% (5/23) случаев, 2-я стадия (умеренный атрофический гастрит) – в 8,6% (2/23). Тяжелый атрофический гастрит (3, 4 стадии) был диагностирован у 8,6% (2/23) пациентов.
В группе МФП отмечалось более легкое течение хронического гастрита: 1-я стадия была выявлена у 11,1% (3/27) пациентов, 2-я стадия – у 3,7% (1/27), 3-я стадия – у 3,7% (1/27).
В группе контроля атрофический гастрит 1-й стадии был обнаружен у 2,7% (1/36) пациентов, 2-й стадии – у 2,7% (1/36), атрофический гастрит 3–4-й стадий не встречался (рис. 3).
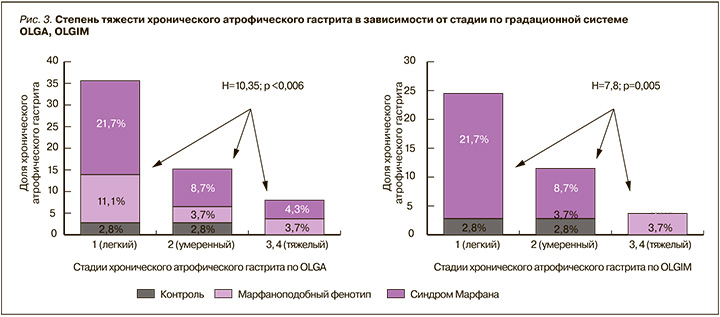
У пациентов с СМ кишечная метаплазия 1-й стадии была диагностирована в 21,7% (5/23) случаев, 2-й стадии – в 8,6% (2/23), пациентов с 3-й и 4-й стадиями выявлено не было. В группе пациентов с МФП кишечная метаплазия желудочного эпителия имелась только у 3,7% (1/27) пациентов и соответствовала 3 стадии градационной шкалы OLGIM. В группе контроля кишечная метаплазия 1-й стадии была обнаружена у 2,7% (1/36) пациентов, во 2-й – у 2,7% (1/36), метаплазия 3-й и 4-й стадий не встречалась.
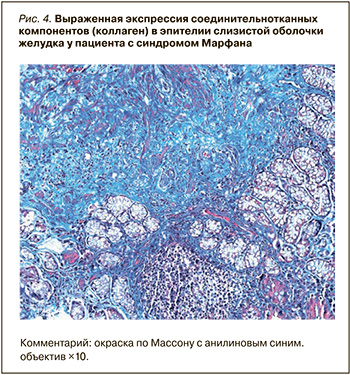 Для расчета показателя экспрессии соединительнотканных компонентов мы применили специальную окраску по Массону, которая рекомендована для окрашивания соединительной ткани. Она позволяет выявить ядра, коллаген, интрацеллюлярные волокна и другие соединительнотканные компоненты, окрашивая их в оттенки синего, а эпителиальные компоненты ‒ в оттенки красного (рис. 4).
Для расчета показателя экспрессии соединительнотканных компонентов мы применили специальную окраску по Массону, которая рекомендована для окрашивания соединительной ткани. Она позволяет выявить ядра, коллаген, интрацеллюлярные волокна и другие соединительнотканные компоненты, окрашивая их в оттенки синего, а эпителиальные компоненты ‒ в оттенки красного (рис. 4).
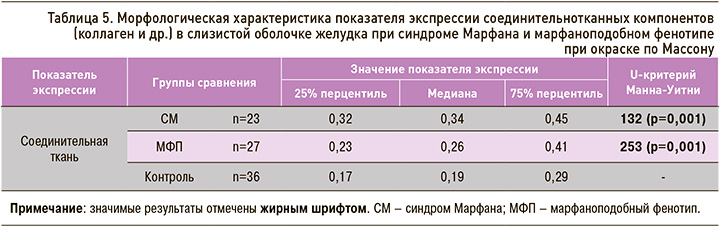
Данные таблицы 5 свидетельствуют о достоверных различиях в показателе экспрессии соединительнотканных компонентов: максимальная экспрессия отмечена у пациентов с СМ (U=132; p=0,001) и МФП (U=253; p=0,001) в сравнении с группой контроля без статистических различий при сравнении между 1-й и 2-й группами (p=0,28).
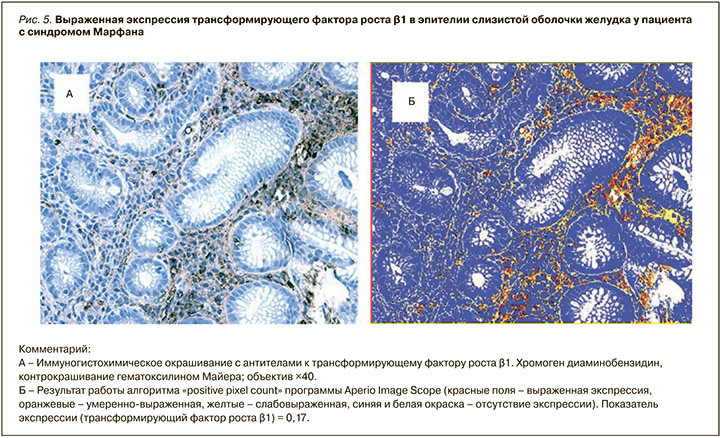
В целом при иммуногистохимическом исследовании микропрепаратов позитивное окрашивание с антителами к ТФРβ1 было выявлено во всех исследованных гистологических срезах. Экспрессия ТФРβ1 была представлена в виде гомогенного или мелкогранулярного окрашивания эпителия и интерстициальной ткани в коричневый цвет различной степени интенсивности и в виде умеренного окрашивания цитоплазмы интерстициальных миофибробластов, мононуклеаров, эпителиоцитов, располагающихся в области шеечных желез.
Проведенный с применением критерия Манна–Уитни статистический анализ выявил достоверные различия в экспрессии ТФРβ1 в изучаемых группах (табл. 6).
Установлен более высокий показатель экспрессии ТФРβ1 (почти в 2 раза) в группе пациентов с СМ и в меньшей степени во 2-й группе по сравнению с контролем (U=179; p=0,005 и U=370; p=0,09 соответственно) (рис. 5) с подтверждением значимых различий между 1-й и 2-й группами (U=252; p=0,02).
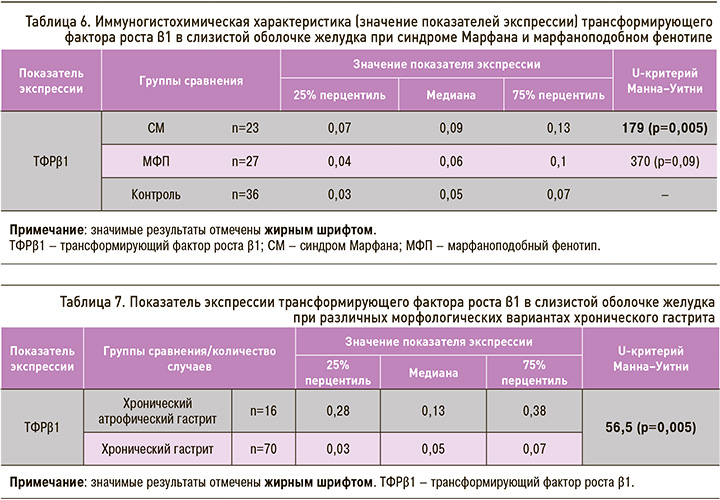
У пациентов с хроническим атрофическим гастритом отмечались более высокие показатели экспрессии ТФРβ (U=56,5; p=0,005) в сравнении с группой пациентов с хроническим гастритом без атрофии (p <0,05) (табл. 7).
ОБСУЖДЕНИЕ
По данным литературы, ТФРβ1 может оказывать действие на процессы в слизистой оболочке желудка [10, 11]. Многие исследования направлены на изучение локализации этого белка и экспрессии рецепторов к ТФРβ1 в зависимости от контаминации H. pylori слизистой оболочки желудка [12]. Вместе с тем значение ТФРβ1 для формирования патологических изменений в слизистой оболочке желудка при таких ННСТ, как СМ и МФП, когда ведущим звеном патогенеза является нарушение регуляции ТФРβ1, в доступной литературе не описано.
В частности, при оценке слизистой оболочки желудка у пациентов с СМ выявлено значимое нарастание атрофии антрального отдела желудка – до 39,1% в сравнении с 7,4% в контроле; это значительно превышает частоту встречаемости хронического атрофического гастрита в популяции (p <0,05). Учитывая, что значительная доля случаев хронического атрофического гастрита приходится на аутоиммунный гастрит, нами исключалась аутоиммунная природа заболевания дополнительным исследованием титра антител к париетальным клеткам желудка в сыворотке крови. Ни в одной из полученных проб титр антител к париетальным клеткам желудка не превышал референтную норму в 10 U/ml, что дает основания исключить аутоиммунный компонент воспаления в патогенезе развития атрофического гастрита в исследуемой группе, группе сравнения и контроля (p >0,05).
Высокая частота встречаемости хронического атрофического гастрита (18,5–39,1%) у пациентов с ННСТ была сопоставима с литературными данными более ранних исследований (до 43%) у лиц с МФП [13], что свидетельствует о воспроизводимости исследования.
Известно, что уменьшение количества желез говорит не об уменьшении их в желудке, а в гистологическом срезе. Такое явление также может наблюдаться при выраженной воспалительной инфильтрации собственной пластинки, сопровождающейся раздвижением желез и соответственно уменьшением их количества в поле зрения морфолога и констатацией о наличии атрофии. В нашем исследовании положительной связи между нейтрофильной инфильтрацией и атрофией не выявлено (τ=0,02; p <0,05), что априорно исключает факт влияния воспалительного компонента в слизистой оболочке желудка на развитие «ложной» атрофии. У пациентов с атрофией слизистой оболочки желудка и отсутствием кишечной метаплазии отмечалась низкая степень воспалительной инфильтрации (медиана 1 и 2 для нейтрофильной и лимфоплазмоцитарной инфильтрации соответственно).
В нашем исследовании при СМ выявлена крайне высокая частота встречаемости кишечной метаплазии слизистой оболочки желудка – до 30% против 7,4% в контроле (p <0,05). При этом отмечалась сильная ассоциативная связь между наличием атрофии и метаплазии в гистологических препаратах слизистой оболочки желудка (коэффициент Спирмена rS=0,74; p <0,05). У 77% (7/9) пациентов с СМ с атрофическим гастритом была выявлена кишечная метаплазия, что убедительно свидетельствует об определенности (истинности) атрофии в этих случаях.
Интерес к изучению кишечной метаплазии обусловлен прежде всего ее связью с раком желудка кишечного типа. В современном представлении метаплазия является процессом адаптации с перестройкой эпителия на иной клеточный фенотип, который более приспособлен к изменившимся условиям [14]. Ранее выделяли тонко- и толстокишечную метаплазию, а также полную и неполную, характеризующие полноту воспроизведения кишечного фенотипа клеток, а термины тонко- и толстокишечная отражали кишечную специализацию [15]. Данные о выделении различных типов метаплазии и их прогностической роли в настоящее время противоречивы [16–19]. В то же время для достоверного утверждения о типе кишечной метаплазии требуются дополнительные методы морфологической диагностики (гистохимическое окрашивание муцинов с применением железистого диамина, орсеина в сочетании с альциановым синим и т.д.) [20], что существенно ограничивает данный подход на практике. Согласно классификации OLGIM [21], кишечную метаплазию оценивают по аналогии с атрофией по визуально-аналоговым шкалам, согласно Сиднейской системе, с оценкой степени метаплазии без указания ее специализации. Такой подход, обеспечивающий стратификацию риска рака желудка на основании обнаружения кишечной метаплазии, необходим для клиницистов и является доступным для широкого круга морфологических лабораторий и специалистов.
Полученные результаты позволяют констатировать, что в исследуемых группах при схожих воспалительных процессах и инфицированности H. pylori (в том числе по локализации, ‒ сообщение в ранней публикации [22]) в 1-й группе уже в молодом возрасте развиваются более глубокие структурные изменения в виде атрофии, кишечной метаплазии слизистой и раннего фиброза собственной пластинки слизистой оболочки желудка.
При этом формирование хронического атрофического гастрита характеризуется значительной экспрессией ТФРβ1 и одновременно сопровождается нарастанием показателя экспрессии компонентов внеклеточного матрикса.
Полученные нами данные свидетельствуют, что степень экспрессии ТФРβ1 различалась в зависимости от степени выраженности фиброза структур межклеточного вещества, в субэпителиальной зоне, а также собственной пластинке с достоверным преобладанием в группе с СМ и МФП.
Таким образом, можно заключить, что при СМ происходит формирование специфического патоморфогенетического варианта хронического атрофического гастрита, обусловленного сигнальной активностью с избыточной экспрессией ключевого стимулятора фиброгенеза – ТФРβ1, способствующего повышенной активации субэпителиальных миофибробластов в слизистой оболочке желудка. При этом обращает на себя внимание отсутствие у пациентов компроментированности по семейной наследственности в отношении рака желудка.
ЗАКЛЮЧЕНИЕ
1. Ассоциированные ННСТ (СМ, МФП) сопровождаются более высокой частотой развития атрофии (до 39%) и кишечной метаплазии (до 30%) слизистой оболочки желудка (против 5% в контроле) и определяют более тяжелое течение хронического гастрита. Хронический гастрит при СМ характеризуется ранним формированием дистрофических и дисрегенераторных изменений слизистой оболочки желудка с развитием истинной атрофии (кишечной метаплазии) в молодом возрасте. Частота диагностики хронического атрофического гастрита выше в 2 раза по сравнению с группой пациентов с МФП и в 6 раз в сравнении с контрольной группой при отсутствии различий по активности и выраженности хронического гастрита, степени и распространенности контаминации H. pylori слизистой оболочки желудка.
2. У пациентов с СМ установлено увеличение распространенности фиброза собственной пластинки слизистой оболочки, желудка с высокой экспрессией соединительнотканных компонентов (U=132; p <0,05). Это объясняется влиянием повышенной экспрессии ТФРβ1 (U=72; p <0,05) и характеризует течение хронического гастрита как неблагоприятное.
3. Увеличение показателя экспрессии ТФРβ1 может выступать в качестве иммуногистохимического признака предраковых состояний в слизистой оболочке желудка, что подтверждается корреляцией между атрофией и экспрессией изучаемых параметров. Во 2-й группе ремоделирование межклеточного вещества также характеризуется менее выраженной тенденцией (p=0,09) к повышению профиброгенной экспрессии ТФРβ1 с накоплением во внеклеточном матриксе соединительнотканных компонентов.



