Заболевание артерий нижних конечностей (ЗАНК) является частым осложнением сахарного диабета (СД) и представляет собой многофакторное заболевание, в основе развития которого лежит атеросклеротическое поражение сосудистого русла. Сегодня ЗАНК рассматривается как мультидисциплинарная проблема: в его диагностике и лечении зачастую принимают участие такие специалисты, как эндокринолог, невролог, кардиолог сосудистый и эндоваскулярный хирург, специалист диабетической стопы, реабилитолог и специалист функциональной диагностики.
Среди основных факторов риска (ФР) развития ЗАНК следует выделить курение, артериальную гипертензию, дислипидемию, повышение гомоцистеина и С-реактивного белка в крови, повышенную вязкость крови и гиперкоагуляционные состояния. Распространенность и заболеваемость ЗАНК выше среди мужчин и увеличивается с возрастом [1].
ДИАГНОСТИКА ЗАБОЛЕВАНИЙ АРТЕРИЙ НИЖНИХ КОНЕЧНОСТЕЙ ПРИ САХАРНОМ ДИАБЕТЕ
У больных СД существуют некоторые особенности течения ЗАНК: это раннее начало и быстрое прогрессирование атеросклеротических изменений, малосимптомное течение вследствие сопутствующей диабетической нейропатии. При этом трофические нарушения мягких тканей нижних конечностей могут развиваться на любой стадии ЗАНК. Пациенты с этим заболеванием имеют высокую вероятность поражения других артериальных бассейнов, а именно коронарного русла и брахиоцефальных артерий. В связи с этим скрининг и своевременная диагностика ЗАНК имеют большое значение, а коррекция модифицируемых факторов риска развития атеросклероза предупреждает развитие сердечно-сосудистых катастроф (острого инфаркта миокарда, острого нарушения мозгового кровообращения) [2].
Для скрининга ЗАНК используется простой метод определения лодыжечно-плечевого индекса (ЛПИ), который рассчитывается как соотношение систолического артериального давления (АД) в артериях стопы и систолического АД в плечевой артерии. Нормальные значения ЛПИ составляют 0,9–1,2, ЛПИ <0,9 свидетельствует о стенонизирующем поражении артерий нижних конечностей [3]. ЛПИ >1,40 у пациентов с СД, как правило, обусловлен наличием кальциноза медии (артериосклероза Менкеберга) [4]. Такое изменение артерий не вызывает их сужения, но делает ригидными, что приводит к завышению АД на 20–30% при измерении тонометром. Для устранения этой погрешности проводится измерение АД в пальцевой артерии и определяется пальце-плечевой индекс (ППИ), поскольку артерии этого калибра практически не подвержены артериосклерозу Менкеберга, и результат измерения АД будет более свободен от искажений [5]. Значение ППИ <0,70 следует рассматривать в качестве диагностического критерия ЗАНК [6].
Оценивать ЛПИ необходимо при постановке диагноза СД, а затем, если исходно результат был нормальный, спустя 10 лет после выявления СД. При наличии других факторов риска, например курения, повторное исследование необходимо выполнить через 5 лет после постановки диагноза. Вместе с тем оценивать симптомы ЗАНК и исследовать пульсацию артерии у больных СД необходимо ежегодно [7].
Среди инструментальных методов обследования пациентов с СД и ЗАНК следует выделить ультразвуковое дуплексное сканирование (УЗДС), магнитно-резонансную ангиографию (МРА), мультиспиральную компьютерную ангиографию (МСКТА), рентгенконтрастную ангиографию. Методом диагностики первой линии служит УЗДС, поскольку оно дает практически полную информацию относительно анатомии и гемодинамики артерий. УЗДС имеет чувствительность 85–90% и специфичность >95% для выявления стеноза >50%.
Методом второй линии инструментального обследования считается МРА, среди преимуществ которой следует выделить отсутствие лучевой нагрузки и более низкий риск нефротоксичности в сравнении с МСКТА. Чувствительность и специфичность МРА составляют 95% для диагностики сегментарного стеноза и окклюзии. Однако МРА имеет тенденцию преувеличения степени стеноза, в связи с чем существуют ограничения для оценки степени тяжести стеноза в случае выраженного кальциноза, что, в свою очередь, ограничивает возможность выбора места анастомоза для хирургического шунтирования.
МСКТА – оптимальный метод визуализации аорто-подвздошного сегмента и проксимальных отделов артерий нижних конечностей у пациентов с СД. Этот метод инструментальной диагностики позволяет с высокой точностью исключить артериальные аневризмы, оценить структуру сосудистой стенки. По результатам проведенного метаанализа, чувствительность и специфичность МСКТА для выявления аорто-подвздошных стенозов >50% составили 96 и 98% соответственно, с аналогичной чувствительностью (97%) и специфичностью (94%) для бедренно-подколенной области.
Статус «золотого стандарта» в диагностике ЗАНК сегодня имеет рентгенконтрастная ангиография. Метод является инвазивным и может применяться при неинформативности других методов исследования [2, 8].
Кроме инструментальной оценки состояния артериального русла, при ЗАНК важно проводить и оценку перфузии мягких тканей, для чего выполняется транскутанная оксиметрия и измерение перфузионного давления кожи. С помощью транскутанной оксиметрии оценивают тяжесть ишемии конечности у пациентов с клиническими симптомами ЗАНК, прогнозируют заживление язв, эффективность консервативного лечения, исходы реваскуляризации, определяют уровень ампутации конечности. Измерение перфузионного давления кожи – метод оценки кровяного давления, необходимого для восстановления капиллярного кровотока после индуцированной окклюзии [2].
В клинической картине ЗАНК вычленяют несколько стадий, которые представляют собой звенья единого патологического процесса. Принято выделять асимптомное течение, стадию перемежающейся хромоты и критическую ишемию конечности. Стадия асимптомного течения ЗАНК является доклинической и характеризуется атеросклеротическим поражением сосудов, но отсутствием жалоб и гемодинамически значимых стенозов. Перемежающая хромота – это синдром, характеризующийся преходящей хронической ишемией конечности и клинически проявляющийся недомоганием, дискомфортом или болью в мышцах нижней конечности при физической нагрузке. При перемежающейся хромоте характер нарушений гемодинамики таков, что перфузия тканей в зоне ишемии обеспечивает доставку кислорода и субстратов в условиях обычного объема потребления, но оказывается недостаточной в условиях физической нагрузки. В этом и заключается патофизиологическая сущность данной стадии субкомпенсации ишемии.
Критическая ишемия нижней конечности (КИНК) – это синдром декомпенсации хронической артериальной недостаточности конечности вследствие ЗАНК, основными симптомами которого выступают не купируемая наркотическими анальгетиками боль в покое и/или наличие язвенно-некротического процесса стопы [1]. Критерии постановки диагноза КИНК с риском потери конечности [2]:
- в отсутствии трофических нарушений покровных тканей – систолическое лодыжечное АД <50 мм рт.ст. или пальцевое давление <30 мм рт. ст., транскутанное напряжение кислорода в поверхностных мягких тканях (TcpO2) <25 мм рт.ст., перфузионное давление кожи <40 мм рт.ст. (низкий риск);
- при наличии язвы или гангрены – систолическое лодыжечное АД <70 мм рт.ст. или пальцевое давление <50 мм рт.ст., TcpO2 <25 мм рт.ст., перфузионное давление кожи <40 мм рт.ст. (умеренный и высокий риск).
ТЕРАПИЯ ЗАБОЛЕВАНИЙ АРТЕРИЙ НИЖНИХ КОНЕЧНОСТЕЙ ПРИ САХАРНОМ ДИАБЕТЕ
Профилактика и лечение пациентов с ЗАНК и СД включает в первую очередь коррекцию всех возможных модифицируемых факторов риска, в частности отказ от курения, достижение и поддержание целевых показателей углеводного и липидного обменов. Результаты нескольких обсервационных исследований позволяют предположить, что отказ от курения ассоциирован с более низкой частотой сердечно-сосудистых ишемических и цереброваскулярных событий, неблагоприятных событий, связанных с конечностями, стеноза в области анастомозов, тромбоза сосудистого протеза, ампутации и смерти у пациентов с ЗАНК [9, 10]. Необходимо также отметить, что достижение целевых цифр АД, контроль массы тела и расширение двигательной активности являются основными компонентами в профилактике и лечении ЗАНК у пациентов с СД. Например, пациентам с перемежающейся хромотой при отсутствии противопоказаний следует рекомендовать проведение программ с физическими тренировками (>30–45 мин, ≥3 раза/нед), поскольку регулярные интенсивные тренировки способствуют увеличению дистанции ходьбы [7].
Важный аспект в лечении и профилактике ЗАНК у пациентов с СД – назначение антиагрегантной терапии, которая отличается на различных стадиях течения ЗАНК. Так, при асимптомном течении пациентам назначение антитромботической терапии не показано, однако монотерапия может быть рассмотрена при наличии атеросклероза других артериальных бассейнов (сонных, коронарных, почечных артерий и т.д.). В данном случае клопидогрел может быть более предпочтительным по сравнению с ацетилсалициловой кислотой (АСК) [2]. Так, в исследовании CAPRIE через 3 года клопидогрел продемонстрировал преимущество перед АСК в подгруппе пациентов с клиническим выраженными ЗАНК (n=6452) в отношении значительного снижения риска сердечно-сосудистой смертности (отношение риска (ОР) 0,76; 95% доверительный интервал (ДИ) 0,64–0,91) и больших сердечно-сосудистых событий (ОР 0,78; 95% ДИ 0,65–0,93) со схожими показателями в подгруппе пациентов с ЗАНК и СД [11].
На стадии клинических проявлений ЗАНК, когда проведение реваскуляризации еще не показано, пациентам также рекомендована однокомпонентная антиагрегантантная терапия – АСК в дозе 75–100 мг или клопидогрел в 75 мг/сут. В то же время при остром коронарном синдроме и/или чрескожном коронарном вмешательстве (менее 1 года), стентировании последней проходимой коронарной артерией, многососудистом поражении коронарных артерий у больных с неполной реваскуляризацией стоит рассмотреть вопрос о назначении двойной антиагрегантной терапии.
При наличии у пациента перемежающейся хромоты, которая резко снижает качество жизни пациента, или на стадии критической ишемии нижней конечности, когда существует риск потери конечности, дальнейшая антиагрегантная терапия будет зависеть от выбранного метода радикального лечения. Например, при проведении эндоваскулярного лечения в течение первого месяца после вмешательства пациентам показана двойная антиагрегантная терапия, далее предпочтение отдается монотерапии АСК или клопидогрелем [2]. По данным исследования CHARISMA (n=3906), в подгруппе пациентов с ЗАНК длительная двойная антиагрегантная терапия приводила к снижению частоты развития инфаркта миокарда (ОР 0,63; 95% ДИ 0,42–0,95), но при этом повышала риск развития других сосудистых осложнений, таких как крупные кровотечения и кровотечения с летальным исходом (ОР 1,99; 95% ДИ 1,69–2,34) [12]. После проведенного шунтирования, как правило, используют антиагрегантные препараты. Как продемонстрировано в метаанализе, включавшем 952 пациента, проходимость шунта была значительно лучше при использовании АСК по сравнению с плацебо (ОР 0,42; p= 0,01) [13]. Однако существует также и вариант назначения антикоагуллянтной терапии (варфарина или новых оральных антикогулянтов). Так, в исследовании Dutch Bypass Oral Anticoagulants or Aspirin Study не было обнаружено различий в проходимости шунта при приеме АСК и антагониста витамина К в течение 2 лет наблюдения (ОР 0,64; 95% ДИ 0,25–1,63). Не было получено различий и в частоте летальных исходов (OР 1,02; 95% ДИ 0,83–1,26) и частоте ампутаций (OР 0,99; 95% ДИ 0,75–1,30). На фоне применения антагониста витамина К по сравнению с АСК было отмечено значительно меньшее число окклюзий аутовенозных шунтов (ОР 0,69; 95% ДИ 0,51–0,94). В то же время риск развития клинически значимого кровотечения при использовании антагониста витамина К с высоким целевым МНО (>3,0) удваивался [14].
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациент И., 66 лет, госпитализирован в отделение эндокринологии в плановом порядке.
Жалобы: периодическая сухость во рту, боли в ногах в покое, перемежающаяся хромота при прохождении расстояния в 100 м.
Анамнез болезни: СД диагностирован в 2000 г., когда стал отмечать появление сухости во рту, жажды (выпивал более 5 л жидкости в сутки), учащенное мочеиспускание, в том числе в ночное время. С вышеперечисленными жалобами обратился в поликлинику по месту жительства, где была выявлена гликемия 15 ммоль/л. На момент манифестации СД была назначена сахароснижающая терапия: гликлазид по 60 мг утром, метформин по 850 мг 2 раза/сут. В 2015 г. сахароснижающая терапия была скорректирована: гликлазид по 60 мг утром, вилдаглиптин по 50 мг утром и вечером. Уровень гликемии на фоне такой терапии 10–14 ммоль/л. Гипогликемические состояния не отмечал.
В июле 2019 г. после ушиба левой стопы появился отек, покраснение 4 пальца левой стопы, в течение недели стали нарастать отек, болезненность, появился язвенный дефект в области 4-го пальца левой стопы, наблюдалось потемнение кожных покровов. Пациент был направлен на стационарное лечение в хирургическое отделение, где ему была выполнена ампутация 4 пальца левой стопы по поводу гангрены. Проведена транслюминальная баллонная ангиопластика и стентирование левой подколенной артерии от 11.07.2019.
Анамнез жизни: острый инфаркт миокарда в 1996 г. ЭКС в 1996 г. по поводу атриовентрикулярной (АВ) блокады. Хроническая аневризма заднебазальной области левого желудочка. Гипертоническая болезнь с максимальными показателями АД до 180/100 мм рт.ст., адаптирован к 140/90 мм рт.ст. Получает амбулаторно: эналаприл по 5 мг утром и вечером, бисопролол по 10 мг утром, амлодипин по 5 мг/сут, торасемид по 5 мг утром, аторвастатин по 10 мг вечером, АСК по 100 мг вечером.
Вредные привычки: курит около 30 лет по 10–15 сигарет в день.
Объективное обследование: рост 172 см, вес 75 кг, индекс массы тела (ИМТ) 23,5 кг/м2. Сознание ясное. Температура тела 36,6 °С. Кожный покров обычной окраски. Отеки стоп, голеней. Пульсация на периферических артериях снижена. Костно-суставная система: ампутация 4-го пальца левой стопы. Дыхание везикулярное, хрипов нет. Частота дыхательных движений (ЧДД) 19/мин. Тоны сердца приглушены, ритмичные. Пульс 85/мин, удовлетворительного наполнения и напряжения. Частота сердечных сокращений (ЧСС) 85/мин. АД 150/95 мм рт.ст. ЛПИ=0,8. Живот мягкий, безболезненный. Печень увеличена +2 см. Стул регулярный, оформленный. Симптом поколачивания отрицательный с обеих сторон. Мочеиспускание свободное, безболезненное.
Локальный статус: кожа стоп сухая. Левая стопа бледная, при пальпации прохладная. Вибрационная и температурная чувствительность снижены.
Данные лабораторных исследований
Общий анализ крови: без особенностей.
Общий анализ мочи: без особенностей.
Биохимический анализ крови: глюкоза – 14,2 ммоль/л; общий белок – 57,9 г/л (64–83); мочевина – 11,6 ммоль/л (2,8–8,3); креатинин – 120,3 мкмоль/л (45–115); билирубин общий – 16,7 мкмоль/л (3,5–21); холестерин общий – 4,0 мкмоль/л (2,9–6,2); триглицериды – 1,1 ммоль/л (0–1,71); калий – 4,10 ммоль/л (3,4–5,6); натрий – 140,0 ммоль/л (135–148); аланинаминотрансфераза (АЛТ) – 29,8 МЕ/л (0–50); аспартатаминотрансфераза (АСТ) – 30,1 МЕ/л (0–50); липопротеиды высокой плотности (ЛПВП) – 1,00 ммоль/л (1,03–1,55).
СКФ по формуле CKD-EPI: 54 мл/мин/1,73м2.
Гликированный гемоглобин: 11,90%.
Иммунохимические исследования: С-пептид – 1,11 нг/мл (0,9–7,1).
Гликемический профиль: см. таблицу 1.
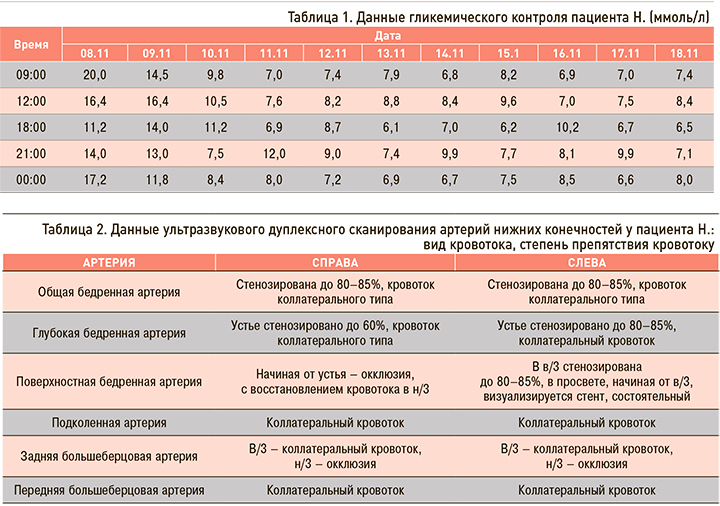
Данные инструментальных исследований
Электрокардиография (ЭКГ): предсердный ЭКС. Отклонение ЭОС влево. Полная блокада 2-х левых в.п. Гиса с преобладанием левой задней в.п. Гиса. АВ-блокада 1 ст., выраженные изменения миокарда.
Ультразвуковое исследование (УЗИ) органов брюшной полости, почек, плевральной полости: эхографическая картина портальной гипертензии, увеличения и диффузных изменений печени, диффузных изменений поджелудочной железы, хронического пиелонефрита, кисты правой почки, свободной жидкости в плевральных полостях.
Эзофагогастродуоденоскония: недостаточность кардии.
УЗДС артерий нижних конечностей: таблица 2.
Заключение: УЗ-признаки атеросклеротического стеноокклюзирующего поражения магистральных артерий нижних конечностей.
Результаты ангиографии брюшной аорты, артерий таза и нижних конечностей: таблица 3.
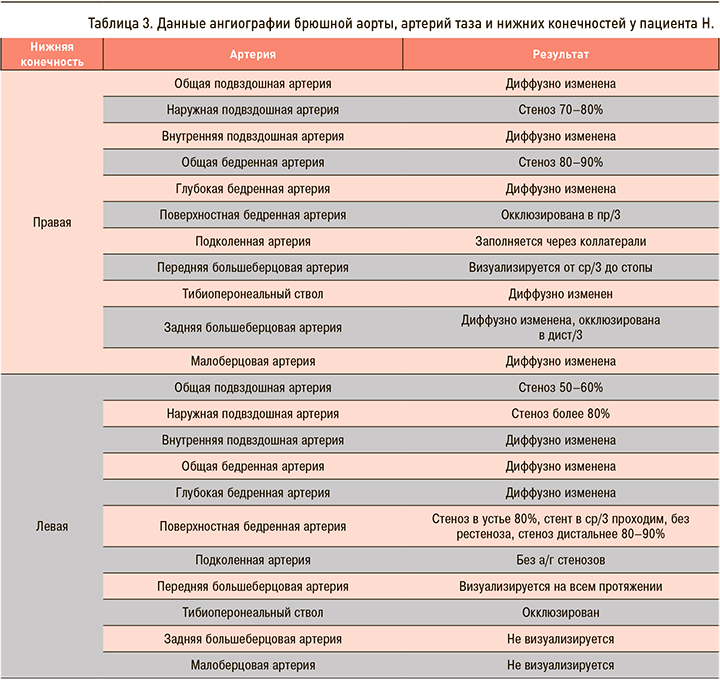
Заключение консультантов
Офтальмолог: OU. Начальная катаракта. Пролиферативная диабетическая ретинопатия.
Диагноз
Основное заболевание: сахарный диабет 2 типа. Целевой уровень гликированного гемоглобина (HbA1c) <7,5%.
Осложнения: диабетическая пролиферативная ретинопатия. Облитерирующий атеросклероз артерий нижних конечностей. Синдром диабетической стопы, нейроишемическая форма. Ампутация 4-го пальца левой стопы от 07.2019 г. Транслюминальная баллонная ангиопластика (ТЛБАП) и стентирование левой подколенной артерии (ПоА) от 11.07.2019.
Сопутствующие заболевания. ИБС: Постинфарктный кардиосклероз. Острый инфаркт миокарда от 1996 г. Хроническая аневризма левого желудочка. Постоянный электрокардиостимулятор (ПЭКС) от 1996 г. Гипертоническая болезнь 3 ст. Риск сердечно-сосудистых осложнений (ССО) 4, недостаточность кровообращения (НК) 2Б. Недостаточность кардии. Хронический панкреатит вне обострения. Жировой гепатоз. Хронический пиелонефрит вне обострения. Киста правой почки. Начальная катаракта.
ОБСУЖДЕНИЕ
У пациента с СД 2 типа, нецелевыми показателями углеводного обмена и АД, длительным стажем курения имеет место ЗАНК. После проведенного обследования, консультации эндоваскулярного хирурга больному рекомендовано оперативное лечение. С целью восстановления кровотока левой нижней конечности под местной анестезией выполнено плановое оперативное вмешательство: механическая реканализация и ангиопластика поверхностной бедренной артерии, ангиопластика общей бедренной, наружной подвздошной артерий слева, стентирование наружной подвздошной, общей бедренной артерии слева стентом EverFlex 8×100 мм. После оперативного лечения достигнут положительный клинический эффект в виде потепления левой стопы, купирования болей в левой стопе, увеличение проходимой дистанции.
Таким образом, комплексное ведение больных с СД и нарушением магистрального кровотока артерий нижних конечностей предусматривает решение следующих вопросов:
- Достижение целевых показателей углеводного обмена.
- Восстановление магистрального кровотока.
- Коррекция АД.
- Назначение антиагрегантной терапии.
- Коррекция липидного спектра крови.
- Соблюдение режима дозированной ходьбы.
- Отказ от курения.


