Артериальная гипертензия (АГ) является многоуровневой проблемой современной кардиологии и медицины в целом. С одной стороны, она служит одним из основных факторов риска (ФР) развития сердечно-сосудистых заболеваний (ССЗ) и их осложнений, а с другой – самостоятельным заболеванием [1, 2].
К важным составляющим рациональной фармакотерапии АГ [3] относят коморбидность/мультиморбидность и лекарственную безопасность [4, 5].
На сегодня не существует идеального препарата или идеальной комбинации, которые были бы эффективны у любого пациента с повышением артериального давления (АД). У каждой группы лекарственных средств есть преимущественные показания к применению, а также относительные и абсолютные противопоказания. В связи с этим наличие коморбидных/мультиморбидных состояний и безопасность медикаментозного лечения, безусловно, требуют учета при лечении пациентов с АГ [6–8].
Рассмотрим клинический пример выбора рациональной фармакотерапии у пациента с АГ.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациент Ш., 56 лет, охранник автостоянки, жалуется на головную боль, головокружение, мелькание «мушек» перед глазами.
Анамнез: пациент около 12 лет отмечает периодическое повышение АД, курит около 30 лет до 2 пачек в сутки, в течение 15 лет работал на шахте в Кемеровской области, злоупотребляет соленой едой. В семейном анамнезе имеются указания на наличие у дедушки инсульта, у бабушки – деменции. Родители страдали АГ и СД 2 типа.
Данные объективного обследования: состояние относительно удовлетворительное. Индекс массы тела 24 кг/м2, левая граница относительной сердечной тупости смещена влево на 1,5 см, тоны сердца ритмичные, акцент ІІ тона над аортой, АД 180/100 мм рт.ст., частота сердечных сокращений (ЧСС) 68/мин. В течение двух последних месяцев АД находилось в пределах 150–180/90–100 мм рт.ст. на фоне приема фиксированной комбинации ингибитора АПФ и гидрохлоротиазида. При систолическом АД 170–180 мм рт.ст. пациент дополнительно использует коротко действующий ингибитор АПФ, который снижает АД, но после его приема отмечает появление кашля.
Данные исследования функции внешнего дыхания (ФВД): индекс Тиффно (ОФВ1/ФЖЕЛ от должного) составляет 64%, ОФВ1 (от должного) составляет 61%, что в сочетании с данными анамнеза (длительное курение, работа шахтером) свидетельствует о наличии у пациента хронической обструктивной болезни легких (ХОБЛ) средней тяжести.
С учетом уровня АД у больного можно сделать вывод, что используемая пациентом антигипертензивная терапия не эффективна. Кроме этого, прием ингибитора АПФ у пациентов с ХОБЛ ограничен риском развития кашля, способного провоцировать приступы бронхоспазма. Для лечения АГ у больных ХОБЛ и бронхиальной астмой хорошо зарекомендовали себя дигидропиридиновые блокаторы медленных кальциевых каналов (БМКК) [9–11]. Они имеют теоретические преимущества в виде влияния на гладкую мускулатуру трахеобронхиального дерева (дилатация) и, возможно, усиления эффекта β2-агонистов [12].
Тиазидные диуретики не обладают негативным влиянием на дыхательные пути и могут быть эффективно использованы у пациентов с ХОБЛ. Тем не менее при приеме препаратов этой группы у пациентов с сочетанной патологией существует вероятность развития тяжелой гипокалиемии. Этот негативный эффект может быть связан с сочетанным применением больными ХОБЛ ингаляционных β2-агонистов в рамках бронходилатирующей терапии [12, 13]. В связи с этим целесообразна замена гидрохлоротиазида на метаболически более нейтральный тиазидоподобный диуретик – индапамид [5, 14, 15].
С учетом вышеизложенного пациенту была назначена следующая комбинированная медикаментозная терапия: тиазидоподобный диуретик индапамид по 2,5 мг (Индап®) 1 раз утром и нитрендипин (НИТРЕМЕД®) в дозе 20 мг/сут: по 10 мг 2 раза/сут. Также больному были рекомендованы диета с ограничением поваренной соли, животных жиров, легкоусвояемых углеводов, ежедневные пешие прогулки, лечение и наблюдение у пульмонолога.
Через 2 нед АД у пациента достигло устойчивых целевых значений и сохранялось на этом уровне весь период наблюдения в течение 2 мес. Кризовых повышений АД не отмечено. Показатели ФВД не продемонстрировали отрицательной динамики, напротив, было выявлено некоторое их улучшение: индекс Тиффно 68%, ОФВ1 (от должного) 72%.
Разберем целесообразность и обоснованность проведенной коррекции антигипертензивной терапии.
ОБОСНОВАНИЕ ЗАМЕНЫ ГИДРОХЛОРОТИАЗИДА НА ИНДАПАМИД
Тиазидные и тиазидоподобные диуретики на протяжении более 60 лет (после появления первого препарата этой группы в 1957 г.) входят в число основных классов антигипертензивных средств первой линии антигипертензивной терапии (АГТ). В рекомендациях Европейского общества кардиологов/Европейского общества артериальной гипертензии (ESC/ESH) 2018 г. [16] и Российского кардиологического общества 2020 г. [17] выбор диуретика для лечения АГ ограничен 3 лекарственными средствами: гидрохлоротиазидом (ГХТ), хлорталидоном и индапамидом.
Применение диуретиков при АГ обосновано патогенетически, поскольку в механизмах повышения АД одну из центральных ролей играет увеличение объема циркулирующей крови и задержка во внутренней среде организма ионов натрия [27– 29]. Особое место тиазидные и тиазидоподобные диуретики, безусловно, занимают при АГ с низкой продукцией ренина, когда на первый план в ее формировании выходит патогенетический (объем-зависимый) механизм, связанный с задержкой жидкости в организме: это часто наблюдается у пациентов с метаболическим синдромом, сахарным диабетом (СД), пожилых лиц, представителей афроамериканской популяции, а также мультиморбидных больных с сопутствующей хронической сердечной недостаточностью и/ или хронической болезнью почек со скоростью клубочковой фильтрации ≥30 мл/мин/1,73 м2 [18].
Тиазидные и тиазидоподобные диуретики с учетом их ренальных эффектов можно условно разделить на два поколения: первое включает производные бензотиадиазина (ГХТ, бендрофлуметиазид, политиазид и др.) и хлорталидон, второе – производные хлорбензамида (индапамид, ксипамид и др.) и квиназолинона (метолазон) [19].
К настоящему времени в рандомизированных контролируемых исследованиях (РКИ) и метаанализах накоплена обширная доказательная база о позитивном влиянии диуретиков на прогноз в виде снижения риска развития сердечно-сосудистых и цереброваскулярных осложнений [20]. При этом в рекомендациях ESC/ESH (2018) [16] подчеркивается наличие у тиазидоподобных диуретиков более обширной доказательной базы в отношении эффективности и прогностической значимости.
Так, в метаанализе 19 РКИ [21] с участием 112 113 пациентов (56 802 получавших диуретики, 55 311 – контроль) лечение тиазидными и тиазидоподобными диуретиками было связано с уменьшением риска ССЗ (относительный риск (ОР) 0,86; p=0,007) и сердечной недостаточности (ОР 0,62; p <0,001), но не оказывало значимого влияния по сравнению с контролем на снижение угрозы инсульта (ОР 0,92; p=0,438) или ишемической болезни сердца (ОР 0,95; p=0,378). Дальнейший анализ, проведенный авторами, показал, что наблюдаемые преимущества были в основном ограничены терапией тиазидоподобными, а не тиазидными диуретиками со значительным снижением риска ССЗ (ОР 0,78; p <0,001), сердечной недостаточности (ОР 0,57; p <0,001) и инсульта (ОР 0,82; p=0,016). В системном обзоре и метаанализе, в который вошло 38 РКИ [22], продемонстрировано, что тиазидоподобные диуретики превосходят ГХТ в снижении массы миокарда левого желудочка в 2 раза.
Тиазидные и тиазидоподобные диуретики, как правило, объединяют в одну группу – тиазиды, однако они имеют существенных различий в механизме своего действия, клинических эффектах, профиле лекарственной безопасности, отчасти в параметрах эффективности контроля АД, а также доказательной базе в РКИ [23]. Так, ГХТ имеет дозозависимый характер влияния на уровень офисного АД, тогда как для индапамида такой зависимости показано не было. В отношении хлорталидона предполагается наличие как дозозависимого, так и дозонезависимого компонента действия [23].
Тиазидоподобные диуретики имеют существенно больший период полувыведения по сравнению с тиазидами: для ГХТ этот показатель составляет 6–15 ч, для хлорталидона – 40–60 ч, для индапамида – до 14–24 ч [23]. Длительность действия ГХТ варьирует, составляя в среднем 16 ч, у индапамида этот показатель находится в пределах ≥24 ч, у хлорталидона – 48–72 ч. В сравнительном исследовании низких доз хлорталидона (6,25 мг) и ГХТ (12,5 мг) по результатам суточного мониторирования АД сделан вывод, что ГХТ в дозе 12,5 мг оказывает антигипертензивный эффект преимущественно в дневное время, не влияя на уровень АД в ночные часы [24].
Вместе с тем ночное снижение АД – важная составляющая его суточного профиля, поскольку оно в большей степени, по сравнению с дневным, определяет прогноз пациента в отношении сердечно-сосудистых и цереброваскулярных осложнений [25–27]. Известно, что наиболее неблагоприятным суточным профилем АД является night-picker-тип, когда давление в ночное время не только не снижается, а, напротив, повышается; для этого типа установлена тесная ассоциация с поражением органов-мишеней при АГ и наибольшим числом сердечных смертей, инфарктов, инсультов, транзиторных ишемических атак [25–27].
В систематическом обзоре и метаанализе, включившем 14 РКИ с применением ГХТ в дозе 12,5–25 мг и 5 исследований с ГХТ в дозе 50 мг, было проведено сравнение контроля АД в течение 24 ч на фоне приема этого диуретика и других антигипертензивных препаратов (АГП) [28]. Американские исследователи отметили явно недостаточный антигипертензивный эффект ГХТ в сравнении с 4 другими основными классами АГП как по систолическому, так и диастолическому АД: это позволило авторам поставить под сомнение возможность использования ГХТ для монотерапии в качестве средства первой линии лечения АГ.
Другой важный вопрос – профиль лекарственной безопасности диуретиков. В ряде метаанализов высказываются опасения насчет того, что терапия диуретиками может приводить к нарушениям электролитного баланса и негативным метаболическим эффектам – нарушениям липидного, пуринового и углеводного обмена, вплоть до повышения риска развития СД 2 типа [29–33]. Прежде всего эти опасения относятся к тиазидным и тиазидоподобным диуретикам первого поколения – ГХТ и хлорталидону. Так, в крупномасштабном сравнительном когортном исследовании [34] были проанализированы эпизоды амбулаторного и стационарного лечения пациентов, впервые применявших антигипертензивную монотерапию диуретиками в США за период 2001–2018 гг. Из 730 225 пациентов (средний возраст 51,5 года, 61,6% женщины) 36 918 получали хлорталидон и 693 337 – ГХТ. Прием хлорталидона был ассоциирован со значительно более высоким риском гипокалиемии (ОР 2,72; 95% доверительный интервал (ДИ) 2,38– 3,12), гипонатриемии (ОР 1,31; 95% ДИ 1,16–1,47), острой почечной недостаточности (ОР 1,37; 95% ДИ 1,15– 1,63), хронической болезни почек (ОР 1,24; 95% ДИ 1,09–1,42), СД 2 типа (ОР 1,21; 95% ДИ 1,12–1,30) и со значительно более низким риском диагностированного аномального увеличения веса (ОР 0,73; 95% ДИ: 0,61– 0,86). Исследователи подчеркивают, что использование хлорталидона связано с более высоким риском почечных и электролитных нарушений. В другом обзоре отмечается, что вероятность гипонатриемии, гипокалиемии и гиперурикемии, ассоциированная с ГХТ, ниже, чем при приеме хлорталидона, однако терапия ГХТ была на ≥18% связана с побочными сердечно-сосудистыми эффектами относительно хлорталидона [35].
В метаанализах, посвященных оценке клинической эффективности и безопасности ГХТ, хлорталидона и индапамида, отмечается, что тиазидоподобные диуретики превосходят ГХТ в плане снижения АД без увеличения частоты гипокалиемии, гипонатриемии и изменений углеводного и липидного обмена [36, 37].
В феврале 2012 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) приняло решение о внесении новых предостережений в инструкцию по медицинскому применению ГХТ в связи с возможным развитием острой транзиторной миопии и острой закрытоугольной глаукомы [38].
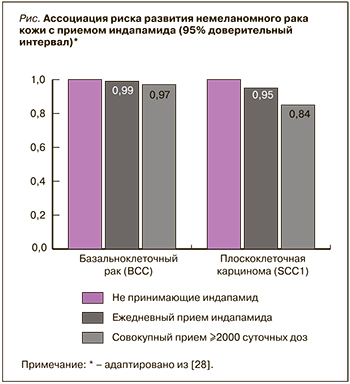 В конце 2018 г. ряд производителей лекарственных препаратов для лечения АГ, содержащих в качестве действующего вещества ГХТ, заявили о выявлении новых побочных эффектов [39]. В двух фармакоэпидемиологических исследованиях была продемонстрирована связь между приемом ГХТ и повышенным риском немеланомного рака кожи (НМРК) – базальноклеточной карциномы и плоскоклеточной карциномы [40, 41]. Угроза развития НМРК возрастала при увеличении суммарной (накопленной) дозы ГХТ. В качестве возможной причины этого рассматривается фотосенсибилизирующее действие ГХТ. Пациентам, принимающим данный диуретик или содержащие его комбинированные препараты, необходимо регулярно осматривать кожу и следить за появлением новых подозрительных поражений или же изменением уже имеющихся. При обнаружении таковых необходимо незамедлительно обратиться к врачу. Для минимизации риска НМРК больным следует ограничить воздействие солнечного света и ультрафиолетовых лучей, а также пользоваться защитными средствами. Для пациентов с НМРК в анамнезе следует пересмотреть целесообразность применения ГХТ [42]. При приеме индапамида, напротив, исследователями отмечена (рис.) отрицательная ассоциация с НМРК [42].
В конце 2018 г. ряд производителей лекарственных препаратов для лечения АГ, содержащих в качестве действующего вещества ГХТ, заявили о выявлении новых побочных эффектов [39]. В двух фармакоэпидемиологических исследованиях была продемонстрирована связь между приемом ГХТ и повышенным риском немеланомного рака кожи (НМРК) – базальноклеточной карциномы и плоскоклеточной карциномы [40, 41]. Угроза развития НМРК возрастала при увеличении суммарной (накопленной) дозы ГХТ. В качестве возможной причины этого рассматривается фотосенсибилизирующее действие ГХТ. Пациентам, принимающим данный диуретик или содержащие его комбинированные препараты, необходимо регулярно осматривать кожу и следить за появлением новых подозрительных поражений или же изменением уже имеющихся. При обнаружении таковых необходимо незамедлительно обратиться к врачу. Для минимизации риска НМРК больным следует ограничить воздействие солнечного света и ультрафиолетовых лучей, а также пользоваться защитными средствами. Для пациентов с НМРК в анамнезе следует пересмотреть целесообразность применения ГХТ [42]. При приеме индапамида, напротив, исследователями отмечена (рис.) отрицательная ассоциация с НМРК [42].
Возникновение дерматологических реакций возможно и при использовании хлорталидона [43]. Так, в недавнем сообщении американских врачей приводится описание клинического случая развития острого интерстициального нефрита и лекарственной системной красной волчанки, обусловленной приемом хлорталидона и амиодарона [44]. В описании активного вещества хлорталидон отмечается, что в процессе лечения содержащими его препаратами необходим контроль картины крови, электролитного состава крови, уровня мочевой кислоты, глюкозы в крови [45].
ИНДАПАМИД – ПРЕПАРАТ ВЫБОРА В ГРУППЕ ДИУРЕТИКОВ
Индапамид, синтезированный в 1974 г., до настоящего времени практически не подвергался научно обоснованной критике [45, 46]. Он относится к тиазидоподобным диуретикам, обладает натрийуретическим действием, характерным для всех тиазидных диуретиков, и дополнительными вазодилатирующими свойствами [18, 47, 48].
Антигипертензивный эффект препарата обусловлен, с одной стороны, натрийуретическими свойствами (в кортикальном отделе нефрона – проксимальном отделе дистального канальца, а также, возможно, в проксимальном отделе канальцев), что устраняет перегрузку сосудистой стенки натрием и уменьшает ее гиперреактивность к различным вазопрессорным агентам (катехоламинам, ангиотензину II и др.). С другой стороны, этот эффект связан с прямым сосудорасширяющим действием вследствие блокирования медленных кальциевых каналов в гладкомышечных клетках сосудистой стенки, повышения синтеза простациклина в сосудистой стенке и простагландина Е2 (ПГ Е2) в почках, а также подавления синтеза эндотелий-зависимого сосудосуживающего фактора [49–53].
Следовательно, индапамид, наряду со свойствами классического тиазидного диуретика, обладает еще и механизмами действия антагониста кальция. Такой двойной путь реализации антигипертензивного эффекта предопределяет его высокую эффективность и органопротекцию при АГ [45, 46, 54, 55]. Так, во французском исследовании X-CELLENT продемонстрировано, что индапамид обладает антигипертензивным эффектом на протяжении всех суток – как в дневное, так и ночное время, а также стабилизирует вариабельность АД, которая тесным образом ассоциирована с развитием сердечно-сосудистых осложнений и прогрессированием поражения органов-мишеней АГ [56].
Было проведено большое число международных и отечественных клинических исследований по оценке антигипертензивной эффективности, органопротективных свойств индапамида и его влияния на риск развития осложнений как в рамках монотерапии, так и в комбинации с другими АГП, в основном ингибиторами АПФ [57–60] и антагонистами кальция [61–64].
Индапамид практически не оказывает влияния на экскрецию калия, уровни глюкозы, холестерина и мочевой кислоты в крови. Метаболическая безопасность и высокая эффективность применения препарата в обычной (2,5 мг) и ретардированной форме (1,5 мг), в том числе у «проблемных» пациентов (с АГ и СД 2 типа, метаболическим синдромом и у лиц пожилого возраста) подтверждена результатами международных и российских исследований NESTOR [65, 66], PROGRESS [67], ADVANCE [68], HYVET [69], МИНОТАВР [70], АРГУС-2 [71], ЭПИГРАФ [58] и ряда др.
В исследовании PATS [72] в группе пациентов, получавших индапамид, частота повторных нарушений мозгового кровообращения была на 29% ниже в сравнении с плацебо. В исследовании PROGRESS [67] достоверное снижение вероятности развития повторного инсульта на 43% было получено только в группе пациентов, принимавших индапамид 2,5 мг в комбинации с ингибитором АПФ периндоприлом, тогда как в группе монотерапии периндоприлом достоверного снижения такого риска не отмечалось.
Изучение затратной эффективности применения АГП позволяет выявлять их экономические преимущества. Так, в ретроспективном фармакоэкономическом анализе нескольких крупных РКИ – LIVE [73], TOHMS [74], PRESERVE [75], NESTOR [65, 66] – индапамид показал лучшие коэффициенты затратной эффективности по сравнению с наиболее часто назначаемыми АГП разных классов не только при оценке степени снижения АД, но и регресса гипертрофии левого желудочка и микроальбуминурии.
Таким образом, индапамид, имеющий оптимальный метаболический профиль в ряду диуретиков, доказанные органопротективные свойства и благоприятно влияющий на прогноз, сохраняет прочные позиции как в моно-, так и комбинированной терапии АГ [45, 46, 55, 76].
Препарат Индап® (PRO.MED.CS Praha a. s., Чехия) является единственным дженериком с объективными доказательствами терапевтической эквивалентности двум формам выпуска оригинального индапамида [77–79]. Успешный опыт использования препарата Индап® в России на протяжении 25 лет, данные широкомасштабных проектов с длительным наблюдением пациентов, проведенных практически во всех регионах нашей страны и в других странах, свидетельствуют о его метаболической нейтральности, органопротективных свойствах и высокой антигипертензивной эффективности, в том числе и у больных АГ с СД 2 типа, метаболическим синдромом, пожилых пациентов. Индап® может применяться как в сочетании с липидоснижающими и антигипергликемическими средствами, так и в комбинации с другими АГП [14, 15, 45, 46, 54, 57, 76, 80–82].
ОБОСНОВАНИЕ ДОБАВЛЕНИЯ НИТРЕНДИПИНА К ИНДАПАМИДУ
Назначенная пациенту терапия, наряду с текущей эффективностью, имеет и позитивный прогностический вектор с учетом фактора семейного анамнеза. Так, у индапамида обнаружена способность влиять на нейродегенеративные процессы, поскольку на фоне его приема происходит подавление продукции бета-амилоида [83], а также улучшение структуры мозговых артериол с ослаблением процессов гипертрофического ремоделирования сосудистой стенки [84]. Интересно, что этот эффект не связан непосредственно с антигипертензивным действием препарата.
В исследовании SYST-EUR (Systolic Hypertension in Europe) [85, 86] была продемонстрирована клиническая эффективность БМКК нитрендипина не только с точки зрения значительного снижения вероятности возникновения инсульта (42%), но и других фатальных и нефатальных сердечно-сосудистых событий, включая снижение на 33% риска протеинурии и на 64% – почечной дисфункции. При ретроспективном анализе было выявлено, что наибольшее положительное влияние на прогноз использование нитрендипина оказывало у пациентов с СД уменьшение риска смерти от ССЗ на 70% (p=0,001), инсульта – на 69% (p=0,02), всех сердечно-сосудистых событий – на 62% (p=0,002) [87].
Два года лечения нитрендипином в исследовании SYST-CHINA (Systolic Hypertension in China) привели к достоверному снижению инсульта на 38%, смертности от инсульта – на 58%, сердечно-сосудистой смертности – на 39%, общей смертности – на 39% по сравнению с группой плацебо [88].
Таким образом, нитрендипин на сегодняшний день является единственным БМКК, обладающим доказанным церебропротективным действием. В соответствии с рекомендациями Американской ассоциации инсульта (American Stroke Association) он рассматривается как препарат первого выбора для профилактики вторичных инсультов [89].
В упоминавшихся выше исследованиях PROGRESS (комбинация периндоприла и индапамида в дозе 2,5 мг) [68] и SYST-EUR [85, 86, 90, 91] был установлен выраженный профилактический эффект АГТ в отношении развития когнитивных расстройств. Особенно наглядным этот эффект был в SYST-EUR, где применение нитрендипина у пациентов основной группы, в сравнении с контролем, сократило риск возникновения деменции на 55% (с 7,4 до 3,3 случаев на 1000 пациентов, 43 против 21 случая; р <0,001). Данные этого исследования позволяют предполагать, что АГТ с использованием нитрендипина может повлиять на развитие не только сосудистой, но и дегенеративной деменции [85, 90].
Возможность влияния нитрендипина на ЦНС подтверждается тем, что он проходит гематоэнцефалический барьер (ГЭБ) и снижает распад нейромедиаторных моноаминов, нейротрансмиттеров, дефицит которых особенно выражен при дегенеративной деменции [92]. Препарат хорошо накапливается в отделах головного мозга, наиболее подверженных изменениям при болезни Альцгеймера: коре, таламусе и гиппокампе [93].
Необходимо отметить, что нейропротективный эффект нитрендипина нельзя экстраполировать на всю группу дигидропиридиновых БМКК. В экспериментальном исследовании было показано, что только нитрендипин и отчасти нилвадипин (не зарегистрирован в России), представляющие собой небольшие молекулы, хорошо проникают через ГЭБ и способствуют снижению уровня бета-амилоида. Другие дигидропиридиновые БМКК (амлодипин и нифедипин) в эксперименте не оказывали влияния на уровень этого биомаркера или даже повышали его [94, 95].
Длительное время препараты нитрендипина отсутствовали в России. В начале 10-х гг. нынешнего века с учетом результатов исследования SYST-EUR на фармрынке появилась фиксированная комбинация нитрендипин (20 мг) + эналаприл (10 мг) [96]. Однако следует иметь в виду, что в этом исследовании у пациентов с изолированной систолической АГ базовый препарат нитрендипин применялся в широком диапазоне доз (10–40 мг), а при необходимости достижения целевого уровня АД комбинировался с эналаприлом (5–20 мг) и/или ГХТ (12,5–25 мг) [95, 96]. В инструкции по применению фиксированной комбинации нитрендипин (20 мг) + эналаприл (10 мг) обозначен режим дозирования не более 1 таб./сут [97]. Соответственно у части больных прием только данной фиксированной комбинации не позволит достичь целевого уровня АД и потребует дополнительной терапии [98, 99].
В 2016 г. на российском фармрынке появился монопрепарат нитрендипина НИТРЕМЕД® (PRO.MED.CS Praha a. s., Чехия). Он выпускается в таблетках 10 и 20 мг, режим его дозирования устанавливается индивидуально. Суточная доза препарата составляет 10–40 мг в 1–2 приема [100].
Наличие в арсенале врачей препарата НИТРИМЕД® дает возможность оптимизировать профилактику цереброваскулярной патологии при АГ. В этом плане представляется перспективной комбинированная терапия нитрендипин + индапамид. Немаловажна и оптимальная ценовая категория, в которой находятся препараты Индап® и НИТРЕМЕД®, что делает эти АГП доступными широкому кругу пациентов [15, 101].
Назначенная в ранее приведенном клиническом примере комбинация индапамид + нитрендипин соответствует и клиническим рекомендациям «Коморбидная патология в клинической практике», в которых отмечено, что у пациентов с мультиморбидной патологией предпочтение следует отдавать лекарственным препаратам с многоцелевым/мультитаргетным действием [102, 103].
Добавим, что в Национальном консенсусе «Особенности ведения коморбидных пациентов в период пандемии новой коронавирусной инфекции (COVID-19)» [104] отмечается, что наиболее тяжелое течение и высокий риск неблагоприятного исхода этого заболевания наблюдаются у пациентов пожилого возраста. При этом течение и лечение АГ в этой группе имеет свои особенности. Так, при ведении пожилых пациентов с систолической АГ БМКК и диуретики рассматриваются как альтернатива препаратам, влияющим на ренин-ангиотензин-альдостероновую систему (РААС). В современных рекомендациях по лечению пациентов с коморбидной патологией отмечены результаты исследования SYST-EUR [85, 86], показавшие высокую антигипертензивную эффективность нитрендипина и его церебропротективные свойства. Индапамид же рассматривается как препарат выбора среди диуретиков, поскольку по сравнению с ГХТ и хлорталидоном он имеет лучший метаболический профиль, в меньшей степени влияет на уровень калия и магния и обладает более выраженными органопротективными свойствами.
ФИКСИРОВАННЫЕ КОМБИНАЦИИ АНТИГИПЕРТЕНЗИВНЫХ ПРЕПАРАТОВ: ПЛЮСЫ И МИНУСЫ
В российских клинических рекомендациях «Артериальная гипертензия у взрослых» (2020) [17] отмечается, что фиксированные комбинации (ФК) хотя и повышают приверженность к лечению, однако не всегда входят в лекарственные формуляры лечебно-профилактических учреждений и в списки жизненно важных лекарственных препаратов. Еще один минус ФК АГП – достаточно ограниченный их набор, не всегда обеспечивающий полную замену произвольным (нефиксированным) сочетаниям антигипертензивных средств [98]. Это наглядно иллюстрируют результаты американского исследования 2012 г. [105], в котором были изучены врачебные назначения пациентам с АГ, дислипидемией и СД. В случае монотерапии (n=848 000 больных) лишь 3 (15%) из 20 наиболее часто выписываемых лекарственных средств были доступны в составе ФК. При анализе же комбинированной терапии (n=568 923 больных) было обнаружено, что в виде ФК на американском рынке были представлены только 9 (45%) из 20 наиболее часто совместно выписываемых классов препаратов. В этом плане уместно напомнить, что на российском фармрынке до сих пор отсутствуют, например, ФК индапамида с антагонистами рецепторов ангиотензина II.
При использовании ФК существует также вероятность назначения ненужного пациенту компонента в начале терапии. Кроме этого фиксированность дозировок активных веществ в одной таблетке ограничивает возможности лечащего врача в подборе оптимальных, индивидуализированных для конкретного пациента доз каждого компонента.
В связи с этим, несмотря на провозглашенную в российских рекомендациях 2020 г. «стратегию одной таблетки», в реальной практике в определенных клинических ситуациях у свободных комбинаций, в частности, содержащих индапамид, есть определенные преимущества. Появление же новой формы выпуска препарата Индап®, делимой на 4 равные части (со специальной риской) таблетки в дозе 2,5 мг, не только определяет удобство его применения и повышение приверженности пациентов к лечению, но и позволяет врачу постепенно титровать индапамид в 4 разных дозах (0,625; 1,25; 1,875; 2,5 мг), в том числе при комбинировании с другими АГП. Это способствует профилактике дозозависимых нежелательных реакций, дает возможность персонализировать подбор минимально эффективной дозы индапамида, что особенно актуально для пациентов старших возрастных групп, больных с наличием ишемической болезни сердца и гемодинамически значимых стенозов брахиоцефальных артерий, перенесших инсульт или транзиторную ишемическую атаку.
ЗАКЛЮЧЕНИЕ
Обсуждая проблемы рациональной фармакотерапии сквозь призму лекарственной безопасности и мультиморбидности/коморбидности, не лишне помнить 2 фундаментально важных изречения корифеев медицины. Первое принадлежит одному из основоположников русской клинической медицины, проф. Матвею Яковлевичу Мудрову: «Лечите не болезнь, а больного». Вторая рекомендация дана Гиппократом: «При лечении болезней имейте привычку соблюдать два правила: помогать или по крайней мере не вредить». Их всегда стоит держать в уме при подборе лекарственной терапии, в том числе коморбидным и мультиморбидным пациентам с АГ.


