ВВЕДЕНИЕ
В настоящее время взаимосвязь хронической обструктивной болезни легких (ХОБЛ) и сердечно-сосудистых заболеваний (ССЗ) не вызывает сомнения. В соответствии с рекомендациями Американской кардиологической ассоциации (American Heart Association, AHA) 2015 г., исследование состояния сосудистой стенки обладает важной прогностической ценностью при оценке рисков ССЗ [1]. Повышение артериальной ригидности у больных ХОБЛ может быть рассмотрено как системное проявление данного заболевания и выступать одним из механизмов формирования взаимосвязи ХОБЛ и ССЗ [2]. Основными показателями артериальной жесткости служат скорость распространения пульсовой волны в аорте (PWVao) и индекс аугментации (Aix).
Широкомасштабное клиническое исследование SUMMIT продемонстрировало, что повышение PWVao у пациентов с ХОБЛ было независимым предиктором смертности или развития сердечно-сосудистых событий [3]. В ряде исследовательских работ выявлено негативное влияние ухудшения функциональных показателей легких на параметры артериальной жесткости у пациентов с ХОБЛ [4–16]. Так, в исследовании ARCADE показано повышение PWVao у больных ХОБЛ с признаками умеренной бронхиальной обструкции во всех возрастных группах по сравнению с контрольной группой [12].
Патогенетические механизмы повышения жесткости сосудистой стенки по-прежнему мало изучены. Одним из основных факторов у пациентов с ХОБЛ может выступать гипоксия, которая оказывает опосредованное влияние на увеличение артериальной ригидности через интенсификацию воспалительных и оксидативных процессов [13, 14]. Обсуждаемым остается вопрос о влиянии степени выраженности эмфиземы на изменение параметров жесткости сосудистой стенки. В раннем исследовании McAllister D.A. et al. выявлена взаимосвязь между степенью эмфиземы и повышением жесткости сосудистой стенки [17]. Однако в более поздних работах данная зависимость не подтвердилась [18, 19]. Следует отметить, что в проблемах взаимосвязи жесткости сосудистой стенки и показателей функционального состояния легких у пациентов с ХОБЛ сохраняются определенные противоречия, и этой теме посвящено сравнительно небольшое количество исследований.
Особый интерес представляет оценка изменений параметров артериальной ригидности в течение суток и их вариабельность у данной группы пациентов. Исследовательские работы по этой проблеме носят единичный характер. По мнению отечественных авторов, чрезмерные суточные колебания (аналогично показателям суточного мониторирования артериального давления) и повышение вариабельности показателей жесткости сосудистой стенки могут способствовать развитию ССЗ у больных ХОБЛ [20, 21].
Целью предлагаемого исследования стало изучение параметров жесткости сосудистой стенки, их вариабельности и циркадного ритма с оценкой взаимосвязей с показателями функционального состояния легких у больных ХОБЛ.
МАТЕРИАЛ И МЕТОДЫ
Сравнительное поперечное исследование у 96 больных ХОБЛ проведено на базе государственного амбулаторно-поликлинического учреждения. Протокол исследования одобрен Этическим комитетом ФГБОУ ВО «МГМСУ им. А.И. Евдокимова» Минздрава России.
Критерии включения
1. Мужчины и женщины в возрасте от 40 до 75 лет.
2. ХОБЛ 1–4-й степеней тяжести (GOLD).
3. Наличие информированного согласия на участие в исследовании.
Критерии невключения
1. Стенокардия напряжения.
2. Инфаркт миокарда/острое нарушение мозгового кровообращения в анамнезе.
3. Нарушения сердечного ритма.
4. Хроническая сердечная недостаточность.
5. Артериальная гипертензия (АГ) 2‒3 степеней.
6. Сахарный диабет 1-го и 2-го типа.
7. Хроническая болезнь почек.
8. Индекс массы тела (ИМТ) ≥30 кг/м2.
9. Среднетяжелое/тяжелое обострение ХОБЛ в предшествующие 30 дней.
10. Онкологическое заболевание.
Фармакотерапия ХОБЛ включала использование длительно действующих бронходилататоров (антихолинергических и/или β2-агонистов); по поводу сопутствующей АГ 1-й степени пациенты получали монокомпонентную терапию ингибиторами АПФ, антагонистами рецепторов ангиотензина I или тиазидными диуретиками.
Всем больным проводились измерения антропометрических параметров (рост, вес, расчет ИМТ по Кетле), офисного артериального давления (АД) по методу Короткова, уровня холестерина, креатинина и глюкозы в плазме крови натощак.
Для комплексной оценки симптомов и выраженности одышки применялись оценочный тест по ХОБЛ (COPD Assessment Test, CAT) и модифицированная шкала одышки (Modified Medical Research Council Dyspnea Scale, mMRC).
Исследование вентиляционной функции легких выполнялось на бодиплетизмографе волюметрического типа Master Lab компании Erich Jeger (Германия) методами спирографии с компьютерным расчетом показателей. Полученные показатели оценивались в соответствии с рекомендациями GOLD (Global Initiative for Chronic Obstructive Lung Disease) 2018 г. Суточная пульсоксиметрия для оценки среднесуточного уровня сатурации проводилась с использованием пульсоксиметра MIROxi (Италия).
Жесткость сосудистой стенки измерялась с помощью диагностической системы BPLab МнСДП-2 Vasotens «Петр Телегин» (Россия). Исследования выполняли в течение 24 ч.
В ходе исследования определялись среднесуточные, дневные и ночные значения РWVao, Aix, индекса ригидности артерий (ASI) и вариабельность данных параметров (вар. РWVao, вар. Aix, вар. ASI) в течение суток.
Анализ данных осуществлялся с помощью статистического пакета программ SPSS 22.0. Перед началом расчетов выполнялась проверка на нормальность распределения посредством двухстороннего критерия согласия Колмогорова–Смирнова и проверка на равенство дисперсий методом Ливена. Большинство выборок не соответствовало критериям нормальности, в связи с чем использовались статистические методы для непараметрических распределений. Для выявления статистических различий между группами сравнения применялся критерий Манна–Уитни. Данные представлены в виде медианы, 25-го и 75-го квартилей. Проводился множественный корреляционный анализ с поправкой на пол, возраст и АД с использованием коэффициента ранговой корреляции Спирмена (r). Выполнялась логистическая регрессия, зависимые переменные сводились к дихотомическому типу. Статистически значимыми считались различия при p <0,05.
РЕЗУЛЬТАТЫ
В зависимости от степени тяжести ХОБЛ были сформированы 4 группы пациентов (табл. 1). При сопоставлении клинико-демографических показателей исследуемых групп установлено статистически значимое повышение возраста у пациентов 2-й группы в сравнении с 1-й и 4-й группами (p=0,041; p=0,007 соответственно). Показатели возраста у больных 3-й группы значимо превышали параметры 1-й группы (p=0,01). Пациенты 2-й группы имели более высокие значения ИМТ по сравнению с пациентами 3-й и 4-й групп (p=0,015; p=0,003 соответственно).

Кроме закономерных достоверных межгрупповых различий объема форсированного выдоха за 1-ю секунду (ОФВ1), выявлены статистически значимые различия емкости вдоха (Евд), величина которой была минимальной у больных 4-й группы по сравнению c остальными группами (p <0,001). Среднесуточные показатели пульсоксиметрии (SpO2) в группах носили сопоставимый характер, кроме больных 4-й группы, у которых величина этого показателя была ниже, чем в 1-й группе (p=0,02). Выраженность симптомов и одышки, согласно опросникам CAT и mMRC, у пациентов 4-й группы значимо превышала аналогичные показатели 1-й, 2-й и 3-й групп. Максимальная сопоставимая частота обострений ХОБЛ отмечалась во 2-й и 4-й группах, достоверно превышая данные 1-й и 3-й групп.
Показатели систолического артериального давления (САД) в исследуемых группах соответствовали целевому уровню, у больных 2-й группы величина этого параметра достоверно превышала значения в 3-й и 4-й группах (p=0,05; p=0,012). Показатели индекса курения, уровней глюкозы у изучаемых пациентов не имели достоверных межгрупповых различий. Наиболее высокий уровень холестерина отмечался в 1-й группе, низкий – в 3-й при отсутствии клинически значимого повышения во всех группах. Среднесуточные значения частоты сердечных сокращений (ЧСС) у больных 4-й группы оказались достоверно выше по сравнению с 1-й, 2-й и 3-й группами (p=0,015, p=0,008; p=0,023 соответственно).
При проведении суточного мониторирования параметров жесткости сосудистой стенки у больных исследуемых групп было обнаружено повышение PWVao по мере усугубления степени тяжести ХОБЛ (табл. 2). Наиболее высокие среднесуточные показатели были выявлены у пациентов 2-й и 4-й групп по сравнению с 1-й группой (p=0,016; p=0,005 соответственно). В дневное и ночное время наиболее высокие показатели также отмечались у пациентов 4-й группы по сравнению с 1-й группой (p=0,016; p=0,02 соответственно). Среднесуточная вариабельность PWVao была выше у пациентов 4-й группы относительно 1-й группы (p=0,004). В ночные часы этот показатель был выше у пациентов 4-й группы по сравнению с 1-й и 3-й группами (p=0,001; p=0,002 соответственно) и у больных 2-й группы относительно 1-й группы (p=0,019).
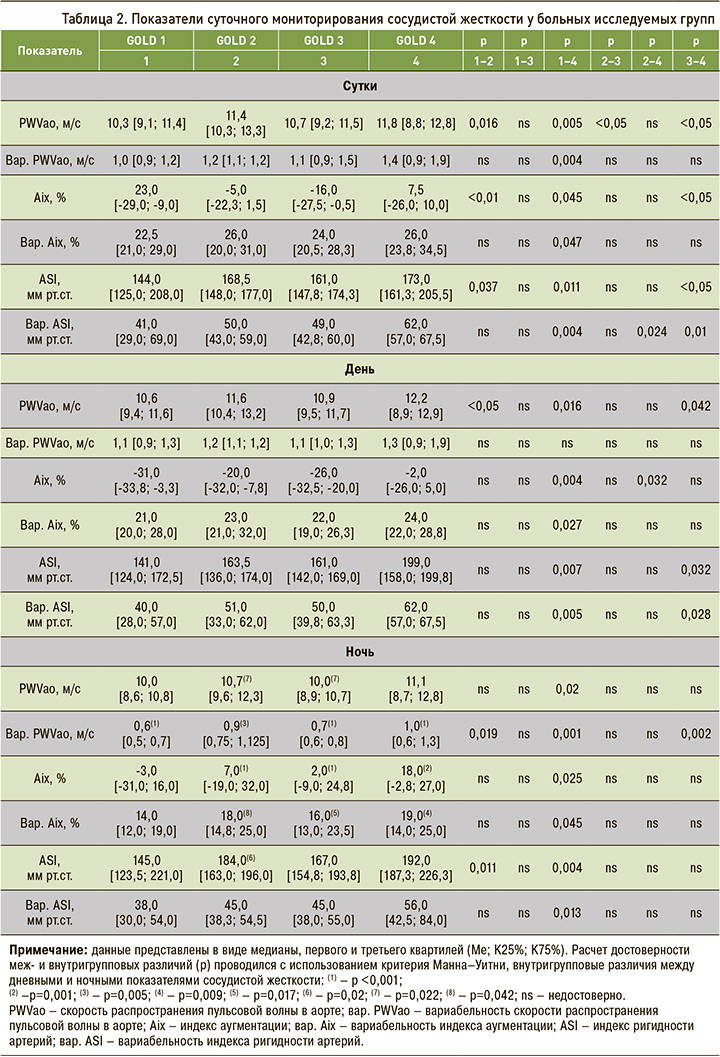
При анализе межгрупповых различий Aix среднесуточные и ночные значения у пациентов 4-й группы достоверно превышали показатели 1-й группы (p=0,045; p=0,025 соответственно). Достоверные межгрупповые различия Aix в дневные часы отсутствовали. Среднесуточная, дневная и ночная вариабельность Aix была достоверно выше у пациентов 4-й группы по сравнению с 1-й группой (p=0,047; p=0,027; p=0,045 соответственно).
Более высокие среднесуточные показатели ASI выявлены у пациентов 2-й и 4-й групп по сравнению с 1-й группой (p=0,037; p=0,011 соответственно). Значения ASI в дневное время у больных 4-й группы в сопоставлении с 1-й и 3-й группами оказались достоверно выше (p=0,007; p=0,032 соответственно); в ночное время достоверно более высокие значения этого параметра зафиксированы у пациентов 2-й и 4-й групп относительно 1-й группы (p=0,011; p=0,004 соответственно). Вариабельность ASI в 4-й группе превышала значения: а) 1-й, 2-й и 3-й групп (p=0,004; p=0,024; p=0,01 соответственно) в течение суток; б) 1-й и 3-й групп (p=0,005; p=0,028 соответственно) в дневные часы; в) 1-й группы (p=0,013) в ночное время.
При исследовании внутригрупповых различий дневных и ночных параметров жесткости сосудистой стенки у больных 1-й группы установлены достоверно более высокие значения вариабельности PWVao в дневное время по сравнению с ночным (р <0,001).
У пациентов 2-й группы выявлены наибольшие значения PWVao в дневное время по сравнению с ночным (р=0,022), а также достоверно более высокие показатели вариабельности PWVao в дневное время по сравнению с ночным (р=0,005); максимальные значения Aix и вариабельности Aix в ночное время по сравнению с дневным (р <0,001; р=0,042 соответственно); достоверно более высокие значения ASI в ночное время по сравнению с дневными (р=0,02).
В 3-й группе определялось достоверное превышение Aix в ночные часы по сравнению с дневными значениями (р=0,042). В 4-й группе установлены достоверно более высокие показатели вариабельности PWVao в дневное время по сравнению с ночным (р <0,001), Aix и вариабельности Aix в ночное время по сравнению с дневным (р=0,001; p=0,009 соответственно).

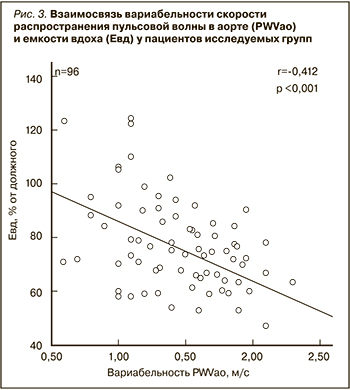
При проведении корреляционного анализа взаимосвязи среднесуточных показателей мониторирования артериальной ригидности (СМАР) (табл.3), помимо корреляций с традиционными факторами (возраст, ИМТ, САД, ДАД), обнаружены следующие взаимосвязи: умеренная обратная зависимость PWVao с ОФВ1 (r=-0,454, p <0,001; рис. 1), умеренная прямая зависимость с ЧСС (r=0,523, p <0,001), обратная умеренная зависимость с SpO2 (r=-0,380, p=0,004) соответственно (рис. 2). Также выявлена умеренная обратная зависимость вар. PWVao с ОФВ1 (r=-0,300, p=0,007), с Евд (r=- 0,412, p=0,001) (рис. 3) и прямая умеренная взаимосвязь с ЧСС (r=0,523, p <0,001). Выявлена умеренная обратная зависимость вариабельности ASI с ОФВ1 (r=-0,416, p=0,006).
С учетом выявленных корреляционных взаимосвязей для оценки степени влияния функциональных характеристик ХОБЛ на параметры жесткости сосудистой стенки (PWVao) проведена логистическая регрессия. Построена математическая модель с процентом согласия 91,2%, которая, помимо традиционных факторов (возраст, ИМТ, САД, ДАД), влияющих на показатели жесткости артериальной стенки, включала показатели SpO2, ОФВ1 (табл. 4). Согласно полученным результатам, кроме значимого влияния на PWao показателей возраста (χ2 Вальда=13,196; р <0,001), ИМТ (χ2 Вальда=11,466; р <0,001), САД (χ2 Вальда=8,624; р=0,004), ДАД (χ2 Вальда=7,872; р=0,004), установлено участие ОФВ1 (χ2 Вальда=7,195; p=0,008) и SpO2 (χ2 Вальда=5,624; p=0,01). Достоверного влияния Евд на PWVao не обнаружено.

Построена математическая модель для оценки степени влияния вышеперечисленных факторов на вариабельность PWVao (табл. 5; процент согласия модели 86,2%). Получены данные, свидетельствующие о значимом влиянии на вариабельность PWVao, кроме ДАД (χ2 Вальда=11,384; р <0,001), возраста (χ2 Вальда=10,842; р <0,001), ЧСС (χ2 Вальда=10,328; р <0,001), САД (χ2 Вальда=8,875; р=0,003), таких параметров, как Евд (χ2 Вальда=7,975; р=0,006), ОФВ1 (χ2 Вальда=6,895; p=0,007) и SpO2 (χ2 Вальда=4,264; p=0,02).

ОБСУЖДЕНИЕ
Проведенное исследование показателей жесткости сосудистой стенки у больных ХОБЛ продемонстрировало повышение среднесуточных, дневных и ночных значений PWVao по мере усугубления степени тяжести ХОБЛ. Достоверные различия выявлены у пациентов 4-й группы (GOLD 4) по сравнению с пациентами 1-й (GOLD 1) группы. Полученные результаты согласуются с литературными данными: в исследовании ARCADE повышение PWVao у пациентов с ХОБЛ определялось во всех возрастных группах по сравнению с контрольной группой лиц [12]. В работе Inomoto A. et al. отмечено увеличение PWVao по мере снижения ОФВ1 [7]. При выполнении корреляционного анализа помимо очевидных взаимосвязей с традиционными предикторами повышения жесткости сосудистой стенки, такими как возраст, ИМТ, ЧСС, САД и ДАД, выявлена умеренная обратная взаимосвязь PWVao с ОФВ1 (r= -0,454, p <0,001) и SpO2 (r= -0,380, p=0,004).
Результаты проведенной логистической регрессии с предикторной оценкой ОФВ1 и SpO2 могут быть расценены как свидетельство в пользу участия нарушения бронхиальной проходимости и гипоксии в увеличении жесткости сосудистой стенки у больных ХОБЛ, наряду с возрастом, ИМТ, САД и ДАД. Одним из механизмов, объясняющим взаимосвязь повышения жесткости сосудистой стенки и степени бронхиальной обструкции является эластолизис – снижение количества и разрушения эластического компонента как в бронхолегочной cистеме, так и в сосудах эластического типа [22, 23]. Возрастная инволюция эластина и повышение жесткости коллагена, а также каскады патологических реакций, наиболее значимыми из которых являются воспалительный, протеазный и оксидативный сдвиги, также лежат в основе повышения артериальной ригидности [24]. Немаловажным фактором, оказывающим влияние на жесткость сосудистый стенки у пациентов с ХОБЛ, может служить и степень гипоксии. Полученные результаты согласуются с данными литературы о роли гипоксии в увеличении артериальной жесткости. По мнению отечественных ученых, в ответ на нарастающую степень гипоксии сосуды реагируют комплексом изменений, в результате которых происходит гипертрофия и гиперплазия эндотелия, субэндотелиального слоя, гладкомышечных клеток, а также повышение содержания коллагена [14]. В работе М.А. Макаровой с соавт. подтверждается роль гипоксии в повышении артериальной ригидности у пациентов с ХОБЛ [13].
При оценке среднесуточных и ночных показателей вариабельности PWVao достоверно более высокие значения установлены у пациентов 4-й группы в сравнении с 1-й группой. При анализе факторов, оказывающих влияние на вариабельность PWVao, помимо установленных взаимосвязей с известными предикторами жесткости сосудистой стенки (возраст, ИМТ, ЧСС, САД и ДАД), выявлены корреляционные связи с ОФВ1 (r=-0,300, p=0,007) и Евд (r=-0,412, p=0,001). Результаты логистической регрессии подтверждают возможное влияние ОФВ1, Евд и SpO2 на вариабельность PWVao.
Следует отметить, что в нашем исследовании взаимосвязь Евд (как суррогатного маркера легочной гиперинфляции) с абсолютными значениями PWVao не получила подтверждения, что согласуется с данными литературы [18, 19].
С точки зрения отечественных авторов, повышение вариабельности параметров артериальной ригидности, вероятно, играет негативную роль в формировании ССЗ, аналогичную повышению вариабельности САД [21]. Можно предположить, что изменение вар. PWVao является более ранним и более чувствительным показателем, чем абсолютные значения PWVao. Литературные данные о взаимосвязи вар. PWVao и Евд в настоящее время отсутствуют. Несмотря на противоречивые сведения о влиянии степени гиперинфляции и эмфиземы на жесткость сосудистой стенки, в исследовании Roeder M. et al. обнаружено увеличение жесткости сосудистой стенки по мере нарастания степени тяжести эмфиземы (по результатам диффузионной способности легких), уровня системного воспаления и дислипидемии [25]. Данное исследование может служить косвенным подтверждением полученным результатам нашей работы.
В рамках проведенного исследования выявлено достоверное увеличение среднесуточных показателей ASI и Aix и вариабельности этих параметров (среднесуточной, дневной и ночной) у пациентов 4-й группы в сравнении с 1-й группой. В настоящее время повышение вариабельности ASI связывают с нарушениями пассивных и активных механизмов регуляции сосудистой жесткости и относят к маркерам сердечно-сосудистого риска. Пассивные механизмы сосудистой жесткости определяются состоянием эластических и коллагеновых волокон в стенке артерии, уровнем ЧСС. Активные механизмы, определяющие жесткость сосудистой стенки, включают эндотелиальную функцию, низкоинтенсивное воспаление, окислительный стресс и симпатическую активность [21]. Учитывая ключевую роль воспалительных, окислительных реакций, дисфункции эндотелия и патологический активности симпатической нервной системы в развитии и прогрессировании ХОБЛ, выявленные изменения параметров сосудистой жесткости у пациентов с крайне тяжелой степенью ХОБЛ носят закономерный характер.
При исследовании циркадного ритма артериальной ригидности наиболее выраженные изменения определялись у пациентов 2-й и 4-й групп. У пациентов 2-й группы выявлено значимое повышение PWVao и ее вариабельности в дневные часы, Aix, вариабельности Aix и ASI в ночное время. Полученные результаты во 2-й группе обусловлены преобладанием пациентов пожилого возраста с повышенным ИМТ и АГ по сравнению с остальными группами. У больных 4-й группы наблюдались достоверно более высокие значения вариабельности PWVao в дневное время, Aix и вариабельности Aix в ночное время. Несмотря на крайне скудное количество работ по исследованию циркадного ритма у пациентов с ХОБЛ без сердечно-сосудистой патологии, полученные результаты согласуются с литературными данными отечественных исследователей. Так, в научных работах Н.А. Кароли с соавт. установлено достоверное повышение Aix в ночное время по сравнению с дневным значением у пациентов с ХОБЛ. По мнению авторов, это объясняется меньшим поглощением возвратной пульсовой волны за счет снижения эластических свойств сосудистой стенки вследствие повышения функциональной активности эндотелия в ночное время [26, 27].
Хорошо известно, что именно ночные колебания (недостаточные или повышенные) АД выступают прогностически неблагоприятным фактором развития ССЗ. По-видимому, можно предположить, что изменения циркадного ритма артериальной ригидности также негативно влияют на развитие ССЗ. Вероятно, это обусловлено наличием необратимых изменений сосудистой стенки, в результате чего в ночное время суток становится недостаточной ее полноценная релаксация, связанная с активацией симпатического отдела вегетативной нервной системы [20].
ЗАКЛЮЧЕНИЕ
В ходе проведенного исследования выявлено повышение ряда показателей жесткости сосудистой стенки и нарушение циркадного ритма артериальной ригидности по мере усугубления степени тяжести ХОБЛ. Наряду с традиционными факторами риска увеличения PWVao (возраст, ИМТ, ЧСС, САД и ДАД) установлено влияние на этот параметр уровня сатурации и ОФВ1. Определена взаимосвязь вариабельности PWVao с Евд, ОФВ1 и SpO2. Полученные данные могут свидетельствовать о негативном влиянии функциональных показателей ХОБЛ на показатели артериальной ригидности, что, в свою очередь, может являться одной из причин формирования сердечно-сосудистой патологии у пациентов с ХОБЛ.


