ВВЕДЕНИЕ
Синдеканы представляют собой трансмембранные протеогликаны (PG), состоящие из основного белка, к которому присоединены боковые цепи гликозаминогликана (GAG), связывающего фактор роста [1]. Семейство синдеканов состоит из четырех подтипов [2]. Синдекан-1 (SDC-1), известный также как CD 138, в основном обнаруживается в эпителиальных клетках, синдекан-2 (SDC-2) присутствует в клетках мезенхимального происхождения, синдекан-3 (SDC-3) – только в нейрональной ткани и хряще, а синдекан-4 (SDC- 4) экспрессируется повсеместно [3]. SDC-1 содержит 288 аминокислот, молекулярная масса белковой части составляет 32,5 кДа [4].
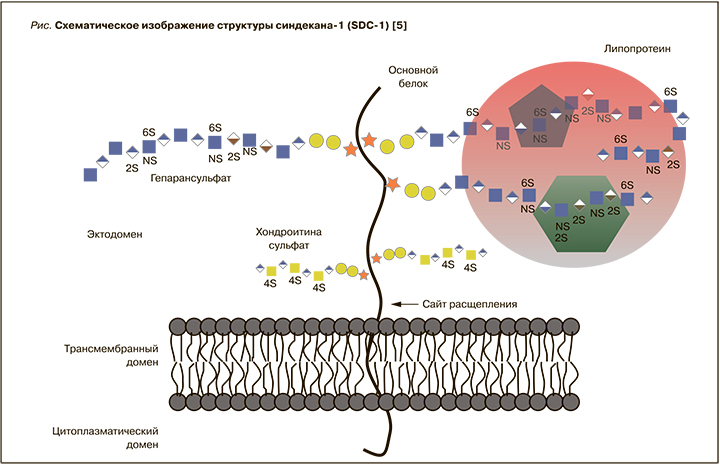
Белковые ядра синдеканов состоят из C-концевого цитоплазматического домена, трансмембранного домена и большого N-концевого внеклеточного домена [5]. Внеклеточный домен – наиболее вариабельная часть белка, сходство последовательностей между синдеканами составляет менее 20%. Эктодомен содержит порядка пяти цепей GAG; природа, количество и положение цепей GAG на коровом белке синдеканов неизменны у разных видов. SDC-1 в различных тканях содержит разные типы GAG, включая гепарансульфат (HS) и хондроитин сульфат (CS) различной длины и ультраструктуры (рис.) [5]. Биохимические реакции, изменяющие структуру HS, принимают участие в регулировании связывания белков PG [6, 7]. Биологическая роль SDC-1 определяется его способностью связывать множество лигандов, кроме того, доказано его участие в матричных взаимодействиях и в матричной сборке [7].
Как известно, компоненты внеклеточного матрикса, особенно PG, связаны с воспалением, фиброзом и ремоделированием сердца [7]. Было обнаружено, что члены семейства синдеканов связаны с ранними стадиями фиброза, выступая в качестве важной мишени для трансформации фактора роста-β2 (TGFβ2) [8]. Экспрессия синдекана повышается в ответ на провоспалительные стимулы при различных сердечных заболеваниях, сопровождающихся формированием фиброза [9]. На моделях мышей, лишенных SDC-1 и SDC- 4, показана сниженная активация профиброзной передачи сигналов и увеличение выраженности разрыва сердца при инфаркте миокарда (ИМ), что указывает на важную роль этих молекул [7]. В то время как так называемый короткий цитоплазматический хвост синдеканов регулирует передачу сигналов, их внеклеточная часть, замещенная гепарансульфатными гликозаминогликановыми цепями, связывает множество молекул внеклеточного матрикса (ЕСМ), участвующих в фиброзе (коллагены, факторы роста, цитокины и белки адгезии иммунных клеток) [7]. Полноразмерные синдеканы индуцируют профиброзную передачу сигналов, повышая экспрессию коллагенов, факторов дифференцировки миофибробластов, ферментов ЕСМ, факторов роста и молекул адгезии иммунных клеток, тем самым усиливая жесткость сердца и предотвращая разрыв миокарда. Под воздействием провоспалительных стимулов синдекановые эктодомены ферментативно высвобождаются из кардиальных клеток («отторжение» синдекана). Эктодомены влияют на экспрессию молекул ECM, способствуя их деградации и разрыву сердца при ИМ [7].
СИНДЕКАН-1: СИСТЕМА РЕНИН–АНГИОТЕНЗИН–АЛЬДОСТЕРОН
Профибротическая роль ангиотензина II (Ang II) в ремоделировании сердца – хорошо известный процесс, опосредованный сопутствующей активацией TGFβ1 и фактора роста соединительной ткани (CTGF) посредством передачи клеточных сигналов, что приводит к усиленному синтезу коллагена и других множественных матричных белков [10, 11]. Принимая участие в этих структурных изменениях, Ang II вызывает гипертрофию и фиброз миокарда. Подобно синдеканам, Ang II-опосредованная передача сигналов происходит в основном через цепи HS благодаря их способности связываться с ECM. Эта связь также стимулирует выработку не только факторов роста, но и их рецепторов, таких как эндоглин, рецептор TGFβ1. Блокада данного сигнального пути способствует уменьшению индуцированного Ang II миокардиального фиброза [7].
Данные работы Schellings M. et al. [12] продемонстрировали участие SDC-1 в ремоделировании сердца путем воздействия на передачу сигналов, опосредованную факторами роста. Отсутствие SDC-1 у экспериментальных мышей защищает их от индуцированной Ang II сердечной дисфункции и последующего фиброза, поскольку потеря SDC-1 ослабляет эффект Ang II за счет снижения индукции факторов роста (CTGF, TGFβ1) [7, 12]. Эти данные подтверждаются значительным увеличением экспрессии SDC-1 у мышей, получавших Ang II. Те же авторы идентифицировали повышенную экспрессию in vivo коллагена I и III и CTGF в фибробластах мышей после инфузии Ang II.
Другой важный аспект представлен участием цепей HS в передаче фиброгенного сигнала. Добавление протамина (ингибитор гепарина и HS) предотвращало увеличение экспрессии CTGF и коллагена I после стимуляции Ang II. Кроме того, сердечные фибробласты, обработанные эктодоменом SDC-1, без цепей HS не влияли на экспрессию CTGF, дополнительно подтверждая, что HS участвуют в передаче фиброгенного сигнала SDC-1 [12, 13].
СИНДЕКАН-1 ПРИ АТЕРОСКЛЕРОЗЕ
В нескольких исследованиях оценивалась экспрессия SDC-1 и влияние Ang II на экспрессию SDC-1 в макрофагах при атеросклерозе. Обнаружено, что Ang II оказывает значительное проатерогенное действие на стенку сосудов: Ang II усиливает активность липоксигеназы макрофагов с последующей генерацией проатерогенных окисленных липопротеидов низкой плотности, тем самым ускоряя рекрутирование париетальных моноцитов [14]. Другой инкриминируемый механизм ‒ индуцированная Ang II экспрессия макрофагальной гидроксиметилглутарил-кофермент А-редуктазы (ГМГ-КоА-редуктазы), которая определяет повышенный синтез холестерина [15,16].
Wang W. et al. обнаружили, что при атеросклерозе SDC-1 высоко экспрессируется в макрофагах, индуцированных после 8-недельной инфузии Ang II у лишенных аполипопротеина E мышей. Те же авторы продемонстрировали, что Ang II активирует экспрессию SDC-1 посредством передачи сигналов серин/треонин-специфичных протеинкиназ, и эти киназы активируются либо непосредственно рецептором Ang I, либо через реактивные формы кислорода и перекись водорода, продуцируемых мембранными никотинамид-адениндинуклеотидфосфат-зависимыми оксидазами в ответ на Ang II [17]. Кроме того, Ang II выступает мощным индуктором выделения SDC-1 в ECM- процесса, ускоряющего формирование атеросклеротических поражений за счет усиления образования клеточной среды с выраженными провоспалительными и стимулирующими особенностями. Это происходит потому, что синдеканы способны взаимодействовать с различными гепарин-связывающими провоспалительными хемокинами (например, хемоаттрактантным белком-1 моноцитов) через свои цепи HS, тем самым усиливая повреждения стенок в виде формирования атеросклеротических бляшек [7].
Весьма интересны данные исследования Vo S. et al., продемонстрировавшие экспрессию SDC-1 даже на ранних стадиях атероматозного поражения аорты. SDC-1 был обнаружен на гладкомышечных клетках интимы и способствовал накоплению пенистых клеток [18].
Другими авторами показана защитная роль SDC-1 при атеросклерозе, обусловленная в основном его противовоспалительными эффектами. Появляется все больше доказательств того, что экспрессия SDC-1 связана с высокой внутренней подвижностью макрофагов, в то время как его дефицит приводит к нарушению миграции и повышенной адгезии. Исследование мышей, содержащих SDC-1 и нокаутных по SDC-1, выявили у первых повышенную плотность воспалительных макрофагов, а у вторых – большой риск атеросклеротической бляшки [19, 20].
СИНДЕКАН-1 ПРИ ИНФАРКТЕ МИОКАРДА
Vanhoutte D. et al. при оценке сывороточных уровней SDC-1 при ИМ у мышей констатировали, что SDC-1 является важной защитной молекулой, ограничивающей зону воспаления и снижающей ремоделирование и дисфункцию миокарда [21]. Эти данные основаны на предполагаемой роли SDC-1 в ингибировании взаимодействия лейкоцитов и эндотелия. Провоспалительная среда усиливает активность матриксных металлопротеиназ, при этом синтезированный de novo коллаген имеет более низкое качество, следовательно, предрасполагает к ремоделированию и дилатации сердца. В другом исследовании была выдвинута гипотеза, что эти эффекты также могут быть опосредованы регуляцией передачи сигналов TGFβ через SDC-1 с усилением противовоспалительного ответа при ИМ в отличие от профибротического действия, обнаруженного в сердцах, обработанных Ang II [22]. Fuernau et al. сообщено о значительной связи между высокими уровнями SDC-1 и смертностью у 600 пациентов с кардиогенным шоком, возникшим вследствие ИМ, что дополнительно подтверждает предыдущие данные [23].
Ostrowski S. et al. было выполнено обследование 678 пациентов с ИМ с подъемом сегмента ST (ИМпST), поступивших в кардиохирургический центр для первичного чрескожного коронарного вмешательства (ЧКВ) с сентября 2006 г. по июль 2008 г. Образцы крови были взяты непосредственно перед вмешательством. Адреналин, норадреналин, SDC-1 и тромбомодулин были измерены ретроспективно у 571 пациента (84%). Средняя длительность наблюдения составила 28 мес. Авторами получены следующие результаты: циркулирующие норадреналин и адреналин слабо, но независимо друг от друга коррелировали с SDC-1 (коэффициент корреляции rho=0,15 и rho=0,13; в обоих случаях p <0,01) и тромбомодулином (rho=0,11 и rho=0,17, оба p <0,01). Что касается биомаркеров, пациенты, у которых диагностирован кардиогенный шок до проведения ЧКВ, имели более высокий уровень адреналина и SDC-1, при этом уровень катехоламинов коррелировал с концентрацией тромбомодулина и SDC-1 (rho=0,31–0,42; во всех случаях p <0,05). За время наблюдения 78 (14%) пациентов умерли (37 смертей от сердечно-сосудистых заболеваний) и 65 (11%) были госпитализированы с сердечной недостаточностью (СН).
Согласно многомерному анализу пропорциональных рисков Кокса, более высокий уровень адреналина в плазме на один квартиль был слабо, но независимо связан как с 30-дневной, так и с отдаленной смертностью и формированием СН (30-дневный коэффициент риска смертности от всех причин 1,39; 95% доверительный интервал (ДИ): 1,01–1,92; p=0,046), развитием недостаточности кровообращения в течение 30 дней (1,65; ДИ: 1,17–2,34; p=0,005) и отдаленной сердечно-сосудистой смертностью (1,49; ДИ: 1,08–2,04; p=0,014). Более того, уровень SDC-1 на один квартиль выше независимо был связан с общей отдаленной смертностью (1,26; 95% ДИ: 1,02–1,57; p=0,034). Ученые пришли к заключению, что у пациентов с ИМпST после проведенного ЧКВ катехоламины слабо коррелировали с биомаркерами эндотелиального повреждения, наиболее сильные корреляции и самые высокие концентрации адреналина и SDC-1 были отмечены у больных с шоком. Кроме того, адреналин и SDC-1 были слабо, но независимо связаны со смертностью и развитием СН. Авторы резюмировали, что острый ИМ вызывает значительное повреждение эндотелиальных клеток и гликокаликса и параллельное увеличение циркулирующих катехоламинов [22].
В 2019 г. в отделении кардиологии медицинского университета города Зальцбурга Wernly B. et al. провели исследование по оценке прогностической значимости концентраций SDC-1 в плазме крови относительно неблагоприятных сердечно-сосудистых событий (ССС) у пациентов с острым ИМпST, которым была выполнена реперфузионная терапия. В это исследование вошли 206 пациентов, госпитализированных по поводу ИМпST (средний возраст 65±12 лет); все они находились под наблюдением в течение 6 мес. Образцы крови были взяты после проведения реперфузионного вмешательства. Не было получено данных о зависимости изучаемого маркера от уровня креатинкиназа, тропонина, размеров инфарктной зоны и индекса спасения миокарда. После внесения коррекционных поправок в статистический анализ, учитывающих известные факторы риска, было установлено, что значение SDC-1 >120 нг/мл независимо ассоциировалось с увеличением смертности в течение 6 мес [24].
СИНДЕКАН-1 ПРИ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Нидерландские ученые провели исследование по анализу уровня SDC-1 в плазме крови у 567 пациентов с хронической СН. Первичной конечной точкой служила совокупность смертности от всех причин и повторных госпитализаций по поводу декомпенсации СН в течение 18 мес. Средний возраст больных составил 71,0±11,0 года, средняя фракция выброса левого желудочка (ФВ ЛЖ) – 32,5±14,0%, медиана концентрации SDC-1 – 20,1 нг/мл (межквартильный диапазон 13,9–27,7 нг/ мл). Пациенты с более высоким уровнем маркера чаще имели более высокий уровень N-концевого натрийуретического пептида (NT-проBNP) и нарушения функции почек. Многофакторный регрессионный анализ показал положительную корреляцию между уровнями SDC-1 и маркерами фиброза, при этом не отмечено достоверной корреляции с маркерами воспаления. Была выявлена статистически достоверная связь ФВ ЛЖ и уровня SDC-1 (p=0,047). Двукратное увеличение концентрации SDC-1 было ассоциировано с повышенным риском первичной конечной точки у пациентов с СН с сохраненной ФВ ЛЖ (отношение рисков 2,10; 95% ДИ: 1,14–3,86; p=0,017), но не у больных СН со сниженной ФВ ЛЖ (отношение рисков 0,95; 95% ДИ: 0,71–1,27; p=0,729) [25].
В исследовании Neves F. et al. изучался уровень нескольких эндотелиальных биомаркеров у 201 пациента с острой СН при поступлении в отделение неотложной помощи. Оценивали внутрибольничную летальность, развитие острого почечного повреждения (ОПП) и 6-месячную смертность. Авторы сделали вывод, что концентрация SDC-1, маркера повреждения гликокаликса, имеет важное прогностического значение в отношении риска развития ОПП и внутрибольничной летальности [26].
В 2019 г. Liu W. et al. были представлены результаты исследования по изучению SDC-1 в качестве фактора риска возникновения неблагоприятных ССС у 96 пациентов (средний возраст 51,08±13,28 года) c дилатационной кардиомиопатией неишемического генеза (средняя ФВ ЛЖ по данным эхокардиографии составила 31,90±8,85%). Медиана концентрации SDC-1 равнялась 456,57 пг/мл (межквартильный диапазон 244,93–1181,26 пг/мл). Многофакторный регрессионный анализ Кокса для Модели I (с поправкой на возраст, пол) и II (с поправкой на традиционные факторы риска) показал, что исходный уровень SDC-1 оставался независимым предиктором комбинированных неблагоприятных конечных событий (Модель I HR, увеличение на 1,10/ 00 пг/ мл уровня SDC-1; 95% ДИ: 1,04–1,16; p=0,0006; HR модели II, повышение уровня SDC-1 на 1,10/100 пг/мл; 95% ДИ: 1,03–1,18; p=0,0029). Анализ Каплана–Мейера, основанный на тертилях SDC-1, показал, что верхний тертиль был связан со снижением выживаемости по сравнению с таковым в среднем и нижнем тертилях (p <0,0001). Анализ многомерной логистической регрессии продемонстрировал положительную корреляцию между уровнем SDC-1 и маркерами фиброза и воспаления [27].
Задачи австралийского исследования, проведенного в 2020 г., заключались в следующем: 1) определить, связана ли ХСН со сниженной ФВ ЛЖ (HFrEF) с повышенным образованием гликокаликса; 2) связано ли выделение гликокаликса при HFrEF с диссинхронией миокарда ЛЖ, воспалением, эндотелиальной дисфункцией и/или окислительно-восстановительным стрессом. 26 пациентов с HFrEF с диссинхронией миокарда ЛЖ были обследованы до и спустя 6 мес после имплантации ресинхронизационного кардиостимулятора (CRT). Всем больным, помимо стандартных лабораторных и инструментальных исследований, проводили оценку показателя SPWD, отражающего время задержки между пиком амплитуды сокращения задней стенки ЛЖ и межжелудочковой перегородки, а также определяли показатели качества жизни, концентрации воспалительных и окислительно-восстановительных биологических маркеров. Выделение гликокаликса количественным методом определяли по уровням в плазме компонента гликокаликса SDC-1. Показатели SDC-1 до CRT обратно коррелировали с ФВ ЛЖ (r =-0,45; p=0,02), отмечена прямая корреляционная связь с SPWD (r=0,44; p=0,02), QOL (r=0,39; p=0,04), NT-проBNP (r=0,43; p=0,02) и воспалительным маркером, симметричным диметиларгинином (r=0,54; p=0,003). Не было обнаружено значительной корреляции между уровнями SDC-1 и другими маркерами эндотелиальной дисфункции/воспалительной активации. После проведения CRT не отмечено статистически достоверных изменений в концентрациях SDC-1 [28].
В 2020 г. сербскими учеными проведено исследование по оценке уровня четырех биологических маркеров («растворимого» ST2 рецептора (sST2), галектина-3, ростового фактора дифференцировки 15 (GDF-15) и SDC-1) у пациентов с хронической СН. Участники, страдающие СН (n=77), были разделены на 3 группы в зависимости от величины ФВ ЛЖ по данным эхокардиографии: группа 1 – со сниженной ФВ <40% (HFrEF), группа 2 – с ФВ 40–49% (HFmrEF), группа 3 – с сохраненной ФВ >50% (HFpEF). Авторы установили, что концентрации в плазме крови четырех биомаркеров ремоделирования сердца были самыми высокими в группе 1 и самыми низкими в группе 3 (p <0,001). У больных группы 3 маркеры независимо коррелировали с индексом массы миокарда ЛЖ (ИМЛЖ): sST2 (p=0,002), галектин-3 (p <0,001), GDF-15 (p=0,011) и SDC-1 (p=0,006), тогда как галектин-3 показал корреляцию только после многопараметрических статистических корректировок (p=0,001). У пациентов группы 3 также были отмечены независимые корреляционные связи размеров перегородки и задней стенки ЛЖ: sST2 (p=0,019; p=0,026), галектин-3 (p=0,011; p=0,009), GDF-15 (p=0,007; p=0,001), и SDC-1 (р=0,005; р=0,002). У пациентов из группы 1 только скорректированный sST2 показал связь с ИМЛЖ (p=0,010). Обнаружена также корреляция BNP с ИМЛЖ (p=0,002) и ФВ ЛЖ (p=0,001). Выявлена связь GDF-15 с параметрами диастолической дисфункции у больных группы 3 (p=0,046) и пациентов группы 2 (p=0,024). Ученые пришли к выводу, что необходимо определять концентрацию циркулирующих биологических маркеров для мониторинга прогрессирования гипертрофии ЛЖ у пациентов с СН [29].
Проведенное в 2021 г. исследование Stojanovic D. et al. показало, что независимыми предикторами бессимптомной ишемии у пациентов с СН служат повышенные концентрации в плазме крови BNP (p=0,008), реналазы (p=0,012), sST2 (p=0,020), галектина-3 (p=0,018), GDF-15 (p=0,034) и SDC-1 (p=0,024). При этом в группе больных с ФВ ЛЖ <45% независимыми предикторами были BNP (p=0,001), реналаза (p <0,001), sST2 (p=0,004), галектин-3 (p=0,003), GDF-15 (р=0,001) и SDC-1 (р <0,001). AUC (площадь под кривой) BNP (0,837) была статистически выше, чем у sST2 (тест DeLong: p=0,042), SDC-1 (DeLong: p=0,022) и цистатина C (DeLong: p=0,022). AUC реналазы (0,753), галектина-3 (0,726) и GDF-15 (0,735) были сходными и не уступали BNP в отношении прогноза ишемии. У пациентов со сниженной ФВ ЛЖ AUC BNP (0,980) была статистически выше, чем у реналазы (DeLong: p <0,001), sST2 (DeLong: p <0,004), галектина-3 (DeLong: p <0,001), GDF-15. (DeLong: p=0,001), SDC-1 (DeLong: p=0,009) и цистатина C (DeLong: p=0,001). AUC реналазы (0,814) была статистически выше, чем у галектина-3 (DeLong: p=0,014) и GDF-15 (DeLong: p=0,046), и аналогична таковой для sST2. У пациентов с ФВ ЛЖ >45% статистически достоверных результатов получено не было [30].
СИНДЕКАН-1 У КАРДИОХИРУРГИЧЕСКИХ БОЛЬНЫХ
В 2018 г. российскими учеными было выполнено исследование, направленное на выявление связи эндотелиального гликокаликса с гемодинамикой и метаболизмом у пациентов с септическим шоком и при кардиохирургических операциях в условиях искусственного кровообращения (ИК). Согласно результатам протокола, первоначальное состояние гликокаликса и повреждение его компонентов (HS и S1) на фоне системной воспалительной реакции при сепсисе и после проведения ИК взаимосвязано с нарушениями метаболизма и гемодинамических параметров. Кроме того, уровень компонентов гликокаликса в крови при септическом шоке коррелировал с выраженностью системной вазодилатации и гиперлактатемии. Также было обнаружено, что при кардиохирургических операциях через 6 ч после ИК наблюдается статистически достоверное преходящее снижение HS и увеличение S1, при этом исходная концентрация HS коррелировала с периоперационными показателями сердечного выброса, пред- и постнагрузки и показала предиктивную способность в диагностике послеоперационной гиперлактатемии [31].
В 2021 г. Passov А. et al. определяли концентрации SDC-1 и HS в артериальной крови у 30 пациентов, перенесших протезирование аортального клапана, непосредственно до и через 1, 5 и 10 мин после демпфирования аорты (реперфузии). Параллельные образцы крови были взяты из коронарного синуса. По сравнению с показателем непосредственно перед декомпрессией аорты артериальный SDC-1 увеличился на 18% (с 253,8 {151,6–372,0}) до 299,1 {172,0-713,7}) нг/ мл; p <0,001), а артериальный HS снизился на 14% (с 148,1 {135,7–161,7} до 128,0 {119,0–138,2} нг/мл; p <0,001] через 1 мин после демпфирования аорты. Во время реперфузии не было отмечено вымывания ни SDC-1, ни HS. Напротив, транскоронарная секвестрация SDC-1 была выявлена на 5-й минуте (-12,96 нг/ мл {-36,38–5,15}; p=0,007) и через 10 мин (-12,37 нг/мл {-31,80–6,62}, p=0,049) после реперфузии. Таким образом, авторы пришли к выводу, что секвестрации SDC-1 и HS могут отражать эндогенное восстановление поврежденного гликокаликса при операции на открытом сердце [32].
ЗАКЛЮЧЕНИЕ
В современном мире остается актуальным поиск и изучение новых биологических маркеров, способных помогать ранней диагностике сердечно-сосудистых заболеваний, служить лабораторным инструментом оценки эффективности проводимой терапии, прогностическим критерием возможных клинических исходов и значимым показателем в стратификации риска [33–35].
В нашем обзоре мы обсудили патофизиологические аспекты SDC-1, многие из которых до сих пор окончательно не ясны. Появляется все больше данных, подчеркивающих важность SDC-1 в качестве нового биологического маркера для диагностики и оценки прогноза у больных кардиологического профиля. Роль SDC-1 при заболеваниях сердца весьма интересна вследствие его защитных эффектов, опосредуемых противовоспалительными свойствами. Тем не менее точная функция данного биологического маркера еще до конца не понятна, вследствие того что показана его роль в ускорении атеросклероза. Окончательное подтверждение диагностической и предиктивной роли данного маркера может быть получена по результатам будущих крупномасштабных проспективных исследований.


