ВВЕДЕНИЕ
Изучение предикторов развития жизнеугрожающих нарушений ритма сердца и внезапной сердечной смерти (ВСС) до настоящего времени представляет значительный интерес. Как известно, к наиболее частым нарушениям ритма сердца, приводящим к ВСС, относят желудочковую тахикардию и фибрилляцию желудочков, субстратом которых служит электрическая нестабильность миокарда [1]. Несмотря на то что достигнуты значительные успехи в верификации предикторов риска ВСС, особое внимание уделяют изменениям длительности интервала QT, отражающим процессы деполяризации и реполяризации желудочков.
Синдром удлиненного интервала QT (LQTS) остается наиболее распространенной наследственной каналопатией и составляет до 20–25% всех случаев ВСС [2]. LQTS представляет собой гетерогенное семейство сердечных электрофизиологических нарушений, характеризующихся удлинением интервала QT и отклонениями зубца T на электрокардиограмме [3]. В основу диагностических критериев данного синдрома входят оценка риска по шкале Шварца, обнаружение патогенной мутации в одном из генов, длительность корригированного интервал QT, а также отсутствие кардиальных причин пролонгации интервала [4]. Выделяют 17 подтипов LQTS, связанных с моногенными мутациями 15 аутосомно-доминантных генов, а именно генов KCNQ1, KCNH2, SCN5A, ANKB, KCNE1, KCNE2, KCNJ2, CACN1C, CAV3, SCN4B, AKAP9, SNTA1, KCNJ5, CALM1, CALM2 [5]. Мутации и полиморфизмы вышеперечисленных генов приводят к изменению важных патогенетических механизмов, влияя на работу ионных каналов кардиомиоцитов и длительность интервала QT, способствуя развитию желудочковых нарушений ритма сердца.
Синдром укороченного интервала QT (SQTS) также может приводить к развитию злокачественных желудочковых и предсердных аритмий. Однако обнаружить причинную мутацию в данном случае удается значительно реже. Основными генами, мутации в которых могут привести к развитию SQTS, являются KCNH2, KCNQ1, KCNJ2, CACNA1C, CACNB2B и CACNA2D [6].
Помимо генетических аспектов, доказано влияние иных факторов, предрасполагающих к увеличению дисперсии интервала QT и росту частоты случаев ВСС: это возраст старше 45 лет, курение, избыточная масса тела, ишемическая болезнь сердца, артериальная гипертензия, дислипидемия, гипергликемия и др. [7–9].
Цель настоящего исследования – изучить ассоциацию некоторых молекулярно-генетических маркеров с длительностью интервала QT у мужчин в Сибирском регионе и сравнить полученные результаты с данными в других этнических группах.
МАТЕРИАЛ И МЕТОДЫ
Базой для набора изучаемых групп служили популяционные репрезентативные выборки, сформированные в период с 2003 по 2017 г. в НИИ терапии и профилактической медицины – филиале Федерального исследовательского центра Институт цитологии и генетики Сибирского отделения РАН (г. Новосибирск) в рамках международного проекта HAPIEE (Health, Alcohol and Psychosocial factors In Eastern Europe) и скрининга молодых людей (возраст 25–44 лет).
В исследование вошли мужчины в возрасте 25–69 лет, проживающие в Новосибирске (n=1353). Из нескольких возрастных когорт (25– 29, 30–34, 35–39, 40–44 лет и т.д.) были сформированы следующие группы: с самым коротким (n=185), средним (n=178) и самым длинным интервалом QT (n=179). Распространенность сердечно-сосудистых заболеваний в представленных группах статистически значимо не различается.
В программу обследования исходных выборок были также включены социально-демографические и клинико-анамнестические данные:
- наличие вредных привычек (курение);
- результаты объективного осмотра (рост, вес, индекс массы тела, окружность талии, окружность бедер, систолическое, диастолическое, пульсовое артериальное давление, частота сердечных сокращений);
- биохимические показатели (общий холестерин, липопротеиды низкой и высокой плотности, триглицериды, глюкоза сыворотки крови);
- электрокардиографические данные – интервал QT корригированный (QTc), рассчитанный по формуле Базетта: QTc = QT/√RR.
Выделение ДНК из 10 мл венозной крови выполнялось методом фенол-хлороформной экстракции.
Выбор возможных молекулярно-генетических маркеров осуществлялся на основании имеющихся литературных данных об их взаимосвязи с длительностью интервала QT. Были выбраны следующие однонуклеотидные полиморфизмы (ОНП): rs1805124, rs11720524 гена SCN5A, rs11756438 гена CEP85L(PLN), rs12576239 гена KCNQ1. Генотипирование изучаемых полиморфизмов проводилось с помощью полимеразной цепной реакции (ПЦР) с последующим анализом длин рестрикционных фрагментов.
Для генотипирования rs1805124 гена SCN5A использовали праймеры 5’-CCAGGGCACCAGCAGTGATGCG-3’(F) и 5’-AAGCCACGTTCCAAGCCGCGG-3’(R).
Амплификацию проводили в следующем температурном режиме: 33 цикла, включающих денатурацию 95 ˚С 30 с, отжиг праймеров 67 ˚С 30 с и элонгацию 72 ˚С 30 с. Рестрикцию выполняли с 10 ед. активности рестриктазы BstHH I («СибЭнзим», Новосибирск) при 50 ˚С в течение 16 ч. Размер продукта амплификации 135 п.н. Детекцию продуктов амплификации и рестрикции осуществляли методом электрофореза в 4% полиакриламидном геле с последующим окрашиванием бромистым этидием.
После проведения рестрикции при генотипе AA детектировался продукт 135 п.н., при генотипе GG – продукты 116 и 19 п.н., при гетерозиготном генотипе – все перечисленные продукты (135, 116, 19 п.н.).
Для генотипирования rs11756438 гена CEP85L(PLN) использовали праймеры 5’-GTGCTAGCTGTTATGGACG-3’(F) и 5’-AAGTCTCACCATGTTGCCC-3’(R).
Амплификацию проводили в следующем температурном режиме: 33 цикла, включающих денатурацию 95 ˚С 30 с, отжиг праймеров 60 ˚С 30 с и элонгацию 72 ˚С 30 с. Рестрикцию проводили с 10 ед. активности рестриктазы Hinf I («СибЭнзим», Новосибирск) при 37 ˚С в течение 16 ч. Детекцию продуктов амплификации и рестрикции осуществляли методом электрофореза в 4% полиакриламидном геле с последующим окрашиванием бромистым этидием. Размер продукта амплификации 177 п.н.
После проведения рестрикции при генотипе AA детектировался продукт 177 п.н., при генотипе CC – продукты 128 и 49 п.н., при гетерозиготном генотипе – все перечисленные продукты.
Для генотипирования rs12576239 гена KCNQ1 использовали праймеры 5’-TTGGATTTCACTCATAGCCT-3’(F) и 5’-CGTTCTCTGATTAACATTTCTGAAC-3’(R).
Амплификацию проводили в следующем температурном режиме: 35 циклов, включающих денатурацию 95 ˚С 30 с, отжиг праймеров 54 ˚С 30 с и элонгацию 72 ˚С 30 с. Рестрикцию проводили с 10 ед. активности рестриктазы Taq I («СибЭнзим», Новосибирск) при 37 ˚С в течение 16 ч. Детекцию продуктов амплификации и рестрикции производили методом электрофореза в 4% полиакриламидном геле с последующим окрашиванием бромистым этидием. Размер продукта амплификации – 177 п.н.
После проведения рестрикции при генотипе TT детектировался продукт 189 п.н., при генотипе CC – продукты 179 и 20 п.н., при гетерозиготном генотипе – все перечисленные продукты.
Генотипирование полиморфизмов rs11720524 гена SСN5A выполнялось с помощью ПЦР в режиме реального времени в соответствии с протоколом фирмы-производителя (зонды TaqMan, Applied Biosystems, США) на приборе StepOnePlus (Applied Biosystems, США).
Статистическую обработку полученных результатов делали с использованием пакета программ SPSS (версия 23.0), а именно с применением таблиц сопряженности для определения частот генотипов и аллелей в исследуемых группах, критерия χ2 для оценки соответствия частот равновесию Харди–Вайнберга, критерия χ2 Пирсона, точного двустороннего критерия Фишера с поправкой Йетса на непрерывность для таблицы 2×2/четырехпольной таблицы. В качестве уровня значимости использовали p <0,05.
Относительный риск по каждому генотипу был рассмотрен как отношение шансов (ОШ). Подчинение распределения признаков нормальному закону проверялось посредством критериев Колмогорова–Смирнова и Шапиро–Уилка. Если признак соответствовал критериям нормального закона распределения, то в дальнейшем применялся однофакторный дисперсионный анализ (one-way ANOVA). При отсутствии нормального распределения использовался тест Крускала–Уоллиса.
Исследование было выполнено с разрешения Локального этического комитета НИИ терапии и профилактической медицины – филиала Федерального исследовательского центра Институт цитологии и генетики Сибирского отделения РАН.
РЕЗУЛЬТАТЫ
Частоты генотипов rs1805124, rs11720524 гена SCN5A, rs11756438 гена CEP85L(PLN), rs12576239 гена KCNQ1 находятся в равновесии Харди–Вайнберга (табл. 1).
Ассоциации однонуклеотидных полиморфизмов rs1805124 гена SCN5A, rs12576239 гена KCNQ1 с длительностью интервала QT нами не обнаружено, в том числе при разделении групп по возрасту (p >0,05).
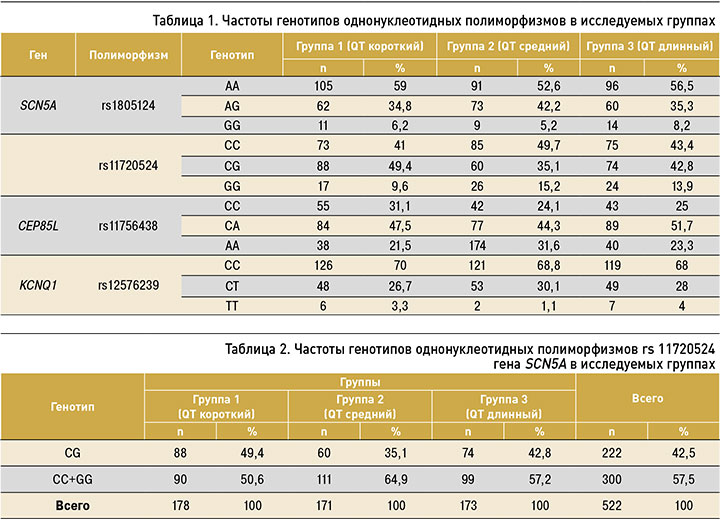
По частотам генотипов rs11720524 гена SCN5A выявлены статистически значимые различия при использовании модели СG vs. CC+GG (табл. 2).
Для носителей генотипов CC и GG характерны большие значения интервала QT по сравнению с носителями гетерозиготных генотипов CG (p=0,025). При разделении групп по возрасту (до 50 лет, 50 лет и старше) выявленные различия сохраняются у мужчин в возрасте до 50 лет (ОШ=1,86; 95% ДИ: 1,12–3,09; р=0,016). Частота гетерозиготного генотипа СG в группе короткого интервала QT составила 55,9%, в то время как в группах со средним и длинным интервалом QT – 40,6%.
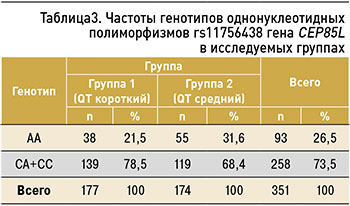
Не обнаружено статистически значимых различий между группами по частотам генотипов и полиморфизмов rs11756438 гена CEP85L. Однако установлено, что гомозиготный генотип AA полиморфизма rs11756438 гена CEP85L в модели AA vs. CA+CC в группе мужчин со средним интервалом QT встречался достоверно чаще относительно группы с коротким интервалом QT – 31,6 против 21,5% соответственно (ОШ=0,59; 95%ДИ: 0,366–0,956; р=0,031; табл. 3). Это свидетельствует о протективном эффекте данного генотипа в отношении укорочения интервала QT.
Согласно U-критерию Крускала–Уоллиса среди прочих факторов следует отметить влияние на принадлежность к той или иной группе QT частоты сердечных сокращений (ЧСС), систолического, диастолического и пульсового АД, индекса массы тела, соотношения «окружность талии/окружность бедер», триглицеридов (p <0,05). В дополнение к этому в рамках общей линейной модели c включением в модель возраста среди статистически значимых факторов, влияющих на длительность интервала QT, оказались ЧСС, вес и рост (p <0,05).
С помощью таблиц сопряженности не удалось подтвердить влияние курения на принадлежность обследуемых к той или иной группе QT. Вместе с тем в модели «не курит vs курит» и «QT длинный vs QT короткий + средний» в группе длинного QT было достоверно меньше некурящих мужчин в возрасте до 50 лет, чем в группах короткого и среднего QT – 43,4 и 56,8% соответственно (ОШ=0,582; 95% ДИ: 0,354–0,957; p=0,033). Влияние уровней общего холестерина, липопротеидов высокой и низкой плотности на группу QT обнаружить не удалось.
ОБСУЖДЕНИЕ
Ген SCN5A, расположенный в позиции 3p21-24, кодирует порообразующую α-субъединицу натриевого канала Na v 1,5 и играет важную роль в инициировании деполяризующих токов натрия, влияя на длительность потенциала действия кардиомиоцитов, возбудимость миокарда. На электрокардиограмме это проявляется изменениями дисперсии интервала QT. Известно, что мутации с усилением функции ведут к увеличению входящего тока натрия в кардиомиоциты, удлинению интервала QT, являясь этиопатогенетическим звеном LQT3. Мутации с потерей функции SCN5A характеризуются обратными изменениями, развитием синдрома Бругада. Кроме того, известны мутации, которые могут приводить к развитию дилатационной кардиомиопатии, вызывать изолированные дефекты проводимости сердца [10].
В ряде публикаций, в том числе в работах Gouas L. et al. (2007), Qureshi S.F. et al. (2015) и др., ОНП rs1805124 гена SCN5A (c.1673 A> G) упоминался в качестве полиморфизма, в котором генотип AA и частота аллеля A встречались чаще у пациентов с удлиненным интервалом QT; это предполагает его этиологическую роль в LQTS [11, 12]. Дополнительно генотип AG полиморфизма rs1805124 относят к генетическим предикторам идиопатических нарушений атриовентрикулярной и внутрижелудочковой проводимости [13]. В нашем исследовании при сравнении групп с разной длительностью интервала QT не выявлено статистически значимых различий по частотам генотипов полиморфизма rs1805124 гена SCN5A.
ОНП rs11720524 (с.-52-562 C> G) гена SCN5A в датском исследовании GEVAMI был связан с ВСС, ассоциирован с фибрилляцией желудочков (ФЖ), вызванной острым инфарктом миокарда с подъемом интервала QT. Аллель C rs11720524 присутствовал в 64% случаев, а гомозиготный генотип CC был достоверно связан с ФЖ (ОШ 1,87; 95% ДИ: 1,12–3,12; р=0,017). После учета клинических различий между основной и контрольной группами (таких как возраст, пол, семейный анамнез ВСС, потребление алкоголя, предшествующая фибрилляция предсердий, прием статинов, стенокардия, критическая артерия и тромболизис при инфаркте миокарда) генотип СС rs11720524 все еще был значимо связан с ФЖ (ОШ 1,9; 95% ДИ: 1,05–3,43; р=0,032). Учитывая функциональные значения гена SCN5A, развитие жизнеугрожающих нарушений ритма и аритмогенной ВСС связывали с изменением длительности интервала QT. Однако в исследовании Jabbari R. et al. (2017) данную ассоциацию подтвердить не удалось [14]. В полученных нами результатах у носителей генотипов CC и GG регистрировались большие значения QT по сравнению с носителями гетерозиготного генотипа СG, что подтверждает ассоциацию ОНП с длиной интервала QT.
В рамках консорциума QTGEN минорный аллель ОНП rs11756438 (С>A), расположенный на хромосоме 6q22.31 в интронной области вблизи генов SCL35F1 и CEP85L(PLN), был ассоциирован с более длинным интервалом QT на 0,09 SD. Ген PLN кодирует фосфоламбан, ингибитор Са2+-АТФазы сердечного саркоплазматического ретикулума, играя роль в передаче сигналов кальция в кардиомиоцитах [15]. Согласно нашим результатам, генотип AA встречался в группе мужчин со средним интервалом QT чаще, чем в группе с коротким интервалом, что частично подтверждает уже известные данные.
Ген KCNQ1, расположенный в локусе 11p15.5, кодирует α-субъединицу калиевого канала K V 7.1; ее функциональная активность проявляется совместно с β-субъединицами KCNE1, генерируя калиевый ток задержанного выпрямления. Потеря подобной функции приводит к удлинению интервала QT и развитию аритмий. Анализ генетических модификаторов тяжести заболевания у пациентов с LQTS в работе Kolder I.C.R.M. et al. (2015) установил взаимосвязь ОНП rs12576239 (С>T) гена KCNQ1 с LQTS, где аллелем риска выступал аллель Т [16]. Подтвердить эту ассоциацию нам не удалось, как и исследователям Peter A. et al. (2011), которые в своей работе выявили ассоциацию rs12576239 только с ВСС [17].
Межэтническое исследование Avery C.L. et al., которое было проведено в 2016 г. на афро- и латиноамериканской популяции с целью идентификации ранее известных и новых ОНП, связанных с удлинением интервала QT, включало некоторые вышеперечисленные ОНП – rs12576239 гена KCNQ1, rs1805124 гена SCN5A, а также rs11756438 гена CEP85L. По результатам этого исследования ассоциация ОНП rs12576239 гена KCNQ1 и rs11756438 гена CEP85L с удлинением интервала QT подтверждена не была. В свою очередь, rs1805124 гена SCN5A показал себя как новый вероятный популяционно-специфический сигнал, влияющий на длительность интервала QT, что частично согласуется с полученными нами результатами [18].
ЗАКЛЮЧЕНИЕ
С длительностью интервала QT ассоциированы ОНП rs11720524 гена SCN5A и rs11756438 гена CEP85L. Не подтверждена ассоциация с длительностью интервала QT полиморфизма rs1805124 гена SCN5A, rs12576239 гена KCNQ1.
Авторы выражают глубокую признательность статистикам Л.В. Щербаковой и Е.Г. Веревкину за подготовку баз данных.



