ВВЕДЕНИЕ
МикроРНК (miRNA) – это эндогенные, консервативные, одноцепочечные, небольшие (≈22 нуклеотида) некодирующие РНК [1]. Они играют роль в регуляции различных биологических процессов, включая эмбриогенез, пролиферацию и дифференциацию клеток, апоптоз и туморогенез [1, 2].
Первая miRNA, lin-4, была идентифицирована у свободно живущей нематоды (круглого червя) Caenorhabditis elegans в 1993 г. [3]. Lin-4 регулирует развитие C. elegans путем связывания с miRNA lin-14 и подавления экспрессии белка lin-14 [3]. Первая miRNA у человека (let-7) была обнаружена в 2000 г. [2]. В 2007 г. miRNA были впервые идентифицированы в периферической крови [4].
MiRNA регулируют экспрессию генов на посттранскрипционном уровне через связывание с 3’-нетранслируемыми участками miRNA-мишени [1]. Транскрипция miRNA начинается с формирования длинной молекулы первичной miRNA (pri-miRNA), из которой в дальнейшем при участии фермента Дроша в ядре образуется шпилечная структура – предшественник miRNA (pre-miRNA) [5]. После транспортировки в цитозоль pre-miRNA разрезается ферментом Дайсер-1, в результате чего образуются одноцепочечные зрелые miRNA. MiRNA ингибируют трансляцию и/или вызывают деградацию своей целевой miRNA в зависимости от степени комплементарности, а также количества и доступности связывающих участков [5]. Чем больше комплементарность между miRNA и его мишенью/мишенями, тем более вероятно, что miRNA приведет к их деградации (рис. 1) [1, 5].
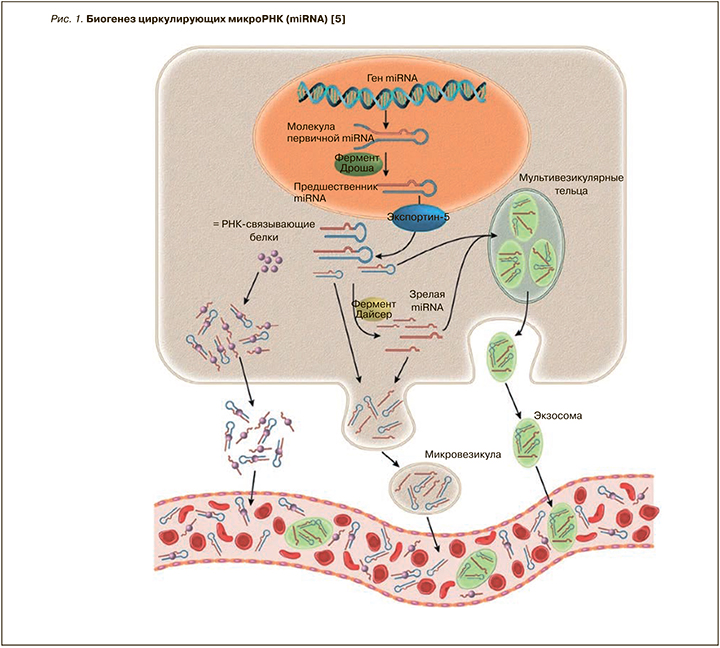
Доказано, что геном человека кодирует около 1000 miRNA. Из них более 100 были обнаружены в сыворотке крови здоровых людей [6]. Большая часть miRNA локализована внутри клетки; при этом незначительная доля miRNA найдена и во внеклеточном пространстве – слезной и семенной жидкостях, слюне, моче, спинномозговой жидкости и в грудном молоке [7].
MiRNA регулирует экспрессию около 30% генов, кодирующих структуру белка в организме человека. К настоящему времени мишени большинства miRNA неизвестны; возможно, это достаточно широкий диапазон – от одного до нескольких сотен генов [8]. В отличие от внутриклеточных miRNA, циркулирующие miRNA демонстрируют стабильность и устойчивость к деградации эндогенной RNA [1]. Циркулирующие miRNA защищены от RNAазы и других форм ферментов деградации за счет локализации в мембранных везикулах (экзосомах, микровезикулах). Также вне клетки miRNA связанны с транспортными белками (белками семейства Argonaute) и могут находиться внутри макромолекулярных комплексов, например в липопротеидах высокой плотности [1, 9, 10].
Экспрессия miRNA может наблюдаться как в образцах тканей, так и в бесклеточных биологических жидкостях, таких как сыворотка или плазма крови. Современные методологии, используемые для обнаружения miRNA, включают количественную полимеразную цепную реакцию (ПЦР, qPCR), гибридизацию in situ, микрочипы и секвенирование RNA [10, 11].
МикроРНК (miRNA) И СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ: ДАННЫЕ ИССЛЕДОВАНИЙ
Идеальный биологический маркер должен соответствовать следующим критериям: 1) доступность в качестве неинвазивного метода; 2) устойчивость к воздействиям извне (например, к ферментному расщеплению, замораживанию и разморозке, колебаниям водородного показателя среды); 3) высокая степень чувствительности и специфичности; 4) ранняя идентификация; 5) длительный период полураспада; 6) сопоставимость профилей в норме у женщин и мужчин, а также у людей разных возрастных категорий. MiRNA чрезвычайно стабильны в кровотоке и могут быть легко обнаружены с высокой чувствительностью и специфичностью при амплификации гена ERBB2 (HER2/neu) методом флуоресцентной гибридизации [5, 12].
В последние годы циркулирующие miRNA были исследованы как перспективные биомаркеры при сердечно-сосудистых заболеваниях (ССЗ) [5, 12].
В сердечной ткани эмбрионального и взрослого организма человека на всех этапах развития были идентифицированы miRNA (miR-21, miR- 29a, miR-129, miR-210, miR-211, miR-320, miR-423 и let-7c) [13]. Критическая роль miRNA во время эмбрионального и постнатального развития сердца была установлена в экспериментальных исследованиях, в которых удаляли фермент Дайсер. Это неспецифическое нарушение многих miRNA приводило к отеку перикарда, нарушению развития миокарда желудочков и ранней смерти мышей [14]. У здорового взрослого человека был выявлен ряд miRNA, которые экспрессируются в сердечной ткани и, таким образом, могут играть ключевую роль в функционировании сердца как в норме, так и при патологии. К ним относятся miR-1, miR-16, miR-27b, miR-30d, miR-126, miR-133, miR-143, miR-208 и семейство let-7 [13, 15].
Исследования, изучающие роль циркулирующих miRNA при сердечной недостаточности (СН), идентифицировали miRNA с измененными уровнями экспрессии у пациентов с этой патологией: miR-122, miR- 210, miR-423-5p, miR-499 и miR-622 [15].
В 2015 г. турецкими врачами (Cakmak Н.А. et al.) проведено исследование, в рамках которого было обследовано 20 пациентов с хронической сердечной недостаточностью (ХСН) I и II функционального классов (ФК), 22 пациента с ХСН III и IV ФК (в соответствии с классификацией NYHA) и 15 здоровых добровольцев контрольной группы. Профилирование miRNA проводили с использованием метода микрочипов. Были получены следующие результаты: профилирование микроматрицы выявило увеличение уровня экспрессии miR-21, miR-650, miR-744, miR-516-5p, miR-1292, miR-182, miR-1228, miR-595, miR-663b, miR-1296, miR-1825, miR-299-3p, miR-662, miR-122, miR-3148 и miR-518e и снижение экспрессии miR-129-3p, miR-3155, miR-3175, miR-583, miR-568, miR-30d, miR-200a-star, miR-1979, miR-371-3p, miR-155-star и miR-502- 5p в сыворотке крови пациентов с ХСН. Было установлено, что в плане прогностической ценности miR-182 (площадь под кривой, AUC 0,695) превосходит предшественник мозгового натрийуретического пептида (NT-proBNP; AUC 0,350) и высокочувствительный С-реактивный белок (вчСРБ; AUC 0,475). Регрессионный анализ Кокса выявил, что miR-182 может прогнозировать сердечно-сосудистую смертность (p=0,032). Таким образом, ученые продемонстрировали повышенный уровень экспрессии циркулирующих miRNA при ХСН по сравнению с контрольной группой. Кроме того, было обнаружено, что miR-182 служит потенциальным прогностическим маркером при СН [16].
Исследования, направленные на изучение конкретных miRNA, продемонстрировали высокий уровень экспрессии miRNA-24, -100, -125b, -195, -199a, -214 и низкий уровень экспрессии miRNA- 18, семейств miRNA-19 и miRNA-133 у пациентов ХСН вследствие ишемической кардиомиопатии и идиопатической дилатационной кардиомиопатии (ДКМП) [17, 18].
Ovchinnikova E.S. et al. отметили снижение уровней экспрессии miRNA (miR-18a, miR-27a, miR-30e, miR-26b, miR-199a, miR-106a, miR-652, let-7i, miR-18b, miR-18a, miR-223, miR-301a, miR-652, miR-423) в течение 48 ч после развития острой СН [19].
По данным Sygitowicz G. et al., miR-21 активируется, а miR-1 подавляется у пациентов с СН. Кроме того, отмечено снижение уровней экспрессии miR-1 при утяжелении ФК ХСН, а также отрицательная корреляционная связь с концентрацией NT-proBNP у пациентов с II и III ФК СН по NYHA [20].
Появляется все больше данных о том, что уровень экспрессии miR-210 в плазме крови положительно коррелируют с ФК ХСН по NYHA и концентрацией NT-proBNP [21].
Отмечено снижение уровней экспрессии miR- 126 и miR-423 у больных с СН, при этом более низкий уровень экспрессии miR-423 позволяет прогнозировать смертность в течение одного года [22, 23].
В двух независимых группах, состоящих из 2203 больных, miR-1254 и miR-1306 были связаны с повышенным риском летальности и повторных госпитализаций при ХСН [24]. Наряду с этим miR-1306 продемонстрировал предиктивную способность в отношении неблагоприятных клинических исходов у пациентов с острой СН [25].
Ирландскими исследователями Watson C.J. et al. было показано, что диагностическая значимость мозгового натрийуретического пептида (BNP) была улучшена при использовании в комбинации с циркулирующими miR-30c, miR-221, miR-328, miR-146a и miR-375. Кроме того, комбинации двух или более miRNA с BNP смогли значительно улучшить прогностическую ценность моделей, позволяющих отличить СН с сохраненной фракцией выброса левого желудочка (ФВ ЛЖ) от СН со сниженной ФВ ЛЖ, по сравнению с использованием только BNP [26].
Сотрудники лаборатории молекулярной биологии РНК Медицинского института Говарда Хьюза получили данные о том, что медицинские вмешательства связаны с изменениями уровней экспрессии miRNA. По сравнению со стабильными пациентами с ХСН, у больных с декомпенсированной сердечной недостаточностью, имеющих имплантированное вспомогательное устройство ЛЖ, отмечались более высокие уровни экспрессии miR-208b, miR-208a и miR-499, miR-1 и miR-133b [27].
Согласно результатам ученых из Швеции, после кардиоплегии и реперфузии miR-208b и miR-499 экспрессируются в коронарный синус в значительно более высоких уровнях, чем до вмешательств [28].
Целью проспективного нерандомизированного протокола, проведенного сотрудниками кафедры гериатрии и метаболических заболеваний университета города Неаполь и включившего 81 пациента с сердечной недостаточностью и диссинхронией желудочков, было изучение связи обратного ремоделирования ЛЖ после сердечной ресинхронизирующей терапии с изменениями уровней экспрессии miRNA. Пациенты, ответившие на лечение, имели более высокие уровни экспрессии miR-26b, miR-145, miR-92a, miR-30e и miR-29a по сравнению с лицами, не ответившими на назначенное лечение [29]. Американские и китайские врачи доложили, что исходные уровни экспрессии miR- 30d и miR-1306 связаны с изменениями параметров ремоделирования ЛЖ в ответ на сердечную ресинхронизирующую терапию у пациентов с прогрессирующей ХСН, а также с однолетней общей смертностью при острой сердечной недостаточности [30, 31].
В 2017 г. Zhang J. et al. провели исследование по изучению miRNA-21 у пациентов с СН. Уровни экспрессии miRNA-21 и концентрацию BNP определяли в крови, полученной из периферической вены (miRNA-21-PV) и коронарного синуса (miRNA-21-CS) у 80 пациентов с СН и у 40 здоровых людей. Уровни экспрессии сывороточных miRNA-21-PV и miRNA-21-CS у пациентов при СН были значительно выше, чем в контрольной группе, а также коррелировали с ФВ ЛЖ и уровнем BNP. Оба РНК-биомаркера продемонстрировали высокие показатели чувствительности и специфичности для диагностирования СН [32].
В рамках исследования Zhang М. et al. уровни экспрессии miR-145 определяли при использовании количественной ПЦР в реальном времени. Логарифмическое преобразование уровней miRNA-145 (Ln_miRNA-145) применяли для статистического анализа из-за искаженного распределения данных. Были получены следующие результаты: уровни экспрессии miR-145 в плазме оказались значительно ниже у пациентов с острым инфарктом миокарда по сравнению с пациентами из группы без ишемической болезни сердца (-6,38±0,11 против -4,47±0,17; p <0,0001) и по сравнению с пациентами без СН. Также уровни экспрессии miR-145 были значимо ниже у пациентов с СН (-6,91±0,20 против -5,35±0,13; p <0,0001). Было обнаружено, что более низкие уровни экспрессии miRNA-145 достоверно коррелировали с повышенными концентрациями BNP (коэффициент корреляции ранга Спирмена (ρ) =-0,60; p <0,0001), тропонина T (ρ=0,62; p <0,0001) и сниженной ФВ (ρ=0,65; p <0,0001). В многомерном линейном регрессионном анализе острый инфаркт миокарда и СН были независимо связаны с более низкой Ln_miRNA-145 (p=0,001 и p=0,004 соответственно) [33].
Scrutinio D. et al. показали, что ассоциация miR-150-5p с дезадаптивным ремоделированием, тяжестью заболевания и исходом подтверждает патофизиологическое значение подавленной экспрессии miR-150-5p при острой СН [34].
В 2018 г. сотрудниками Китайского медицинского университета г. Шэньян выполнено исследование miRNA-132 на моделях СН у мышей. Ученые показали, что избыточная экспрессия miRNA-132 резко увеличила антиоксидантный стресс и антиапоптотическую способность кардиомиобластов мышей (H9C2) и снизила экспрессию трансформирующего фактора роста (бета TGF-β1) и smad3 – белков SMAD, которые являются преобразователями сигналов и транскрипционными модуляторами, опосредующими несколько сигнальных путей (Mothers against decapentaplegic homolog 2, Similar to Mothers Against Decapentaplegic) [35].
В том же году Masson S. et al. проанализировали прогностическую ценность конкретного кандидата miRNA в большой когорте пациентов с ХСН, включенных в многоцентровое клиническое исследование. Уровни экспрессии miR-132 в плазме измеряли с использованием miRNA-специфичных технологий на основе ПЦР при рандомизации у 953 пациентов с ХСН из исследования GISSI-Heart Failure. Связь со смертельным исходом (от всех причин и сердечно-сосудистая смерть) и нефатальными событиями (время до первой госпитализации в связи с ССЗ или декомпенсацией СН), а также прогноз возрастающего риска оценивались в скорректированных моделях. Более высокие уровни экспрессии miR-132 продемонстрировали независимую связь с более молодым возрастом, лучшей почечной фильтрацией, ишемической этиологией СН, более тяжелыми симптомами СН, более высоким диастолическим артериальным давлением, более высоким холестерином и мужским полом. После обширной корректировки демографических, клинических и эхокардиографических факторов риска и исходных концентраций NT-proBNP miR-132 оставался связанным только с госпитализацией по поводу СН (отношение рисков (ОР) 0,79; 95% ДИ: 0,66–0,95; p=0,01) и улучшал прогнозирование риска (индекс непрерывной чистой реклассификации (cNRI) 0,205; p=0,001) [36].
Протокол китайских ученных Chen F. et al. был направлен на исследование микроматрицы miRNA плазмы крови по всему геному у 13 пациентов с СН и 3 человек из контрольной группы. Уровни экспрессии выбранных дифференциально экспрессируемых miRNA с повышенной регуляцией (miR-3135b, miR-3908 и miR-5571-5p) были подтверждены количественными анализами ПЦР в реальном времени в независимой когорте из 33 пациентов с СН и 20 из контрольной группы. Результаты были следующими: из всех проанализированных miRNA уровни экспрессии miR-3135b (p <0,001), miR-3908 (p <0,001) и miR-5571-5p (p <0,001) при СН значительно отличались от контрольной группы. Кривые ROC для miR-3135b, miR-3908 и miR-5571-5p выявили значения AUC 1,00, 0,86 и 0,94 соответственно. Что еще более важно, miR-3135b и miR-3908 были способны отличать СН со сниженной ФВ ЛЖ от СН с сохраненной ФВ ЛЖ (p <0,05). Уровень экспрессии miR-5571-5p в плазме крови был статистически достоверно связан с ФК СН по NYHA (p <0,001) [37].
В 2019 г. проведено исследование по анализу miRNA-155 у пациентов с СН после перенесенного острого инфаркта миокарда. Уровни экспрессии miRNA-155 у пациентов с СН были достоверно выше, чем в контрольной группе и группе острого инфаркта миокарда. Площадь под кривой AUC сывороточной miRNA-155 при диагностике СН после острого инфаркта миокарда составила 0,941, пороговое значение – 1,77, чувствительность – 92,73%, а специфичность – 92,14%. Концентрации NT-proBNP были значительно выше, а ФВ ЛЖ ниже у пациентов как с высокими, так и низкими уровнями экспрессиями miRNA-155 [38].
Xiao J. et al. была выполнена работа по изучению прогностической ценности miR-30d у пациентов с острой СН. В исследование были включены 96 больных с клиническим диагнозом «острая СН», находившихся под наблюдением в течение 1 года. Уровень экспрессии miR-30d в сыворотке крови был значительно ниже у пациентов с острой СН, умерших в течение 1 года наблюдения, по сравнению с теми, кто выжил. Одномерный логистический регрессионный анализ выявил 18 переменных, которые были связаны со смертностью от всех причин. Многомерный логистический регрессионный анализ позволил обнаружить всего 4 переменные, связанные с летальностью: частоту сердечных сокращений (ЧСС), уровень гемоглобина, концентрацию натрия и уровень экспрессии miR-30d в сыворотке крови. Анализ кривой ROC показал, что гемоглобин, ЧСС и концентрация натрия в сыворотке продемонстрировали слабую прогностическую ценность для острой СН (AUC не выше 0,700) в сравнении с уровнем экспрессии miR-30d (AUC=0,806). Анализ выживаемости Каплана–Мейера подтвердил, что пациенты с более высокими уровнями экспрессии miR-30d имели статистически значимо более низкую летальность (p =0,001) [30].
Согласно результатам исследования Zhang L. et al., больные СН со сниженной ФВ ЛЖ (0,87; 95% ДИ: 0,37–1,45) имели значительно более низкий уровень экспрессии miR-19b, чем группа больных СН с сохраненной ФВ ЛЖ (1,32; 95% ДИ: 0,63–2,51) и контрольная группа (1,82; 95% ДИ: 0,37– 1,45; в обоих случаях p <0,001). Отмечена заметная отрицательная корреляция между miR-19b и NT-proBNP (p <0,001). Дополнительное использование miR-19b не улучшило точность NT-proBNP в диагностике СН у лиц контрольной группы (оба AUC=0,98; 95% ДИ: 0,97–0,99). Но в том, что касалось отличий СН с сохраненной ФВ ЛЖ от СН со сниженной ФВ ЛЖ, miR-19b и NT-proBNP дали значительно более высокую AUC, чем один только NT-proBNP (0,85; 95% ДИ: 0,80–0,90 против 0,66; 95% ДИ: 0,58–0,74; p <0,001), а чувствительность и специфичность диагностики СН со сниженной ФВ ЛЖ возросла с 58 до 77% и с 75 до 79% соответственно. Авторы резюмировали, что, помимо NT-proBNP, miR-19b улучшает диагностику этой формы СН, но ввиду удовлетворительной точности NT-proBNP в прогнозировании СН в группе контроля miR-19b не показала дополнительных преимуществ [39].
В 2020 г. D’Alessandra Y. et al. показали, что miRNA (miR-1, -154, -21, -221, -376a, -379, -382, -409-5p, -423-5p, -499-5p, -654-5p, и -7) служат потенциальными диагностическими и прогностическими биологическими маркерами СН [40].
Целью исследования Liu J. et al. было изучение нового маркера miR-652-3p в качестве диагностического и прогностического лабораторного инструмента у пациентов с острой СН. Ретроспективно были проанализированы данные 196 пациентов, в том числе 65, у которых развилось острое почечное повреждение (ОПП) во время госпитализации. Показатели липокалина, связанного с желатиназой нейтрофилов (NGAL), измеряли в образцах сыворотки и мочи. Количественная ПЦР в реальном времени применялась для оценки уровня экспрессии miR-652-3p. Показатели NGAL и miR-652-3p в сыворотке и моче были повышены у пациентов с острой СН и ОПП. Экспрессия miR-652-3p продемонстрировала диагностическое значение для прогнозирования начала ОПП у пациентов с острой СН и улучшала диагностическую значимость NGAL. Пациенты с ОПП и высоким уровнем экспрессии miR-652-3p имели высокую летальность в течение 180 дней. Авторы резюмировали, что miR-652-3p в сыворотке и моче могут быть потенциальными кандидатами на роль биомаркеров для ранней диагностики и прогнозирования ОПП у пациентов с острой СН. Комбинация NGAL и miR-652-3p может точно предсказать начало ОПП при острой СН [41].
В 2021 г. Jin Li S. et al. на моделях ишемической СН у крыс и мышей установили, что усиление функции miR-30d (генетической, лентивирусной или агомиР-опосредованной) улучшает сердечную функцию, снижает фиброз миокарда и уменьшает апоптоз кардиомиоцитов. Экспериментальный нокдаун экспрессии miR-30d потенцирует патологическое ремоделирование ЛЖ с усилением дисфункции, выраженности фиброза и гибели кардиомиоцитов. RNA-секвенирование роста и потери функции miR-30d in vitro использовалось для идентификации и проверки прямых мишеней miR-30d. Экспрессия miR-30d избирательно повышается в кардиомиоцитах, индуцируется гипоксическим стрессом и обладает защитным действием, направленным на митоген-ассоциированную протеинкиназу 4 (MAP4K4) для уменьшения апоптоза. Более того, miR-30d секретируется главным образом внеклеточными везикулами кардиомиоцитов и ингибирует пролиферацию и активацию фибробластов путем прямого воздействия на интегрин-α5 в острой фазе ишемического ремоделирования посредством паракринной передачи сигналов сердечным фибробластам [42].
В том же году Li D.-M. et al. обследовали 120 пациентов с СН и 60 здоровых добровольцев. Больные СН со сниженной ФВ ЛЖ имели значительно более высокий уровень экспрессии miR-208a (p <0,001). Дополнительное использование miR-208a и NT-proBNP дало значительно более высокую AUC, чем использование только NT-proBNP (0,83; 95% ДИ: 0,76–0,90 против 0,73; 95% ДИ: 0,64–0,82); кроме того, это привело к увеличению чувствительности и специфичности до 68,0 и 90,2% соответственно. Таким образом, использование miR-208a в сочетании с NT-proBNP у пациентов с СН со сниженной ФВ ЛЖ усиливает диагностическую роль последнего [43].
В исследовании, проведенном на базе отделения внутренней медицины Венского медицинского университета, оценивались miRNA (miR-21, miR-29a, miR-122, miR-132, miR-133a, miR-let7i) у пациентов с тяжелой митральной регургитацией. Среди панели оцениваемых miRNA miR-133a наиболее сильно коррелировала со степенью тяжести митральной регургитацией (r=-0,41; p=0,001). Повышенные уровни экспрессии miR-133 также были ассоциированы с высоким риском сердечно-сосудистой смерти и/или повторной госпитализацией в связи с декомпенсацией ХСН (ОР 1,85; 95% ДИ :1,24–2,76; p=0,003) [44].
Brundin М. et al. выполнено сравнение пациентов с идиопатической ДКМП и ИБС в контексте уровней экспрессии miRNA, а также параметров магнитно-резонансной томографии (МРТ) сердца. Было обследовано 135 пациентов: 53 пациента с ДКМП (средний возраст 59±12 лет), 34 пациента с ишемической болезнью сердца (66±9 лет) и 48 пациентов контрольной группы (64±5 лет). Были проанализированы и оценены уровни экспрессии семи различных miRNA: 16-5p, 21-5p, 29-5p, 133a-3p, 191-5p, 320a и 423-5p. Уровни экспрессии miR-29-5p были увеличены у пациентов с ДКМП по сравнению с больными ишемической болезнью сердца (p <0,005), а уровни экспрессии miR-320a были повышены при ДКМП по сравнению со здоровыми добровольцами (p <0,05). Не было значимой связи между уровнями экспрессии miR и параметрами МРТ сердца [45].
В 2021 г. в Словакии проведено исследование уровней экспрессии miR-21 в качестве диагностического маркера при СН. Были обследованы пациенты с СН со сниженной ФВ ЛЖ (n=19), группу контроля составили здоровые добровольцы (n=11). Уровни экспрессии miR-21 были уменьшены у пациентов с СН со сниженной ФВ ЛЖ по сравнению с контрольной группой (p <0,05); не было отмечено корреляции с ФК ХСН, ФВ ЛЖ и NT-proBNP. Уровни экспрессии miR-21 заметно снижались у пациентов с анемией относительно пациентов с нормальным гематокритом (p <0,05). Обнаружена значимая связь между miR-21, гематокритом (p <0,05) и концентрацией гемоглобина (p <0,05). Не было обнаружено никакой корреляции между процентом гемолиза и miR-21 [46].
Исследование Jin Y. et al. было направлено на изучение потенциальной диагностической роли miR- 214, BNP, NT-proBNP и стимулирующего фактора роста (sST2) при СН. Авторы пришли к выводу, что miR-214, BNP, NT-proBNP и sST2 могут применяться в качестве эффективных биомаркеров СН, обеспечивая новую стратегию диагностики и оценки степени тяжести этого заболевания [47].
Целью исследования немецких врачей Aleshcheva G. et al. стало выявление и оценка прогностической роли miRNA в сыворотке крови пациентов с воспалительными заболеваниями сердца, диагностированными после проведения эндомиокардиальной биопсии. Было обследовано 184 пациента с воспалительными и/или вирусно-индуцированными заболеваниями миокарда, 25 пациентов с идиопатической ДКМП и 25 здоровых добровольцев. Экспрессии let-7f, miR-197, miR-223, miR-93 и miR-379 позволили отличить пациентов с вирусом и/или воспалением от здоровых добровольцев (p <0,05, специфичность более 93%). Основываясь на экспрессии miR-21 и miR-30a-5p, идентифицированы пациенты с ДКМП (p <0,05, специфичность >95%). Ученые резюмировали, что данный профиль miRNA может быть использован как перспективный неинвазивный диагностический инструмент для выявления пациентов с внутримиокардиальным воспалением и/или вирусной персистенцией при помощи только одного образца сыворотки независимо от назначенной терапии и времени появления симптомов [48].
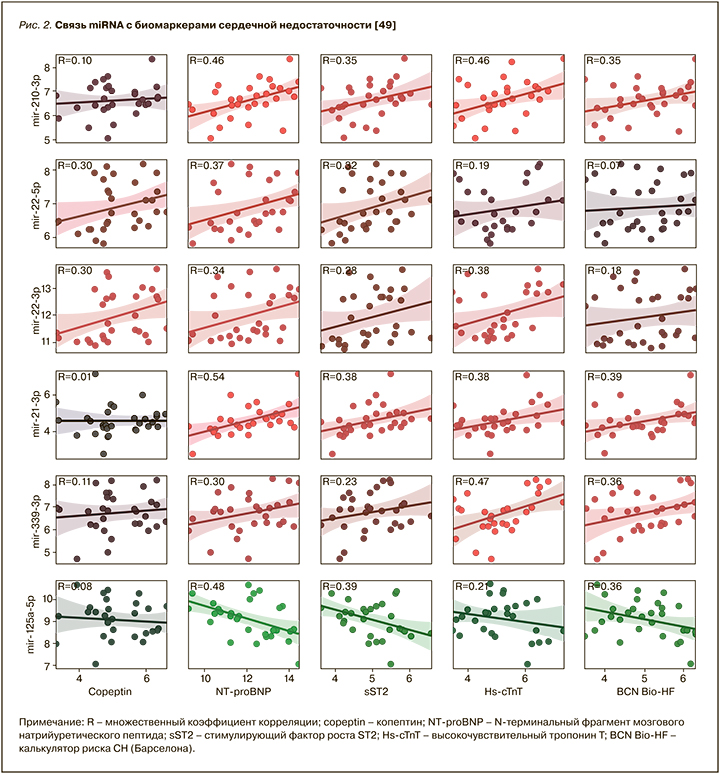
Galluzzo A. et al. было показано, что шесть miRNA (miR-210-3p, miR-22-5p, miR-22-3p, miR-21-3p, miR-339-3p и miR-125a-5p) значимо коррелировали с биомаркерами СН. Уровни экспрессии miR-210-3p, miR-22-5p, miR-22-3p, miR-21-3p и miR-339-3p положительно коррелировали с концентрацией NT-proBNP (множественный коэффициент корреляции (R) ≥0,30). Кроме того, эти miRNA показали положительную связь с другим маркерами СН, среди которых копептин, sST2 и высокочувствительный сердечный тропонин (hs-cTnT; R ≥0,30). Отмечена отрицательная связь miR-125a-5p с NT-proBNP и sST2 (R <-0,30). Более того, miR-210-3p, miR-21-3p и miR-339-3p положительно коррелировали с параметрами калькулятора риска СН, Барселона bioHF (R <0,30), тогда как miR-125a-5p показывала отрицательную корреляцию (R=-0,36; рис. 2) [49].
В 2021 г. ученые из Бельгии сообщили, что miR-181c является лабораторным маркером ответа на тренировку с физической нагрузкой у больных СН с сохраненной ФВ ЛЖ. Высокие уровни экспрессии miR-181c способны помочь в установлении уровня физической нагрузки до начала обучения, тем самым обеспечивая возможность индивидуального подхода [50]. В этом же году получены аналогичные данные по Let-7b, miR-23a, miR-140, miR-146a, miR-191, miR-210 и miR-339-5p для пациентов с СН со сниженной ФВ ЛЖ [51].
Профессор Taubel J. из Лондонского университета Святого Георгия и его команда опубликовали данные по CDR132L-специфическому антисмысловому олигонуклеотиду, который является первым в своем классе ингибитором miR-132 и, по данным доклинических исследований, улучшает показатели СН. Целью данного клинического исследования фазы 1b была оценка безопасности, фармакокинетики, целевого воздействия и фармакодинамических эффектов CDR132L у пациентов, получающих стандартную терапию ХСН в рандомизированном плацебо-контролируемом двойном слепом исследовании. Пациенты имели ФВ от ≥30 до <50% и NT-proBNP >125 нг/л. 28 пациентов были рандомизированы для получения CDR132L (0,32, 1, 3 и 10 мг/кг массы тела) или плацебо (0,9% физиологический раствор) в виде двух внутривенных инфузий с интервалом 4 нед. CDR132L показал безопасность и хорошо переносился, не было отмечено явной ограничивающей дозу токсичности. Подход к моделированию фармакокинетических/фармакодинамических доз предполагает эффективный уровень дозы при CDR132L ≥1 мг/кг. CDR132L приводил к дозозависимому устойчивому снижению miR-132 в плазме крови. У пациентов, получавших CDR132L ≥1 мг/кг, наблюдалось среднее снижение NT-proBNP на 23,3% по сравнению со средним увеличением на 0,9% в группе контроля. CDR132L индуцировал уменьшение длительности комплекса QRS и положительно влиял на маркеры фиброза. Таким образом, данный протокол стал первым клиническим испытанием антисмыслового олигонуклеотида у пациентов с СН. CDR132L показал хорошую безопасность и переносимость, улучшение сердечных функций, а также линейную фармакокинетику без признаков накопления. Хотя приведенное исследование было ограничено небольшим числом пациентов, ориентировочная эффективность этого препарата очень обнадеживает, подтверждая ценность дополнительных клинических исследований фармакодинамических эффектов CDR132L у больных ХСН [52].
ЗАКЛЮЧЕНИЕ
В современном мире в научном арсенале имеется большое количество биомаркеров, позволяющих лучше понять патогенез СН, оценить активность систем нейрорегуляции, выраженность повреждения миокарда, расширить знания об аспектах течения воспалительных процессов и формирования фиброзной ткани в сердце, особенностях поражения других органов и систем человеческого организма [53–55]. В нашем обзоре мы представили данные экспериментальных и клинических исследований, указывающих на очевидную связь между экспрессией miRNA и СН. Необходимо дальнейшее, более глубокое изучение функций miRNA, в том числе с помощью клинических исследований, для определения диагностической, прогностической и, возможно, терапевтической значимости этих маркеров [2, 56, 57].



