ВВЕДЕНИЕ
В развитии заболеваний человека свое значение имеют как генетические особенности организма, так и факторы окружающей среды. Классическим примером наследственной предрасположенности к заболеваниям желудочно-кишечного тракта (ЖКТ) служит семейный аденоматозный полипоз, при котором мутации зародышевой линии на 99% связаны с развитием колоректального рака к 40 годам [1].
Известно, что генетические факторы играют одну из главных ролей и при развитии гастроэзофагеальной рефлюксной болезни (ГЭРБ): так, у гомозиготных близнецов она развивается чаще по сравнению с дизиготными [2]. В настоящее время изучается вклад генетических факторов в развитие слабости тонуса нижнего пищеводного сфинктера, плохое восстановление слизистой оболочки, изменение кислотного или желчного состава рефлюксата или недостаточный клиренс рефлюксата [3].
В современной литературе обсуждается роль повышенной передачи сенсорных сигналов как механизма развития симптомов заболевания [4]. Гетеротримерные гуанин-нуклеотидсвязывающие белки (G-белки) служат для передачи сигналов от обширного набора рецепторов к эффекторным системам, включая ионные каналы и ферменты, которые изменяют скорость производства, высвобождения или деградации внутриклеточных вторичных мессенджеров [5]. Передача сенсорных сигналов находится под влиянием генетических факторов [6]. Одним из таких компонентов может быть полиморфизм гена GNβ3, который кодирует β3-субъединицу G-белка [5]. При ГЭРБ реакция пациента на заброс в пищевод желудочного и/ или дуоденального содержимого является как раз результатом передачи сенсорных сигналов.
Цель исследования – изучить распространенность генетического полиморфизма гена GNBβ3 825С/Т у пациентов с ГЭРБ, проживающих на территории Забайкальского края, в зависимости от клинической картины заболевания и характера рефлюксата.
МАТЕРИАЛ И МЕТОДЫ
В исследовании приняли участие 139 человек. В первую группу вошли 79 пациентов с ГЭРБ (30 мужчин и 49 женщин), медиана возраста составила 43 (33; 57) года. Вторая группа (контроль) состояла из 60 здоровых человек (28 мужчин и 32 женщины), медиана возраста – 44 (37; 54) года. Группы были сопоставимы по полу и возрасту. Все респонденты, принявшие участие в исследовании, охарактеризовали себя как европеоиды, родились и проживают на территории Забайкальского края не менее трех поколений.
Диагноз ГЭРБ устанавливался в первой группе с помощью анкеты GerdQ при наборе 8 и более баллов и/или при обнаружении изменений слизистой оболочки пищевода по данным эндоскопического исследования верхних отделов желудочно-кишечного тракта (ЖКТ) и/или в случае выявления патологических кислых, слабокислых или щелочных рефлюксов при 24-часовой рН-импедансометрии. Дополнительно у пациентов оценивалась частота возникновения симптомов изжоги и регургитации не менее 1 раза в неделю.
Контрольную группу составили лица, не имеющие клинических и инструментальных признаков ГЭРБ, без тяжелой сопутствующей патологии, которые были охарактеризованы как практически здоровые.
Все участники перед исследованием подписали информированное добровольное согласие. В работе соблюдались этические принципы Хельсинской декларации. Проведение исследования было одобрено локальным этическим комитетом при Читинской государственной медицинской академии (протокол № 83 от 22.10.2016).
Генотипирование полиморфного локуса С825Т бета-субъединицы G-белка (GNBβ3) осуществляли методом полимеразной цепной реакции (ПЦР). Материалом для генетического анализа служили образцы ДНК, выделенные из лейкоцитов периферической венозной крови. Визуализация продуктов амплификации выполнялась посредством электрофореза в 3% агарном геле с добавлением бромистого этидия с ультрафиолетовой детекцией. В работе применялись стандартные наборы для исследуемых SNP научно-производственной фирмы «Литех» (Москва).
Накопление и обработку данных выполняли с помощью программы MS Excel. Для статистической обработки использовали программу Statistica 10.0. Применялись методы непараметрической статистики: медиана, 25-й и 75-й процентили, критерий Манна–Уитни, хи-квадрат, точный критерий Фишера, расчет отношения шансов (ОШ) с установлением 95% доверительного интервала (ДИ). Отклонения распределений генотипов изученного полиморфного локуса от распределения Харди–Вайнберга оценивались с применением модифицированного критерия хи-квадрат Пирсона. Различия считали достоверными при р <0,05. В расчетах использовались онлайн-программа Hardy–Weinberg equilibrium calculator.
РЕЗУЛЬТАТЫ
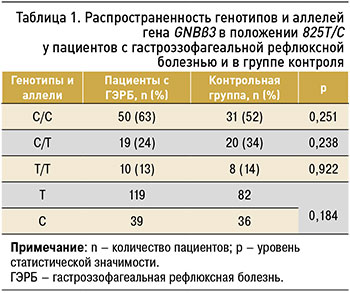
Распределение частот генотипа полиморфного локуса С825Т GNBβ3 в изучаемых группах соответствовало закону Харди–Вайнберга, р >0,05.
Как в первой, так и второй группе выявлено наличие трех генотипов GNBβ3 C825T (С/С, Т/Т, С/Т). Не установлено различий в распространенности генотипов и аллелей между пациентами с ГЭРБ и контролем (табл. 1).
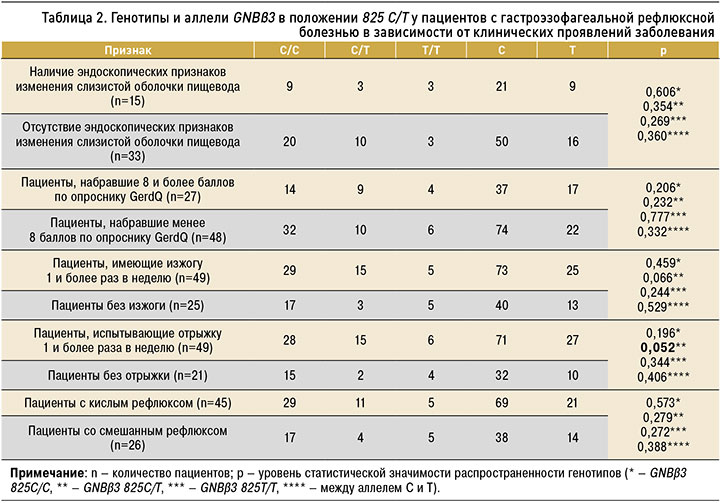
Нами проведена оценка распространенности генотипа GNBβ3 в положении 825Т/С в зависимости от наличия или отсутствия основных симптомов ГЭРБ (изжоги и регургитации не менее 1 раза в неделю), порогового уровня баллов согласно анкете GerdQ (8 и более), наличия или отсутствия поражения слизистой оболочки пищевода и вида патологического рефлюкса.
Установлено, что пациенты, которые испытывают отрыжку один и более раз в неделю, чаще имеют генотип GNBβ3 825С/Т (ОШ=3,235; 95% ДИ: 0,838–12,488), при этом распространенность аллеля Т у этих больных не отличалась. У лиц с изжогой, возникающей не реже 1 раза в неделю, наблюдалась тенденция к наиболее частому распространению данного генотипа. Нами не обнаружено статистически значимых различий в распространенности полиморфных вариантов гена 825 С/Т GNBβ3 у пациентов с ГЭРБ в зависимости от наличия или отсутствия порогового уровня баллов по опроснику GerdQ, повреждения слизистой оболочки пищевода и вида патологического рефлюкса (табл. 2).
ОБСУЖДЕНИЕ
Полиморфизм гена GNBβ3 в положении 825 С/Т дает три возможных генотипа (С/С, С/Т, Т/Т). Аллель 825Т в генотипе Т/Т или С/Т вызывает образование усеченного, но функционально активного варианта сплайсинга. Этот аллель предсказывает повышение активности G-белка и тем самым ускорение клеточных или физиологических реакций. Гомозиготные носители генотипа GNBβ3 825С/С характеризуются замедлением ответа передачи сигнала [3].
Изучение значения полиморфизма гена GNBβ3 825C/T первоначально проводилось у пациентов с функциональной диспепсией. Установлено, что этот генотип и аллель 825Т чаще встречались у больных диспепсией с синдромом эпигастральной боли [6–11]. В единичных работах определен вклад аллеля 825Т гена GNBβ3 в развитие постпрандиального дистресс-синдрома [12]. Место полиморфизма гена GNBβ3 825Т/С у пациентов с синдромом раздраженного кишечника (СРК) проанализировано в метаанализе, который включил 11 исследований «случай–контроль». Авторами установлено, что аллель С играет протективную роль в развитии СРК с запором, генотип GNBβ3 825С/С показал прямую связь с развитием СРК с диареей [13].
Теоретической предпосылкой к оценке роли полиморфизма гена GNВβ3 825 С/Т в развитии ГЭРБ стало предположение, что висцеральная гиперчувствительность участвует в формировании симптомов рефлюкса. Рецепторы, способные связываться с G-белком, опосредуют реакцию на кислоту, нейротрансмиттеры и гуморальные факторы, модулирующие сенсорную функцию пищевода [13]. Таким образом, полиморфизм гена G-белка способен быть фактором, влияющим на появление изжоги и отрыжки у пациентов с ГЭРБ.
В исследовании de Vries D.R. et al. (2009), в котором приняли участие 363 пациента с ГЭРБ и 373 респондента группы контроля, было показано, что генотип С/Т был более распространен у пациентов с ГЭРБ по сравнению с группой контроля, а аллель 825Т ассоциировался с повышенным восприятием рефлюкса [4]. Связь аллеля 825Т с симптомами заболевания была продемонстрирована и в более поздней работе, однако генетическая изменчивость GNBβ3 не зависела от уровня кислотности в пищеводе [14].
В нашем исследовании мы не получили различий в распространенности генотипов GNBβ3 между пациентами основной группы и группой контроля, равно как и не выявили связи между видом рефлюкса и наличием изменений слизистой оболочки. При этом генотип GNBβ3 825 C/Т чаще встречался у пациентов, испытывающих симптомы отрыжки и изжоги не менее 1 раза в неделю.
ЗАКЛЮЧЕНИЕ
При исследовании распространенности генотипов полиморфного локуса 825 C/T GNBβ3 у пациентов с ГЭРБ и здоровых лиц, проживающих на территории Забайкальского края, не получено статистически значимых различий между группами. Генотип CNBβ3 825 С/Т был ассоциирован с ГЭРБ, сопровождающейся клиническими проявлениями не менее 1 раза в неделю.


