Abstract. An elevated level of rheumatoid factor (RF) is often considered to be an evidence of rheumatoid arthritis or other rheumatic disease. At the same time, RF is known to be a non-specific indicator. Current article discusses the significance of an increase of RF specifically in various rheumatic diseases. In addition, the peculiarities of the laboratory diagnostic process, which must be taken into account when interpreting the results, are discussed.
ВВЕДЕНИЕ
Ревматоидный фактор (РФ) – это общий термин, применяемый для описания группы аутоантител, направленных к антигенным детерминантам Fc-фрагмента иммуноглобулина G (IgG) [1].
Аутоантитела, которые в дальнейшем были названы ревматоидным фактором, впервые описаны в 1940 г., когда Э. Ваалер и Х.М. Роуз показали, что присутствие этих антител в исследуемой сыворотке приводит к агглютинации сенсибилизированных бараньих эритроцитов. Диагностический метод получил название реакции Ваалера–Роуза. Термин «ревматоидный фактор» был предложен группой исследователей в 1952 г. на основании установленной взаимосвязи этих аутоантител с ревматоидным артритом (РА) [2].
Первоначально считалось, что РФ представлен иммуноглобулинами класса М (IgM). В настоящее время известно, что это гетерогенная популяция антител, среди которых IgM преобладают, но также присутствуют IgG, IgA, IgD и IgE. Поэтому в современной терминологии рекомендуется уточнять изотип РФ (например, IgM-РФ).
РФ представляет собой антитела к Fc-фрагменту тяжелой цепи IgG. IgG являются преобладающими иммуноглобулинами в сыворотке человека. Причина, вызывающая выработку аутоантител к ним, не ясна, но известно, что при РА существенно повышается количество измененных IgG, к которым и вырабатывается РФ [2–4].
РФ вырабатывается синовиальными В-клетками [1], а также В-лимфоцитами. В норме лимфоидная ткань человека содержит некоторое количество В-лимфоцитов, экспрессирующих РФ на своей поверхности, однако при этом в кровотоке РФ определяется в незначительных концентрациях или не определяется вовсе. Причины, приводящие к активации В-клеток и соответственно повышенной выработке РФ, не ясны. Полагают, что определенную роль в этом играет постоянная антигенная стимуляция, в том числе бактериальными и вирусными антигенами [2].
ЛАБОРАТОРНОЕ ВЫЯВЛЕНИЕ РЕВМАТОИДНОГО ФАКТОРА
Имеется несколько лабораторных методик для выявления РФ, среди которых выделяют полуколичественные и количественные [5].
Первоначально использовались полуколичественные реакции, основанные на свойстве IgM вызывать агглютинацию. Самой первой такой методикой стала упоминавшаяся ранее реакция Ваалера–Роуза, при которой РФ-содержащая сыворотка вызывает агглютинацию эритроцитов барана, сенсибилизированных кроличьими IgG. В дальнейшем в качестве носителя IgG стали применять другие вещества, в том числе бентонит и частицы латекса, в связи с чем методика получила название «латекс-тест» [6]. В русскоязычных источниках под реакцией латекс-агглютинации подразумевается именно эта модификация реакции Ваалера–Роуза. В этой методике выявляемый уровень IgM-РФ определяется как наиболее высокое разведение сыворотки (титр), вызывающее видимую агглютинацию.
К количественным методам выявления РФ относят нефелометрию и турбидиметрию, а также твердофазный иммуноферментный анализ (ELISA). Результат количественных методов выражается в международных единицах (МЕ/мл) [7].
Турбидиметрия и нефелометрия являются оптическими методами. Как и реакция Ваалера–Роуза, они основаны на агглютинации латексных частиц, на которых сорбированы инактивированные IgG. В случае присутствия в исследуемой сыворотке РФ образуются преципитаты. В отличие от реакции Ваалера–Роуза, результат теста оценивается объективно: исследуется прохождение света через коллоидный раствор с преципитатами. Суспензия мелких частиц рассеивает проходящий через нее свет. При нефелометрии аналитическим сигналом служит интенсивность рассеянного света, а при турбидиметрии – прошедшего [8].
Твердофазный иммуноферментный анализ ELISA, в отличие от других количественных методов, позволяет не просто обнаружить РФ, но и идентифицировать его изотипы (IgM/IgG/IgA) [5]. Тест основан на специфическом взаимодействии антитела и антигена с последующим присоединением к полученному комплексу конъюгата (антивидового иммуноглобулина, меченного ферментом). Фермент вызывает разложение хромогенного субстрата с образованием окрашенного продукта, который выявляется либо визуально, либо фотометрически. Регистрацию результатов реакции проводят на специальных фотометрах с вертикальным лучом при определенной длине волны. Результат выражают в единицах оптической плотности [9].
В настоящее время в большинстве лабораторий применяют количественные методы. Полуколичественные методы используются редко, однако полностью пока не вытеснены.
РЕФЕРЕНСНЫЕ ЗНАЧЕНИЯ И ГРАДАЦИИ ПОВЫШЕНИЯ РЕВМАТОИДНОГО ФАКТОРА
Наибольшее значение в клинической практике имеет определение IgM РФ. Нормальный уровень IgM РФ при тестировании сывороток с помощью латекс-агглютинации составляет ≤1:40, при нефелометрии – ≤15 МЕ/мл, при иммуноферментном анализе – ≤20 МЕ/мл. Для определения отдельных изотипов РФ (в том числе IgA) применяют иммуноферментный анализ (ELISA) [5].
Выделяют следующие градации результатов определения уровней IgM РФ [5]:
- отрицательные (меньшие или равные верхней границе нормы – ВГН);
- слабо положительные (≤3 ВГН);
- высоко положительные (>3 ВГН).
Положительные результаты определения IgM РФ полуколичественными методами (латекс-агглютинация), даже в высоких титрах, всегда рассматриваются как слабо положительные.
При использовании общепринятой ВГН (15– 20 МЕ/мл) диагностическая чувствительность составляет 50–90%, диагностическая специфичность – 80–93%. [5] Такая существенная вариативность объясняется особенностями лабораторных методик.
ТРУДНОСТИ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ РЕВМАТОИДНОГО ФАКТОРА
Таким образом, в настоящее время для выявления РФ используются три основных метода – латекс-агглютинация, нефелометрия/турбидиметрия и иммуноферментный анализ (ELISA). При этом известно, что результаты, получаемые разными методами, значительно различаются и в целом несопоставимы [10].
В частности, выявляемость РФ зависит от применяемого метода (от 41% для латекс-теста до 95,2% для турбидиметрии) [11–13]. Кроме того, при высоких концентрациях РФ в зависимости от метода значительно различается не только выявляемость, но и определяемый уровень РФ [12].
Данные о чувствительности и специфичности методов весьма вариабельны. Для латекс-теста соотношение чувствительности и специфичности составляет соответственно 41 и 59% [11], для нефелометрии и турбидиметрии – 60–95,2 и 89,4% [12, 13]. Наибольший разброс показателей отмечен в отношении иммуноферментного анализа (ELISA) – 35,7–64 и 33–98,9% [11, 12], что связывают с использованием разных коммерческих диагностических наборов; более того, даже высказывается мнение о невозможности сопоставления результатов иммуноферментного анализа, выполненного с использованием наборов разных производителей [12, 14]. Разночтения продемонстрированы при сравнении шести коммерческих наборов, использованных для определения уровня РФ в референсной сыворотке (WHO International standard, по стандарту уровень РФ в сыворотке – 25 МЕ/мл) [14]. По данным исследования, для четырех наборов показано хорошее соответствие стандарту, а для двух – существенное отличие от него. Кроме того, в сравниваемых наборах различался уровень отсечения, при котором тест считался положительным (5–20 МЕ/мл); это привело к тому, что референсная сыворотка оценивалась тремя тестами как резко положительная, одним тестом – как пограничная и еще одним – как отрицательная.
Таким образом, показатель РФ зависит от используемого метода, а также от применяемого коммерческого набора, многие из которых не валидизированы [12].
РЕВМАТОИДНЫЙ ФАКТОР ПРИ РЕВМАТОИДНОМ АРТРИТЕ
Ревматоидный артрит (РА) – аутоиммунное ревматическое заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом и системным поражением внутренних органов, приводящее к ранней инвалидности и сокращению продолжительности жизни пациентов. Распространенность РА среди взрослого населения в разных географических зонах варьирует от 0,5 до 2%, в России она составляет 0,61% от общей популяции [15].
РФ и вырабатывающие их B-клетки присутствуют в синовиальной оболочке и кровотоке пациентов с РА, однако патогенетическая роль РФ в развитии этого заболевания не ясна. Согласно одной из гипотез, РФ, будучи антигеном к иммунным комплексам, участвует в активации комплемента, способствуя выработке хемотаксических факторов и привлечению клеток воспаления, согласно другой, он, напротив, является результатом воспалительного процесса, а не его триггером [2, 4, 16, 17].
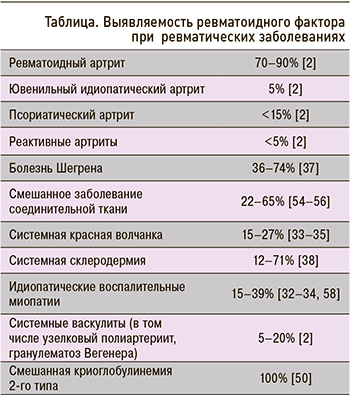
При РА чувствительность РФ достигает 60–80% и возрастает по мере увеличения продолжительности заболевания. В то же время менее 50% пациентов с ранней стадией РА являются РФ-позитивными. Наиболее часто обнаруживается IgM РФ, он же и обладает наибольшей чувствительностью. Специфичность РФ достигает 70–90% и увеличивается пропорционально значению [18].
В соответствии с рекомендациями ACR/ EULAR от 2010 г., выявление повышенных РФ служит одним из диагностических критериев РА. РФ-позитивность поддерживает диагноз РА, но в то же время РФ-негативность не исключает РА, поскольку известно о наличии серонегативных вариантов заболевания. Высокая концентрация РФ рассматривается как предиктор быстро прогрессирующего деструктивного поражения суставов и системных проявлений при РА (таких как ревматоидные узелки и васкулит) [4, 5, 19]. Деструктивный РА обычно отмечается на фоне высоких концентраций РФ (>40 МЕ/мл) или превышающих ВГН в 3 раза [20]. Клинический ответ на лечение сопровождается снижением титров РФ [4, 17]. Уровень РФ может снижаться на фоне лечения некоторыми препаратами: такая картина описана для инфликсимаба [21–23], этанерцепта [24], адалимумаба [25], ритуксимаба [25, 26], абатацепта, тоцилизумаба [28, 29].
Вместе с тем уровень РФ не всегда отражает активность заболевания, поэтому не рекомендуется использовать его для оценки эффективности лечения [19].
У пациентов c РА выявляются различные изотипы РФ: не только IgM, но и IgG и IgA. Также возможно обнаружение IgD и IgE. Характерной является комбинация повышенных IgM и IgA. Высокие титры IgA РФ ассоциированы не только с активностью заболевания, но и с менее выраженным ответом на лечение [4]; в частности, это отмечается на фоне терапии ингибиторами фактора некроза опухоли альфа (анти-ФНО препаратами) [19].
Повышение РФ может на много лет предшествовать клиническому развитию РА [4]. Выявлено последовательное увеличение РФ различных изотипов на доклинической стадии: первым было отмечено возрастание IgM-РФ (примерно за 4 года до начала заболевания), затем IgA-РФ (за 3 года) и после IgG-РФ (примерно за год до дебюта РА) [30, 31].
ПОВЫШЕНИЕ РЕВМАТОИДНОГО ФАКТОРА ПРИ ДРУГИХ РЕВМАТОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЯХ
Системная красная волчанка
Системная красная волчанка (СКВ) – системное аутоиммунное заболевание неизвестной этиологии, характеризующееся гиперпродукцией органоспецифических аутоантител к различным компонентам клеточного ядра с развитием иммуновоспалительного повреждения тканей и внутренних органов. Заболеваемость СКВ колеблется от 4 до 250 случаев на 100 000 населения [32].
РФ выявляется у 15–27% пациентов с СКВ [33–35] и ассоциирован с рядом клинических и лабораторных особенностей, в частности, с сухим синдромом, анемией [35], и не связан с нефритом [34]. При СКВ выявляются различные изотипы РФ: IgM, IgG и IgA выявлены у 17,9, 20,5 и 20,5% пациентов соответственно, при этом комбинации различных изотипов встречается у 19%. Наличие IgA РФ характерно для пациентов с высокой активностью заболевания и отсутствием нефрита [35].
Болезнь Шегрена
Болезнь Шегрена – системное заболевание неизвестной этиологии, характерной чертой которого является хронический аутоиммунный и лимфопролиферативный процесс в секретирующих эпителиальных железах с развитием паренхиматозного сиалоаденита с ксеростомией и сухого кератоконъюнктивита с гиполакримией. Распространенность его составляет 0,1–0,4% [36].
У пациентов с болезнью Шегрена РФ выявляется в 36–74% случаев, при этом частота РФ-позитивности увеличивается вместе с давностью заболевания [37].
У РФ-позитивных пациентов отмечается, помимо прочего, более высокая встречаемость артралгий [38], кожного васкулита, увеличения слюнных желез, цитопении, феномена Рейно, а также поражения почек и центральной нервной системы [39, 40]. Кроме того, повышенный титр РФ служит независимым фактором риска развития неходжкинской лимфомы [41].
Помимо IgM, при болезни Шегрена обнаруживается и IgA (26%) [42], который ассоциирован с поражением почек и легких [42, 43].
Болезнь Шегрена сопровождается наиболее высоким уровнем повышения РФ [44]. Кроме того, существует предположение, что исчезновение РФ у пациента с этим заболеванием может указывать на развитие лимфомы [18].
Системная склеродермия
Системная склеродермия (CCД) – полиорганное заболевание, в основе которого лежат иммунные нарушения и вазоспастические сосудистые реакции по типу синдрома Рейно, сопровождающиеся активацией фиброзообразования и избыточным отложением компонентов внеклеточного матрикса (коллагена) в тканях и органах. Распространенность ССД составляет 30–300 случаев на 1 млн [45]. РФ выявляется у 12–71% пациентов с этим заболеванием [38], ассоциирован с синдромом Шегрена [46], артралгиями и артритом [38].
Идиопатические воспалительные миопатии
Идиопатические воспалительные миопатии (ИВМ) – группа хронических заболеваний неизвестной этиологии, основным проявлением которых выступает симметричная мышечная слабость проксимальных отделов конечностей, связанная с воспалением поперечнополосатой мускулатуры. Согласно эпидемиологическим исследованиям, показатели заболеваемости варьируют от 2,18 до 7,7 случаев в год на 1 млн населения [47]. Данные о частоте и клинической значимости РФ при ИВМ разнятся. В исследовании Ide V. et al. частота повышенного РФ у пациентов с различными формами ИВМ составила 9%, и авторы высказали предположение, что этот показатель не имеет клинического значения [48]. По другим данным, увеличение РФ выявлено у 20% пациентов с дерматополимиозитом, наиболее часто у лиц с перекрестными синдромами [49, 50]. У пациентов с антисинтетазным синдромом, сопровождающимся артритом, РФ-позитивность отмечается в 15–39% [51, 52].
Смешанное заболевание соединительной ткани
Смешанное заболевание соединительной ткани (СЗСТ) – редкая системная патология, характеризующаяся сочетанием отдельных признаков СКВ, ССД, РА, полимиозита, с наличием антител к растворимому ядерному рибонуклеопротеину (анти-u1-РНП) в высоких титрах [53]. Частота СЗСТ достигает 1,9–3,8 на 100 тыс. населения [53].
Повышение уровня РФ отмечается у 22–65% пациентов с СЗСТ [54–56]. При этом обнаруживаются различные его изотипы: IgM-, IgG- и IgA-РФ у 48, 38 и 33% пациентов соответственно. Практически значимых клинико-лабораторных ассоциаций в настоящее время не описано [57].
Сведения о выявляемости РФ при различных ревматических заболеваниях представлены в таблице.
ЗАКЛЮЧЕНИЕ
Таким образом, РФ – это антитела к тяжелой цепи Fc-фрагмента IgG. РФ представлен иммуноглобулинам различных классов, при этом наиболее часто выявляются IgM, A и G. Повышение уровня РФ характерно для РА, однако не является специфическим показателем; оно может наблюдаться и при других заболеваниях, как ревматологических, так и неревматологических, которые будут обсуждаться в следующей части публикации. Более того, возрастание уровня РФ возможно у здоровых лиц, особенно в старшей возрастной группе, что будет также рассмотрено далее. По причине такой неспецифичности повышения РФ исследование этого маркера не рекомендовано в качестве скринингового теста [18]. Показанием к консультации ревматолога служит только высокий уровень РФ, особенно в сочетании с болями в суставах [33]. Лабораторная диагностика данного фактора целесообразна при наличии клинической картины, характерной для ревматического заболевания.
1. Хоббс К. Лабораторные исследования. В книге: Акутота В., Арройо Р.А., Баттафарано Д.Ф. с соавт. Секреты ревматологии. Под ред. О.М. Лесняк. М.: ГЭОТАР-Медиа. 2018; с. 64–73. [Hobbs K. Laboratory evaluation. In book: Acutota V., Arroyo R.A., Battafarano D.F. et al. Rheumatology secrets. Ed. by Lesnyak O.M. Moscow: GEOTAR-Media. 2018; pp. 64–73 (In Russ.)]. ISBN: 978-5-9704-4508-2.
2. Gualtierotti R., Ciavarella T., Meroni P.L. Rheumatoid factors. In book: Autoantibodies. 3rd edition. Ed. by Shoenfeld Y., Meroni P.L., Gershwin V.E. Amsterdam: Elsevier B.V. 2014; 751–60. ISBN: 978-0-444-56378-1. https://dx.doi.org/10.1016/C2010-0-68545-2.
3. Ryu H.J., Takeuchi F., Kuwata S. et al. The diagnostic utilities of anti-agalactosyl IgG antibodies, anti-cyclic citrullinated peptide antibodies, and rheumatoid factors in rheumatoid arthritis. Rheumatol Int. 2011; 3(31): 315–19. https://dx.doi.org/10.1007/s00296-009-1260-5.
4. de Angelis V., Meroni P.L. Rheumatoid factors. In book: Autoantibodies. 1st edition. Ed. by Peters J.B., Schoenfeld Y. Amsterdam: Elsevier Inc. 2007; pp. 755–62. ISBN: 978-0-444-52763-9.
5. Александрова Е.Н., Новиков А.А., Насонов Е.Л. Рекомендации по лабораторной диагностике ревматических заболеваний Общероссийской общественной организации «Ассоциация ревматологов России» – 2015. Современная ревматология. 2015; 4: 25–36. [Aleksandrova E.N., Novikov A.A., Nasonov E.L. The 2015 guidelines for the laboratory diagnosis of rheumatic diseases by the All-Russian public organization «Association of rheumatology of Russia». Sovremennaya revmatologiya = Modern Rheumatology Journal. 2015; 4: 25–36 (In Russ.)]. https://dx.doi.org/10.14412/1996-7012-2015-4-25-36.
6. Jones J.G. Biochemistry of articular disorders. In book: Marshall W., Lapsley M., Day A., Ayling R. Clinical biochemistry: Metabolic and clinical aspects. 3rd edition. London: Churchill Livingstone. 2014; pp. 636–45. ISBN: 978-0-702-05140-1.
7. Кишкун А.А. Клиническая лабораторная диагностика. М.: ГЭОТАР-Мелиа. 2010; с. 721–723. [Kishkun A.A. Clinical laboratory diagnostics. Moscow: GEOTAR-Media. 2010; pp. 721–723 (In Russ.)]. ISBN: 978-5-9704-1550-4.
8. Фридрихсберг Д.А. Курс коллоидной химии. Спб.: Химия. Ленинградское отделение. 1995; с. 41. [Friedrichsberg D.A. Colloid chemistry course. Saint Petersburg: Khimiya. Leningradskoye otdeleniye = Chemistry. Leningrad branch. 1995; p. 41 (In Russ.)]. ISBN: 5-7245-1022-7.
9. Жаворонок С.В., Тапальский Д.В. Иммуноферментный анализ. Учебное пособие. Гомель: Гомельский государственный медицинский университет. 2004; с. 6. [Zhavoronok S.V., Tapalsky D.V. Linked immunosorbent assay. Tutorial. Gomel: Gomel State Medical University. 2004; p. 6 (In Russ.)].
10. Ameratunga R., Musaad S., Sugrue C., Kyle C. Rheumatoid factor measurement-continuing problems 70 years after discovery. Clin Rheumatol. 2011; 9(30): 1215–20. https://dx.doi.org/10.1007/s10067-011-1716-3.
11. Devi C., Ravichandran R., Selvaraj L. et al. Comparative study of rheumatoid factor – IgM autoantibody testing by latex agglutination nephelometry and ELISA in patients with rheumatoid arthritis. Eur J Mol Clin Med. 2020. 8(7): 4521–27.
12. Rocha K.C., Da Fonseca Brinque L.A., Oliveira C.G.B. et al. Comparative study between immunoturbidimetric and latex agglutination methods for the detection of rheumatoid factor. J Bras Patol Med Lab. 2013; 1(49): 12–16. https://dx.doi.org/10.1590/S1676-24442013000100002.
13. Bas S., Perneger T.V., Kunzle E., Vischer T.L. Comparative study of different enzyme immunoassays for measurement of IgM and IgA rheumatoid factors. Ann Rheum Dis. 2002; 6(61): 505–10. https://dx.doi.org/10.1136/ard.61.6.505.
14. Van Hoovels L., Jacobs J., Vander Cruyssen B. et al. Performance characteristics of rheumatoid factor and anti-cyclic citrullinated peptide antibody assays may impact ACR/EULAR classification of rheumatoid arthritis. Ann Rheum Dis. 2018; 5(77): 667–77. https://dx.doi.org/10.1136/annrheumdis-2017-212365.
15. Клинические рекомендации. Ревматоидный артрит. Ассоциация ревматологов России. 2018. Рубрикатор Минздрава России. Доступ: https://cr.minzdrav.gov.ru/schema/250_1 (дата обращения – 16.08.2021). [Clinical guidelines. Rheumatoid arthritis. Association of Rheumatologists of Russia. 2018. Rubricator of the Ministry of Healthcare of Russia. URL: https://cr.minzdrav.gov.ru/schema/250_1 (date of access – 16.08.2021) (In Russ.)].
16. Shmerling R.H. Rheumatoid factor: Biology and utility of measurement. 2021. URL: https://www.uptodate.com/contents/rheumatoid-factor-biology-and-utility-of-measurement (date of access – 11.02.2022).
17. Westwood O.M.R., Nelson P.N., Hay F.C. Rheumatoid factors: What’s new? Rheumatology (Oxford). 2006; 45(4): 379–85. https://dx.doi.org/10.1093/rheumatology/kei228.
18. Salzman B.E., Nevin J.E., Newman J.H. A primary care approach to the use and interpretation of common rheumatologic tests. Clin Fam Pract. 2005; 2(7): 335–58. https://dx.doi.org/10.1016/J.CFP.2005.02.009.
19. Taylor P., Gartemann J., Hsieh J., Creeden J. A systematic review of serum biomarkers anti-cyclic citrullinated peptide and rheumatoid factor as tests for rheumatoid arthritis. Autoimmune Dis. 2011; 1(1): 1–18. https://dx.doi.org/10.4061/2011/815038.
20. Лапин С.В., Мазинг А.В., Булгакова Т.В. с соавт. Клинические рекомендации по лабораторной диагностике аутоиммунных заболеваний. 2014. Доступ: https://medqualitypeople.ru/f/klinicheskie_rekomendacii_po_laboratornoj_diagnostike_autoimmunnyh_zabolevanij_0.pdf (дата обращения – 16.07.2021). [Lapin S.V., Mazing A.V., Bulgakova T.V. et al. Clinical guidelines for laboratory diagnosis of autoimmune diseases. 2014. URL: https://medqualitypeople.ru/f/klinicheskie_rekomendacii_po_laboratornoj_diagnostike_autoimmunnyh_zabolevanij_0.pdf (date of access – 16.07.2021) (In Russ.)].
21. Bobbio-Pallavicini F., Alpini C., Caporali R. et al. Autoantibody profile in rheumatoid arthritis during long-term infliximab treatment. Arthritis Res Ther. 2004; 6(3): R264–72. https://dx.doi.org/10.1186/ar1173.
22. De Rycke L., Verhelst X., Kruithof E. et al. Rheumatoid factor, but not anti-cyclic citrullinated peptide antibodies, is modulated by infliximab treatment in rheumatoid arthritis. Ann Rheum Dis. 2005; 2(64): 299–302. https://dx.doi.org/10.1136/ard.2004.023523.
23. Caramaschi P., Biasi D., Tonolli E. et al. Antibodies against cyclic citrullinated peptides in patients affected by rheumatoid arthritis before and after infliximab treatment. Rheumatol Int. 2005; 1(26): 58–62. https://dx.doi.org/10.1007/s00296-004-0571-9.
24. Chen H.A., Lin K.C., Chen C.H. et al. The effect of etanercept on anti-cyclic citrullinated peptide antibodies and rheumatoid factor in patients with rheumatoid arthritis. Ann Rheum Dis. 2006; 1(65): 35–39. https://dx.doi.org/10.1136/ard.2005.038851.
25. Atzeni F., Sarzi-Puttini P., Dell’ Acqua D. et al. Adalimumab clinical efficacy is associated with rheumatoid factor and anti-cyclic citrullinated peptide antibody titer reduction: A one-year prospective study. Arthritis Res Ther. 2005; 1(8): R3 https://dx.doi.org/10.1186/ar1851.
26. Cambridge G., Leandro M.J., Edwards J.C.W. et al. Serologic changes following B lymphocyte depletion therapy for rheumatoid arthritis. Arthritis Rheum. 2003; 48(8): 2146–54. https://dx.doi.org/10.1002/art.11181.
27. Cohen S.B., Emery P., Greenwald M.W. et al. Rituximab for rheumatoid arthritis refractory to anti-tumor necrosis factor therapy: Results of a multicenter, randomized, double-blind, placebo-controlled, phase III trial evaluating primary efficacy and safety at twenty-four weeks. Arthritis Rheum. 2006; 9(54): 2793–806. https://dx.doi.org/10.1002/art.22025.
28. Maneiro R.J., Salgado E., Carmona L., Gomez-Reino J.J. Rheumatoid factor as predictor of response to abatacept, rituximab and tocilizumab in rheumatoid arthritis: Systematic review and meta-analysis. Semin Arthritis Rheum. 2013; 1(43): 9–17. https://dx.doi.org/10.1016/j.semarthrit.2012.11.007.
29. Faillace C., De Carvalho J.F. Rheumatoid factor appearance after tocilizumab treatment seems to predict bad therapeutical response in rheumatoid arthritis. Rheumatol Int. 2013; 7(33): 1909–10. https://dx.doi.org/10.1007/s00296-012-2409-1.
30. Deane K.D., O’Donnell C.I., Hueber W. et al. The number of elevated cytokines and chemokines in preclinical seropositive rheumatoid arthritis predicts time to diagnosis in an age-dependent manner. Arthritis Rheum. 2010; 11(62): 3161–72. https://dx.doi.org/10.1002/art.27638.
31. Deane K.D., Norris J.M., Holers V.M. Preclinical rheumatoid arthritis: Identification, evaluation, and future directions for investigation. Rheum Dis Clin North Am. 2010; 2(36): 213–41. https://dx.doi.org/10.1016/j.rdc.2010.02.001.
32. Федеральные клинические рекомендации по диагностике и лечению системной красной волчанки. Ассоциация ревматологов России. 2016. Доступ: https://rheumatolog.su/media/media/2018/07/18/clinrec_skv.pdf (дата обращения – 11.02.2022). [Federal clinical guidelines for the diagnosis and treatment of systemic lupus erythematosus. Association of Rheumatologists of Russia. 2016. URL: https://rheumatolog.su/media/media/2018/07/18/clinrec_skv.pdf (date of access – 11.02.2022) (In Russ.)].
33. Popescu C., Zofota S., Bojinca V., Ionescu R. The significance of rheumatoid factor and anti-cyclic citrullinated peptide antibodies in systemic lupus erythematosus. Rom J Intern Med. 2013; 51(3–4): 179–87.
34. Fedrigo A., dos Santos T.A.F.G., Nisihara R., Skare T. The lupus patient with positive rheumatoid factor. Lupus. 2018; 27(8): 1368–73. https://dx.doi.org/10.1177/0961203318759607.
35. Witte T., Hartung K., Sachse C. et al. Rheumatoid factors in systemic lupus erythematosus: Association with clinical and laboratory parameters. Rheumatol Int. 2000; 3(19): 107–11. https://dx.doi.org/10.1007/s002960050112.
36. Федеральные клинические рекомендации по диагностике и лечению болезни Шегрена. Ассоциация ревматологов России. 2016. Доступ: https://rheumatolog.su/media/media/2018/07/18/clinrec_b_shyogrena.pdf (дата обращения – 11.02.2022). [Federal clinical guidelines for the diagnosis and treatment of Sjogren’s disease. Association of Rheumatologists of Russia. 2016. URL: https://rheumatolog.su/media/media/2018/07/18/clinrec_b_shyogrena.pdf (date of access – 11.02.2022) (In Russ.)].
37. Bournia V.K., Vlachoyiannopoulos P.G. Subgroups of Sjogren syndrome patients according to serological profiles J Autoimmun. 2012; 39(1–2): 15–26. https://dx.doi.org/10.1016/j.jaut.2012.03.001.
38. Wielosz E., Majdan M., Dryglewska M., Zwolak R. Anti-CCP antibodies and rheumatoid factor in systemic sclerosis: Prevalence and relationships with joint manifestations. Adv Clin Exp Med. 2018; 27(9): 1253–57. https://dx.doi.org/10.17219/acem/69921.
39. Ramos-Casals M., Solans R., Rosas J. et al. Primary Sjogren syndrome in Spain: Clinical and immunologic expression in 1010 patients. Medicine (Baltimore). 2008; 87(4): 210–19. https://dx.doi.org/10.1097/MD.0b013e318181e6af.
40. Martel C., Gondran G., Launay D. et al. Active immunological profile is associated with systemic Sjogren’s syndrome. J Clin Immunol. 2011; 31(5): 840–47. https://dx.doi.org/10.1007/s10875-011-9553-3.
41. Fragkioudaki S., Mavragani C.P., Moutsopoulos H.M. Predicting the risk for lymphoma development in Sjogren syndrome. Medicine (Baltimore). 2016; 95(25): e3766. https://dx.doi.org/10.1097/MD.0000000000003766.
42. Peen E., Mellbye O.J., Haga H. IgA rheumatoid factor in primary Sjogren’s syndrome. Scand J Rheumatol. 2009; 38(1): 46–49. https://dx.doi.org/10.1080/03009740802366043.
43. Kitagawa T., Shibasaki K., Toya S. Clinical significance and diagnostic usefulness of anti-centromere antibody in Sjogren’s syndrome. Clin Rheumatol. 2012; 31(1): 105–12. https://dx.doi.org/10.1007/s10067-011-1789-z.
44. Diaz-Lopez C., Geli C., Corominas H. et al. Are there clinical or serological differences between male and female patients with primary Sjogren’s syndrome? J Rheumatol. 2004; 31(7): 1352–55.
45. Диагностика и лечение прогрессирующего системного склероза (системной склеродермии). М34.0. Ассоциация ревматологов России. 2016. Доступ: https://rheumatolog.su/media/media/2019/02/22/ssd_klin_rekomendatsii.pdf (дата обращения – 11.02.2022). [Diagnostics and treatment of progressive systemic sclerosis (systemic scleroderma). М34.0. Association of Rheumatologists of Russia. 2016. URL: https://rheumatolog.su/media/media/2019/02/22/ssd_klin_rekomendatsii.pdf (date of access – 11.02.2022) (In Russ.)].
46. Avouac J., Clements P.J., Khanna D. et al. Articular involvement in systemic sclerosis. Rheumatology (Oxford). 2012; 51(8): 1347–56. https://dx.doi.org/10.1093/rheumatology/kes041.
47. Федеральные клинические рекомендации по диагностике и лечению идиопатических воспалительных миопатий. Ассоциация ревматологов России. 2016. Доступ: https://rheumatolog.su/media/media/2018/07/18/clinrec_id_vosp_mio.pdf (дата обращения – 11.02.2022). [Federal clinical guidelines for the diagnosis and treatment of idiopathic inflammatory myopathies. Association of Rheumatologists of Russia. 2016. URL: https://rheumatolog.su/media/media/2018/07/18/clinrec_id_vosp_mio.pdf (date of access – 11.02.2022) (In Russ.)].
48. Ide V., Bossuyt X., Blockmans D., De Langhe E. Prevalence and clinical correlates of rheumatoid factor and anticitrullinated protein antibodies in patients with idiopathic inflammatory myopathy. RMD Open. 2018; 4(2): e000661. https://dx.doi.org/10.1136/rmdopen-2018-000661.
49. Koler R.A., Montemarano A. Dermatomyositis. Am Fam Physician. 2001; 64(9): 1565–72.
50. Shmerling R.H., Delbanco T.L. The rheumatoid factor: An analysis of clinical utility. Am J Med. 1991; 91(5): 528–34. https://dx.doi.org/10.1016/0002-9343(91)90190-9.
51. Cavagna L., Nuno L., Scire C.A. et al. Serum Jo-1 autoantibody and isolated arthritis in the antisynthetase syndrome: Review of the literature and report of the experience of AENEAS Collaborative Group. Clin Rev Allergy Immunol. 2017; 52(1): 71–80. https://dx.doi.org/10.1007/s12016-016-8528-9.
52. Chen L., Somers A., Liu J. Antisynthetase syndrome and pleural effusion: A case report. Chest. 2020; 158(4): 1991–92. https://dx.doi.org/10.1016/j.chest.2020.08.1725.
53. Шаяхметова Р.У., Ананьева Л.П. Смешанное заболевание соединительной ткани. Современная ревматология. 2019; 1: 11–18. [Shayakhmetova R.U., Ananyeva L.P. Mixed connective tissue disease. Sovremennaya revmatologiya = Modern Rheumatology Journal2019; 1: 11–18 (In Russ.)]. https://dx.doi.org/10.14412/1996-7012-2019-1-11-18.
54. Ungprasert P., Crowson C.S., Chowdhary V.R. et al. Epidemiology of mixed connective tissue disease, 1985–2014: A population-based study. Arthritis Care Res (Hoboken). 2016; 68(12): 1843–48. https://dx.doi.org/10.1002/acr.22872.
55. John K.J., Sadiq M., George T. et al. Clinical and immunological profile of mixed connective tissue disease and a comparison of four diagnostic criteria. Int J Rheumatol. 2020; 2020: 9692030. https://dx.doi.org/10.1155/2020/9692030.
56. Garcia-De La Torre I., Salazar-Paramo M., Salmon-De La Torre G. Mixed connective tissue disease. A clinico-serological study of 17 cases. Mol Biol Rep. 1996; 23(3–4): 153–57. https://dx.doi.org/10.1007/BF00351163.
57. Mimura Y., Ihn H., Jinnin M. et al. Rheumatoid factor isotypes in mixed connective tissue disease. Clin Rheumatol. 2006; 25(4): 572–74. https://dx.doi.org/10.1007/s10067-005-0185-y.
58. Colaris M.J.L., de Boer M., van der Hulst R.R., Cohen Tervaert J.W. Two hundreds cases of ASIA syndrome following silicone implants: a comparative study of 30 years and a review of current literature. Immunol Res. 2017; 65(1): 120–28. https://dx.doi.org/10.1007/s12026-016-8821-y.



