ВВЕДЕНИЕ
Поиск взаимосвязей между гиперурикемии (ГУ) и коморбидной патологией ведется уже давно, и не только в общей популяции, но и у пациентов с иммуновоспалительными заболеваниями, в частности с ревматоидным артритом (РА). Еще в 1971 г. в одном из исследований у 100 пациентов с РА была установлена более высокая частота ГУ, чем у пациентов группы контроля, сопоставимых по полу и возрасту (8 и 2% соответственно) [1]. Сывороточный уровень мочевой кислоты (МК) был напрямую взаимосвязан с сывороточным уровнем мочевины, из чего авторы сделали вывод о патогенетической общности ГУ с поражением почек (высказано предположение о вторичном возникновении ГУ относительно дисфункции почек).
Panoulas V.F. et al. проанализировали данные 400 пациентов с РА и показали, что сывороточная концентрация МК была выше у пациентов с артериальной гипертензией (АГ), при этом ее уровень независимо ассоциирован с сердечно-сосудистыми заболеваниями (ССЗ) при РА: так, при уровне МК ≥380 мкмоль/л в сыворотке крови риск ССЗ увеличивается в 6 раз [2].
Daoussis D. et al. определили функцию почек у 350 больных РА и обнаружили, что уровень МК сыворотки крови служит независимым фактором риска (ФР) почечной дисфункции. Помимо концентрации МК в сыворотке крови, со снижением функции почек были ассоциированы возраст, систолическое артериальное давление (САД), уровни общего холестерина (ОХС), триглицеридов (ТГ) и длительность РА [3].
Sari I. et al. изучали распространенность ГУ у 132 здоровых добровольцев. Частота ГУ составила 12,1%. Авторами были определены независимые предикторы ГУ, которыми оказались толщина кожной складки и уровень креатинина [4].
Похожие результаты получили авторы других работ, где были показаны взаимосвязи между уровнем МК и факторами сердечно-сосудистого риска, в том числе у пациентов с аутоиммунными заболеваниями, включая РА [5–10].
По данным исследования Chavan V.U. et al., кроме достоверно более высокого уровня МК, у 50 пациентов с РА наблюдались меньшие уровни магния и кальция и чаще выявлялся атерогенный липидный профиль по сравнению с 50 здоровыми добровольцами.
Таким образом, в настоящий момент накоплено достаточно данных, показывающих возможность влияния РА и ГУ на сердечно-сосудистые риски и коморбидную патологию в целом. В то же время сведения о совокупном влиянии РА и ГУ на встречаемость коморбидной патологии ограниченны или представлены анализом малых групп. Изучение указанной проблемы представляется особенно актуальным с учетом патогенетических предпосылок, указывающих на то, что РА и ГУ могут взаимно потенцировать увеличение выраженности некоторых патологических состояний, таких как дисфункция эндотелия и др.
Целью нашего исследования стало изучение взаимосвязи между наличием ГУ и частотой и структурой коморбидной патологии у пациентов с РА.
МАТЕРИАЛ И МЕТОДЫ
Выполнен анализ данных 262 пациентов с РА и ГУ и 262 больных РА с нормальным уровнем МК (группа сравнения), включенных в городской регистр ГУ г. Санкт-Петербурга с января 2000 г. по апрель 2020 г. В регистр вошли сведения о демографических особенностях (пол, возраст), диагнозе, наличии и длительности ГУ, наличии и терапии коморбидной патологии. Под ГУ понимали зафиксированное ≥1 раз повышение МК сыворотки крови >360 мкмоль/л.
Критерии включения в исследование: наличие информированного согласия пациента на включение в регистр; диагноз «ревматоидный артрит», верифицированный в соответствии с критериями EULAR/ACR 2010 г.; возраст более 18 лет на момент включения в исследование.
Критериями исключения из исследования служили отсутствие у пациента свободы волеизъявления; наличие онкологического и/или лимфопролиферативного заболевания (текущего или перенесенного) и других опухолевых процессов; вторичная ГУ (например, ГУ на фоне синдрома распада опухоли и др.); хроническая болезнь 5 стадии (в том числе на заместительной почечной терапии); хронические инфекционные заболевания (туберкулез любой локализации, вирусные гепатиты В и С, ВИЧ-инфекция); другие аутоиммунные заболевания (системная красная волчанка, спондилоартриты и др.).
Включение данных пациентов в регистр проводилось в обезличенном виде, не позволяющем идентифицировать отдельного пациента как личность, каждому из них присваивался индивидуальный номер. Исследование было одобрено локальными комитетами по этике ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России и СПб ГБУЗ «Клиническая ревматологическая больница № 25» (г. Санкт-Петербург).
Статистический анализ проводился с помощью пакета программного обеспечения STATISTICA 8.0 (StatSoftInc, США). Характер распределения данных оценивался графическим методом и с использованием критерия Шапиро–Уилка. В случае нормального распределения признака его описывали в виде среднее ± стандартное отклонение (M±SD). При распределении данных, отличном от нормального, применялся критерий χ2. Различия и взаимосвязи считали статистически значимыми при p <0,05.
РЕЗУЛЬТАТЫ
В зависимости от уровня повышения сывороточной МК пациенты РА с ГУ были разделены на 2 подгруппы. В первую подгруппу были включены 152 пациента с уровнями МК более 360 и менее 500 (M±SD 435,8±34,6) мкмоль/л, во вторую – 110 человек, у которых этот показатель превышал 500 (M±SD 590,2±92,2) мкмоль/л. В группе сравнения (РА без гиперурикемии) средняя концентрация МК составила 249,7±62,7 мкмоль/л.
Демографические особенности и частота коморбидной патологии в обеих группах представлены в таблице 1.
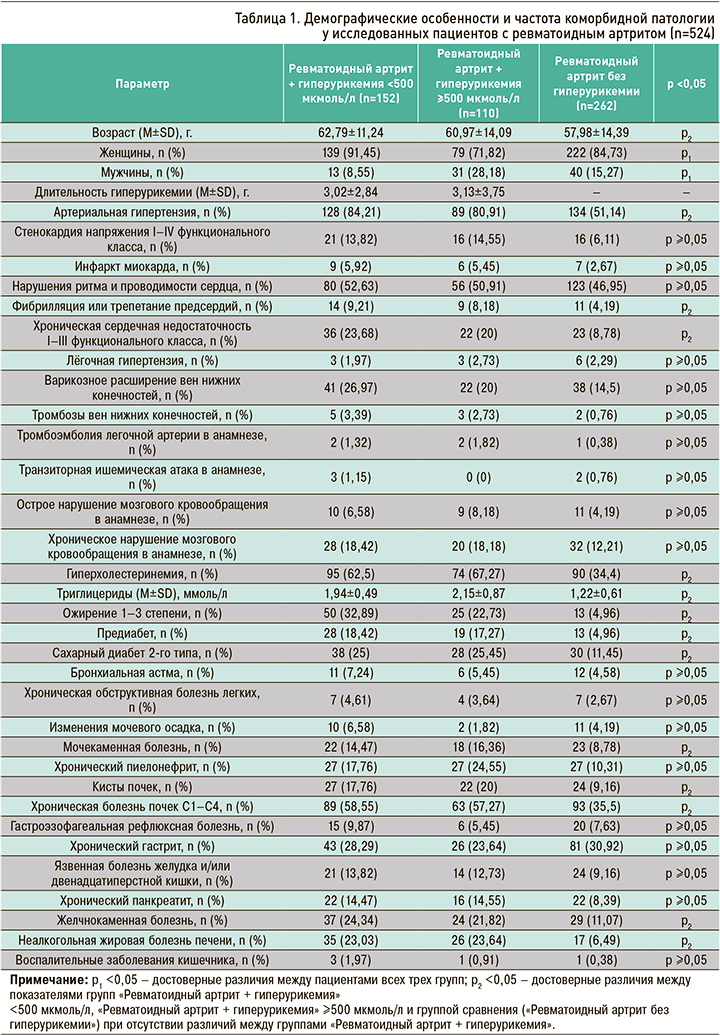
Пациенты РА с разным уровнем ГУ отличались не только встречаемостью коморбидной патологии, но и имели различия в ее лечении. Соответствующие данные приведены в таблице 2.
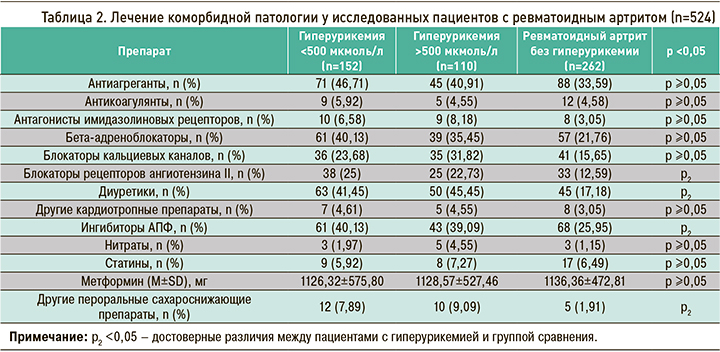
Таким образом, данные таблиц 1 и 2 свидетельствуют о том, что наличие ГУ, вне зависимости от ее выраженности, ассоциируется с увеличением числа коморбидных патологий, в первую очередь со стороны сердечно-сосудистой системы и почек. Метаболические отклонения в виде нарушения толерантности к глюкозе разной степени выраженности, повышения индекса массы тела, дислипидемии также ассоциировались с наличием ГУ у пациентов с РА.
ОБСУЖДЕНИЕ
Данные, полученные нами в ходе анализа медицинской документации пациентов с РА и ГУ, согласуются с рядом исследований, опубликованных ранее. Так, Daoussis D. et al. изучили функцию почек у 400 больных РА: у 67,75% из них скорость клубочковой фильтрации (СКФ) была менее 90 мл/мин/1,73 м2, у 12,75% – менее 60 мл/ мин/1,73 м2. Величина этого показателя была взаимосвязана с пожилым возрастом, женским полом, уровнем холестерина сыворотки крови, сывороточной концентрацией МК и наличием внесуставных заболеваний, за исключением сухого синдрома и ревматоидных узелков. Интересно отметить, что почечная дисфункция не была взаимосвязана с другими факторами, ассоциирующимися с РА, включая активность и продолжительность заболевания, инвалидность и использование нефротоксичных препаратов в прошлом или настоящем. На основании данных обзора литературы и собственных исследований Daoussis D. et al. пришли к заключению, что сывороточный уровень МК служит независимым предиктором развития АГ, стимулирует и увеличивает инсулинорезистентность у пациентов с РА [12, 13].
В другой работе Kuo D. et al. проанализировали данные 813 пациентов с РА и такого же числа лиц без РА. ГУ считали повышение МК >365 мкмоль/л у женщин и >480 мкмоль/л у мужчин. Так же, как и в нашем исследовании, в основной и в группе сравнения преобладали женщины (68%). У пациентов с РА ГУ выступала предиктором тромботических событий в периферических артериях, более того, в обеих группах она была предиктором смертности от всех причин [14].
Meek I.L. et al. провели сравнительный анализ 480 пациентов с РА, 172 с подагрическим артритом (ПА) и 206 с остеоартритом (ОА) на предмет наличия взаимосвязей ГУ с традиционными ФР (прежде всего ССЗ). В группах РА и ОА выявлена ассоциация ГУ с уровнем артериального давления, отношением триглицеридов к липопротеидам высокой плотности, значениями гликированного гемоглобина и индекса массы тела. Авторами установлено, что уровень МК ≥340 мкмоль/л и натрийуретический пептид (NT proBNP) являются независимыми предикторами первых сердечно-сосудистых событий [15]. Схожие данные при сравнении пациентов с ПА, РА и ОА мы получили и в нашей более ранней работе [16].
Zaragoza-Garsia O. et al. в своем исследовании (350 пациентов с РА) показали ассоциацию ГУ с гипетриглицеридемией и увеличением окружностью талии, которые относятся к признанным маркерам кардиоваскулярного риска [17].
В исследовании Chandrashekara S. et al. изучали липидный профиль у 15 пациентов с РА и 9 пациентов с системной красной волчанкой (СКВ). Группы были сопоставимы по уровню скорости оседания эритроцитов, С-реактивного белка и гомоцистеина, уровень МК был значительно выше в группе СКВ (340 мкмоль/л), чем в группе РА (286 мкмоль/л). Независимо от заболевания концентрация МК положительно коррелировала с уровнем липопротеидов очень низкой плотности и липопротеидов высокой плотности [18]. В нашей работе мы продемонстрировали увеличение дислипидемии в группе пациентов с РА и ГУ по сравнению с пациентами с РА без ГУ на большей выборке и в сопоставлении пациентов одной нозологической формы. Это представляется важным, так как метаболический синдром, по ранее представленным Crowson C.S. et al. данным, встречается при РА чаще, чем в отсутствие этого заболевания. При сравнительном анализе данных 232 пациентов с РА и 1241 пациента без РА частота компонентов метаболического синдрома была достоверно выше у пациентов с РА. Наличие метаболического синдрома было взаимосвязано с сывороточным уровнем МК, припухлостью крупных суставов и показателем опросника для оценки здоровья и индекса инвалидизации [19].
Еще в одном исследовании изучалось поражение органов-мишеней (ПОМ) при АГ у 251 пациента с РА. Других ССЗ и хронической болезни почек (ХБП) в исследуемой группе не было. Распространенность ПОМ составила 23,5%, у 45,8% пациентов с ПОМ отмечалась неконтролируемая АГ, у 32,3% – ранее не диагностированная АГ. Пациенты с ПОМ были старше пациентов без ПОМ, имели более высокие уровни сывороточной МК, САД, пульсового давления и частоты сердечных сокращений, чаще страдали сахарным диабетом 2-го типа.
Как и в приведенных выше исследованиях, в нашей работе пациенты с РА и ГУ достоверно чаще страдали АГ, значимыми нарушениями ритма, такими как фибрилляция или трепетание предсердий, метаболическими нарушениями, ассоциированными с инсулинорезистентностью (предиабетом, сахарным диабетом 2-го типа и ожирением 1–3 степеней), и имели более высокую частоту гиперхолестеринемии, прежде всего за счет достоверно более высокого уровня триглицеридов. Показательно, что в нашем исследовании частота желчнокаменной болезнь и неалкогольная жировая болезнь печени была выше среди пациентов с РА; это, вероятно, не случайно, и позволяет рассматривать указанные состояния как компоненты метаболического синдрома.
Оценивая лечение ССЗ, которое получали наши пациенты, следует отметить, что все виды препаратов чаще назначались пациентам с ГУ (в случае с блокаторами рецепторов ангиотензина, ингибиторами АПФ и пероральными сахароснижающими препаратами – достоверно чаще), что напрямую связано с большей частотой той коморбидной патологии, по поводу которой такая терапия назначалось. В то же время следует подчеркнуть, что терапию для коррекции углеводного и липидного обмена получал достаточно малый процент пациентов. Что касается диуретиков, разница в частоте назначения которых достигла степени достоверности, то в основном пациенты получали относительно безопасные в плане повышения уровня МК препараты – калийсберегающие и тиазидные/тиазидоподобные препараты. Их назначение было оправдано в этой группе пациентов большей частотой АГ, ХБП и хронической сердечной недостаточности.
ЗАКЛЮЧЕНИЕ
ГУ у пациентов с РА ассоциирована с большей частотой ССЗ, метаболических нарушений и ХБП. Наиболее часто у пациентов с РА и ГУ выявляли АГ (84%), гиперхолестеринемию (62%) и ХБП (58%).


