Аннотация. Выявление повышенного уровня ревматоидного фактора (РФ) нередко расценивается как доказательство ревматоидного артрита или другого ревматического заболевания. В то же время известно, что РФ представляет собой неспецифичный показатель. В данной публикации обсуждается значимость повышения РФ именно при различных ревматических заболеваниях. Кроме того, обсуждаются особенности процесса лабораторной диагностики, которые необходимо учитывать при интерпретации результатов.
ВВЕДЕНИЕ
Ревматоидный фактор (РФ) – это общий термин, применяемый для описания группы аутоантител, направленных к антигенным детерминантам Fc-фрагмента иммуноглобулина G (IgG) [1].
Аутоантитела, которые в дальнейшем были названы ревматоидным фактором, впервые описаны в 1940 г., когда Э. Ваалер и Х.М. Роуз показали, что присутствие этих антител в исследуемой сыворотке приводит к агглютинации сенсибилизированных бараньих эритроцитов. Диагностический метод получил название реакции Ваалера–Роуза. Термин «ревматоидный фактор» был предложен группой исследователей в 1952 г. на основании установленной взаимосвязи этих аутоантител с ревматоидным артритом (РА) [2].
Первоначально считалось, что РФ представлен иммуноглобулинами класса М (IgM). В настоящее время известно, что это гетерогенная популяция антител, среди которых IgM преобладают, но также присутствуют IgG, IgA, IgD и IgE. Поэтому в современной терминологии рекомендуется уточнять изотип РФ (например, IgM-РФ).
РФ представляет собой антитела к Fc-фрагменту тяжелой цепи IgG. IgG являются преобладающими иммуноглобулинами в сыворотке человека. Причина, вызывающая выработку аутоантител к ним, не ясна, но известно, что при РА существенно повышается количество измененных IgG, к которым и вырабатывается РФ [2–4].
РФ вырабатывается синовиальными В-клетками [1], а также В-лимфоцитами. В норме лимфоидная ткань человека содержит некоторое количество В-лимфоцитов, экспрессирующих РФ на своей поверхности, однако при этом в кровотоке РФ определяется в незначительных концентрациях или не определяется вовсе. Причины, приводящие к активации В-клеток и соответственно повышенной выработке РФ, не ясны. Полагают, что определенную роль в этом играет постоянная антигенная стимуляция, в том числе бактериальными и вирусными антигенами [2].
ЛАБОРАТОРНОЕ ВЫЯВЛЕНИЕ РЕВМАТОИДНОГО ФАКТОРА
Имеется несколько лабораторных методик для выявления РФ, среди которых выделяют полуколичественные и количественные [5].
Первоначально использовались полуколичественные реакции, основанные на свойстве IgM вызывать агглютинацию. Самой первой такой методикой стала упоминавшаяся ранее реакция Ваалера–Роуза, при которой РФ-содержащая сыворотка вызывает агглютинацию эритроцитов барана, сенсибилизированных кроличьими IgG. В дальнейшем в качестве носителя IgG стали применять другие вещества, в том числе бентонит и частицы латекса, в связи с чем методика получила название «латекс-тест» [6]. В русскоязычных источниках под реакцией латекс-агглютинации подразумевается именно эта модификация реакции Ваалера–Роуза. В этой методике выявляемый уровень IgM-РФ определяется как наиболее высокое разведение сыворотки (титр), вызывающее видимую агглютинацию.
К количественным методам выявления РФ относят нефелометрию и турбидиметрию, а также твердофазный иммуноферментный анализ (ELISA). Результат количественных методов выражается в международных единицах (МЕ/мл) [7].
Турбидиметрия и нефелометрия являются оптическими методами. Как и реакция Ваалера–Роуза, они основаны на агглютинации латексных частиц, на которых сорбированы инактивированные IgG. В случае присутствия в исследуемой сыворотке РФ образуются преципитаты. В отличие от реакции Ваалера–Роуза, результат теста оценивается объективно: исследуется прохождение света через коллоидный раствор с преципитатами. Суспензия мелких частиц рассеивает проходящий через нее свет. При нефелометрии аналитическим сигналом служит интенсивность рассеянного света, а при турбидиметрии – прошедшего [8].
Твердофазный иммуноферментный анализ ELISA, в отличие от других количественных методов, позволяет не просто обнаружить РФ, но и идентифицировать его изотипы (IgM/IgG/IgA) [5]. Тест основан на специфическом взаимодействии антитела и антигена с последующим присоединением к полученному комплексу конъюгата (антивидового иммуноглобулина, меченного ферментом). Фермент вызывает разложение хромогенного субстрата с образованием окрашенного продукта, который выявляется либо визуально, либо фотометрически. Регистрацию результатов реакции проводят на специальных фотометрах с вертикальным лучом при определенной длине волны. Результат выражают в единицах оптической плотности [9].
В настоящее время в большинстве лабораторий применяют количественные методы. Полуколичественные методы используются редко, однако полностью пока не вытеснены.
РЕФЕРЕНСНЫЕ ЗНАЧЕНИЯ И ГРАДАЦИИ ПОВЫШЕНИЯ РЕВМАТОИДНОГО ФАКТОРА
Наибольшее значение в клинической практике имеет определение IgM РФ. Нормальный уровень IgM РФ при тестировании сывороток с помощью латекс-агглютинации составляет ≤1:40, при нефелометрии – ≤15 МЕ/мл, при иммуноферментном анализе – ≤20 МЕ/мл. Для определения отдельных изотипов РФ (в том числе IgA) применяют иммуноферментный анализ (ELISA) [5].
Выделяют следующие градации результатов определения уровней IgM РФ [5]:
- отрицательные (меньшие или равные верхней границе нормы – ВГН);
- слабо положительные (≤3 ВГН);
- высоко положительные (>3 ВГН).
Положительные результаты определения IgM РФ полуколичественными методами (латекс-агглютинация), даже в высоких титрах, всегда рассматриваются как слабо положительные.
При использовании общепринятой ВГН (15– 20 МЕ/мл) диагностическая чувствительность составляет 50–90%, диагностическая специфичность – 80–93%. [5] Такая существенная вариативность объясняется особенностями лабораторных методик.
ТРУДНОСТИ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ РЕВМАТОИДНОГО ФАКТОРА
Таким образом, в настоящее время для выявления РФ используются три основных метода – латекс-агглютинация, нефелометрия/турбидиметрия и иммуноферментный анализ (ELISA). При этом известно, что результаты, получаемые разными методами, значительно различаются и в целом несопоставимы [10].
В частности, выявляемость РФ зависит от применяемого метода (от 41% для латекс-теста до 95,2% для турбидиметрии) [11–13]. Кроме того, при высоких концентрациях РФ в зависимости от метода значительно различается не только выявляемость, но и определяемый уровень РФ [12].
Данные о чувствительности и специфичности методов весьма вариабельны. Для латекс-теста соотношение чувствительности и специфичности составляет соответственно 41 и 59% [11], для нефелометрии и турбидиметрии – 60–95,2 и 89,4% [12, 13]. Наибольший разброс показателей отмечен в отношении иммуноферментного анализа (ELISA) – 35,7–64 и 33–98,9% [11, 12], что связывают с использованием разных коммерческих диагностических наборов; более того, даже высказывается мнение о невозможности сопоставления результатов иммуноферментного анализа, выполненного с использованием наборов разных производителей [12, 14]. Разночтения продемонстрированы при сравнении шести коммерческих наборов, использованных для определения уровня РФ в референсной сыворотке (WHO International standard, по стандарту уровень РФ в сыворотке – 25 МЕ/мл) [14]. По данным исследования, для четырех наборов показано хорошее соответствие стандарту, а для двух – существенное отличие от него. Кроме того, в сравниваемых наборах различался уровень отсечения, при котором тест считался положительным (5–20 МЕ/мл); это привело к тому, что референсная сыворотка оценивалась тремя тестами как резко положительная, одним тестом – как пограничная и еще одним – как отрицательная.
Таким образом, показатель РФ зависит от используемого метода, а также от применяемого коммерческого набора, многие из которых не валидизированы [12].
РЕВМАТОИДНЫЙ ФАКТОР ПРИ РЕВМАТОИДНОМ АРТРИТЕ
Ревматоидный артрит (РА) – аутоиммунное ревматическое заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом и системным поражением внутренних органов, приводящее к ранней инвалидности и сокращению продолжительности жизни пациентов. Распространенность РА среди взрослого населения в разных географических зонах варьирует от 0,5 до 2%, в России она составляет 0,61% от общей популяции [15].
РФ и вырабатывающие их B-клетки присутствуют в синовиальной оболочке и кровотоке пациентов с РА, однако патогенетическая роль РФ в развитии этого заболевания не ясна. Согласно одной из гипотез, РФ, будучи антигеном к иммунным комплексам, участвует в активации комплемента, способствуя выработке хемотаксических факторов и привлечению клеток воспаления, согласно другой, он, напротив, является результатом воспалительного процесса, а не его триггером [2, 4, 16, 17].
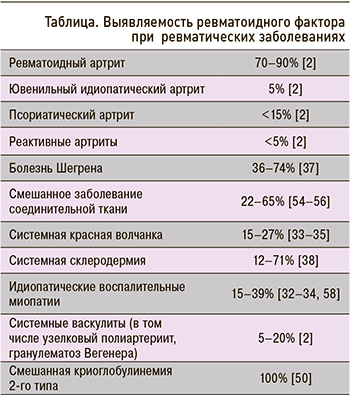
При РА чувствительность РФ достигает 60–80% и возрастает по мере увеличения продолжительности заболевания. В то же время менее 50% пациентов с ранней стадией РА являются РФ-позитивными. Наиболее часто обнаруживается IgM РФ, он же и обладает наибольшей чувствительностью. Специфичность РФ достигает 70–90% и увеличивается пропорционально значению [18].
В соответствии с рекомендациями ACR/ EULAR от 2010 г., выявление повышенных РФ служит одним из диагностических критериев РА. РФ-позитивность поддерживает диагноз РА, но в то же время РФ-негативность не исключает РА, поскольку известно о наличии серонегативных вариантов заболевания. Высокая концентрация РФ рассматривается как предиктор быстро прогрессирующего деструктивного поражения суставов и системных проявлений при РА (таких как ревматоидные узелки и васкулит) [4, 5, 19]. Деструктивный РА обычно отмечается на фоне высоких концентраций РФ (>40 МЕ/мл) или превышающих ВГН в 3 раза [20]. Клинический ответ на лечение сопровождается снижением титров РФ [4, 17]. Уровень РФ может снижаться на фоне лечения некоторыми препаратами: такая картина описана для инфликсимаба [21–23], этанерцепта [24], адалимумаба [25], ритуксимаба [25, 26], абатацепта, тоцилизумаба [28, 29].
Вместе с тем уровень РФ не всегда отражает активность заболевания, поэтому не рекомендуется использовать его для оценки эффективности лечения [19].
У пациентов c РА выявляются различные изотипы РФ: не только IgM, но и IgG и IgA. Также возможно обнаружение IgD и IgE. Характерной является комбинация повышенных IgM и IgA. Высокие титры IgA РФ ассоциированы не только с активностью заболевания, но и с менее выраженным ответом на лечение [4]; в частности, это отмечается на фоне терапии ингибиторами фактора некроза опухоли альфа (анти-ФНО препаратами) [19].
Повышение РФ может на много лет предшествовать клиническому развитию РА [4]. Выявлено последовательное увеличение РФ различных изотипов на доклинической стадии: первым было отмечено возрастание IgM-РФ (примерно за 4 года до начала заболевания), затем IgA-РФ (за 3 года) и после IgG-РФ (примерно за год до дебюта РА) [30, 31].
ПОВЫШЕНИЕ РЕВМАТОИДНОГО ФАКТОРА ПРИ ДРУГИХ РЕВМАТОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЯХ
Системная красная волчанка
Системная красная волчанка (СКВ) – системное аутоиммунное заболевание неизвестной этиологии, характеризующееся гиперпродукцией органоспецифических аутоантител к различным компонентам клеточного ядра с развитием иммуновоспалительного повреждения тканей и внутренних органов. Заболеваемость СКВ колеблется от 4 до 250 случаев на 100 000 населения [32].
РФ выявляется у 15–27% пациентов с СКВ [33–35] и ассоциирован с рядом клинических и лабораторных особенностей, в частности, с сухим синдромом, анемией [35], и не связан с нефритом [34]. При СКВ выявляются различные изотипы РФ: IgM, IgG и IgA выявлены у 17,9, 20,5 и 20,5% пациентов соответственно, при этом комбинации различных изотипов встречается у 19%. Наличие IgA РФ характерно для пациентов с высокой активностью заболевания и отсутствием нефрита [35].
Болезнь Шегрена
Болезнь Шегрена – системное заболевание неизвестной этиологии, характерной чертой которого является хронический аутоиммунный и лимфопролиферативный процесс в секретирующих эпителиальных железах с развитием паренхиматозного сиалоаденита с ксеростомией и сухого кератоконъюнктивита с гиполакримией. Распространенность его составляет 0,1–0,4% [36].
У пациентов с болезнью Шегрена РФ выявляется в 36–74% случаев, при этом частота РФ-позитивности увеличивается вместе с давностью заболевания [37].
У РФ-позитивных пациентов отмечается, помимо прочего, более высокая встречаемость артралгий [38], кожного васкулита, увеличения слюнных желез, цитопении, феномена Рейно, а также поражения почек и центральной нервной системы [39, 40]. Кроме того, повышенный титр РФ служит независимым фактором риска развития неходжкинской лимфомы [41].
Помимо IgM, при болезни Шегрена обнаруживается и IgA (26%) [42], который ассоциирован с поражением почек и легких [42, 43].
Болезнь Шегрена сопровождается наиболее высоким уровнем повышения РФ [44]. Кроме того, существует предположение, что исчезновение РФ у пациента с этим заболеванием может указывать на развитие лимфомы [18].
Системная склеродермия
Системная склеродермия (CCД) – полиорганное заболевание, в основе которого лежат иммунные нарушения и вазоспастические сосудистые реакции по типу синдрома Рейно, сопровождающиеся активацией фиброзообразования и избыточным отложением компонентов внеклеточного матрикса (коллагена) в тканях и органах. Распространенность ССД составляет 30–300 случаев на 1 млн [45]. РФ выявляется у 12–71% пациентов с этим заболеванием [38], ассоциирован с синдромом Шегрена [46], артралгиями и артритом [38].
Идиопатические воспалительные миопатии
Идиопатические воспалительные миопатии (ИВМ) – группа хронических заболеваний неизвестной этиологии, основным проявлением которых выступает симметричная мышечная слабость проксимальных отделов конечностей, связанная с воспалением поперечнополосатой мускулатуры. Согласно эпидемиологическим исследованиям, показатели заболеваемости варьируют от 2,18 до 7,7 случаев в год на 1 млн населения [47]. Данные о частоте и клинической значимости РФ при ИВМ разнятся. В исследовании Ide V. et al. частота повышенного РФ у пациентов с различными формами ИВМ составила 9%, и авторы высказали предположение, что этот показатель не имеет клинического значения [48]. По другим данным, увеличение РФ выявлено у 20% пациентов с дерматополимиозитом, наиболее часто у лиц с перекрестными синдромами [49, 50]. У пациентов с антисинтетазным синдромом, сопровождающимся артритом, РФ-позитивность отмечается в 15–39% [51, 52].
Смешанное заболевание соединительной ткани
Смешанное заболевание соединительной ткани (СЗСТ) – редкая системная патология, характеризующаяся сочетанием отдельных признаков СКВ, ССД, РА, полимиозита, с наличием антител к растворимому ядерному рибонуклеопротеину (анти-u1-РНП) в высоких титрах [53]. Частота СЗСТ достигает 1,9–3,8 на 100 тыс. населения [53].
Повышение уровня РФ отмечается у 22–65% пациентов с СЗСТ [54–56]. При этом обнаруживаются различные его изотипы: IgM-, IgG- и IgA-РФ у 48, 38 и 33% пациентов соответственно. Практически значимых клинико-лабораторных ассоциаций в настоящее время не описано [57].
Сведения о выявляемости РФ при различных ревматических заболеваниях представлены в таблице.
ЗАКЛЮЧЕНИЕ
Таким образом, РФ – это антитела к тяжелой цепи Fc-фрагмента IgG. РФ представлен иммуноглобулинам различных классов, при этом наиболее часто выявляются IgM, A и G. Повышение уровня РФ характерно для РА, однако не является специфическим показателем; оно может наблюдаться и при других заболеваниях, как ревматологических, так и неревматологических, которые будут обсуждаться в следующей части публикации. Более того, возрастание уровня РФ возможно у здоровых лиц, особенно в старшей возрастной группе, что будет также рассмотрено далее. По причине такой неспецифичности повышения РФ исследование этого маркера не рекомендовано в качестве скринингового теста [18]. Показанием к консультации ревматолога служит только высокий уровень РФ, особенно в сочетании с болями в суставах [33]. Лабораторная диагностика данного фактора целесообразна при наличии клинической картины, характерной для ревматического заболевания.
1. Хоббс К. Лабораторные исследования. В книге: Акутота В., Арройо Р.А., Баттафарано Д.Ф. с соавт. Секреты ревматологии. Под ред. О.М. Лесняк. М.: ГЭОТАР-Медиа. 2018; с. 64–73.
2. Gualtierotti R., Ciavarella T., Meroni P.L. Rheumatoid factors. In book: Autoantibodies. 3rd edition. Ed. by Shoenfeld Y., Meroni P.L., Gershwin V.E. Amsterdam: Elsevier B.V. 2014; 751–60. ISBN: 978-0-444-56378-1. https://dx.doi.org/10.1016/C2010-0-68545-2.
3. Ryu H.J., Takeuchi F., Kuwata S. et al. The diagnostic utilities of anti-agalactosyl IgG antibodies, anti-cyclic citrullinated peptide antibodies, and rheumatoid factors in rheumatoid arthritis. Rheumatol Int. 2011; 3(31): 315–19. https://dx.doi.org/10.1007/s00296-009-1260-5.
4. de Angelis V., Meroni P.L. Rheumatoid factors. In book: Autoantibodies. 1st edition. Ed. by Peters J.B., Schoenfeld Y. Amsterdam: Elsevier Inc. 2007; pp. 755–62. ISBN: 978-0-444-52763-9.
5. Александрова Е.Н., Новиков А.А., Насонов Е.Л. Рекомендации по лабораторной диагностике ревматических заболеваний Общероссийской общественной организации «Ассоциация ревматологов России» – 2015. Современная ревматология. 2015; 4: 25–36.
6. Jones J.G. Biochemistry of articular disorders. In book: Marshall W., Lapsley M., Day A., Ayling R. Clinical biochemistry: Metabolic and clinical aspects. 3rd edition. London: Churchill Livingstone. 2014; pp. 636–45. ISBN: 978-0-702-05140-1.
7. Кишкун А.А. Клиническая лабораторная диагностика. М.: ГЭОТАР-Мелиа. 2010; с. 721–723.
8. Фридрихсберг Д.А. Курс коллоидной химии. Спб.: Химия. Ленинградское отделение. 1995; с. 41.
9. Жаворонок С.В., Тапальский Д.В. Иммуноферментный анализ. Учебное пособие. Гомель: Гомельский государственный медицинский университет. 2004; с. 6.
10. Ameratunga R., Musaad S., Sugrue C., Kyle C. Rheumatoid factor measurement-continuing problems 70 years after discovery. Clin Rheumatol. 2011; 9(30): 1215–20. https://dx.doi.org/10.1007/s10067-011-1716-3.
11. Devi C., Ravichandran R., Selvaraj L. et al. Comparative study of rheumatoid factor – IgM autoantibody testing by latex agglutination nephelometry and ELISA in patients with rheumatoid arthritis. Eur J Mol Clin Med. 2020. 8(7): 4521–27.
12. Rocha K.C., Da Fonseca Brinque L.A., Oliveira C.G.B. et al. Comparative study between immunoturbidimetric and latex agglutination methods for the detection of rheumatoid factor. J Bras Patol Med Lab. 2013; 1(49): 12–16. https://dx.doi.org/10.1590/S1676-24442013000100002.
13. Bas S., Perneger T.V., Kunzle E., Vischer T.L. Comparative study of different enzyme immunoassays for measurement of IgM and IgA rheumatoid factors. Ann Rheum Dis. 2002; 6(61): 505–10. https://dx.doi.org/10.1136/ard.61.6.505.
14. Van Hoovels L., Jacobs J., Vander Cruyssen B. et al. Performance characteristics of rheumatoid factor and anti-cyclic citrullinated peptide antibody assays may impact ACR/EULAR classification of rheumatoid arthritis. Ann Rheum Dis. 2018; 5(77): 667–77. https://dx.doi.org/10.1136/annrheumdis-2017-212365.
15. Клинические рекомендации. Ревматоидный артрит. Ассоциация ревматологов России. 2018. Рубрикатор Минздрава России. Доступ: https://cr.minzdrav.gov.ru/schema/250_1 (дата обращения – 16.08.2021).
16. Shmerling R.H. Rheumatoid factor: Biology and utility of measurement. 2021. URL: https://www.uptodate.com/contents/rheumatoid-factor-biology-and-utility-of-measurement (date of access – 11.02.2022).
17. Westwood O.M.R., Nelson P.N., Hay F.C. Rheumatoid factors: What’s new? Rheumatology (Oxford). 2006; 45(4): 379–85. https://dx.doi.org/10.1093/rheumatology/kei228.
18. Salzman B.E., Nevin J.E., Newman J.H. A primary care approach to the use and interpretation of common rheumatologic tests. Clin Fam Pract. 2005; 2(7): 335–58. https://dx.doi.org/10.1016/J.CFP.2005.02.009.
19. Taylor P., Gartemann J., Hsieh J., Creeden J. A systematic review of serum biomarkers anti-cyclic citrullinated peptide and rheumatoid factor as tests for rheumatoid arthritis. Autoimmune Dis. 2011; 1(1): 1–18. https://dx.doi.org/10.4061/2011/815038.
20. Лапин С.В., Мазинг А.В., Булгакова Т.В. с соавт. Клинические рекомендации по лабораторной диагностике аутоиммунных заболеваний. 2014. Доступ: https://medqualitypeople.ru/f/klinicheskie_rekomendacii_po_laboratornoj_diagnostike_autoimmunnyh_zabolevanij_0.pdf (дата обращения – 16.07.2021).
21. Bobbio-Pallavicini F., Alpini C., Caporali R. et al. Autoantibody profile in rheumatoid arthritis during long-term infliximab treatment. Arthritis Res Ther. 2004; 6(3): R264–72. https://dx.doi.org/10.1186/ar1173.
22. De Rycke L., Verhelst X., Kruithof E. et al. Rheumatoid factor, but not anti-cyclic citrullinated peptide antibodies, is modulated by infliximab treatment in rheumatoid arthritis. Ann Rheum Dis. 2005; 2(64): 299–302. https://dx.doi.org/10.1136/ard.2004.023523.
23. Caramaschi P., Biasi D., Tonolli E. et al. Antibodies against cyclic citrullinated peptides in patients affected by rheumatoid arthritis before and after infliximab treatment. Rheumatol Int. 2005; 1(26): 58–62. https://dx.doi.org/10.1007/s00296-004-0571-9.
24. Chen H.A., Lin K.C., Chen C.H. et al. The effect of etanercept on anti-cyclic citrullinated peptide antibodies and rheumatoid factor in patients with rheumatoid arthritis. Ann Rheum Dis. 2006; 1(65): 35–39. https://dx.doi.org/10.1136/ard.2005.038851.
25. Atzeni F., Sarzi-Puttini P., Dell’ Acqua D. et al. Adalimumab clinical efficacy is associated with rheumatoid factor and anti-cyclic citrullinated peptide antibody titer reduction: A one-year prospective study. Arthritis Res Ther. 2005; 1(8): R3 https://dx.doi.org/10.1186/ar1851.
26. Cambridge G., Leandro M.J., Edwards J.C.W. et al. Serologic changes following B lymphocyte depletion therapy for rheumatoid arthritis. Arthritis Rheum. 2003; 48(8): 2146–54. https://dx.doi.org/10.1002/art.11181.
27. Cohen S.B., Emery P., Greenwald M.W. et al. Rituximab for rheumatoid arthritis refractory to anti-tumor necrosis factor therapy: Results of a multicenter, randomized, double-blind, placebo-controlled, phase III trial evaluating primary efficacy and safety at twenty-four weeks. Arthritis Rheum. 2006; 9(54): 2793–806. https://dx.doi.org/10.1002/art.22025.
28. Maneiro R.J., Salgado E., Carmona L., Gomez-Reino J.J. Rheumatoid factor as predictor of response to abatacept, rituximab and tocilizumab in rheumatoid arthritis: Systematic review and meta-analysis. Semin Arthritis Rheum. 2013; 1(43): 9–17. https://dx.doi.org/10.1016/j.semarthrit.2012.11.007.
29. Faillace C., De Carvalho J.F. Rheumatoid factor appearance after tocilizumab treatment seems to predict bad therapeutical response in rheumatoid arthritis. Rheumatol Int. 2013; 7(33): 1909–10. https://dx.doi.org/10.1007/s00296-012-2409-1.
30. Deane K.D., O’Donnell C.I., Hueber W. et al. The number of elevated cytokines and chemokines in preclinical seropositive rheumatoid arthritis predicts time to diagnosis in an age-dependent manner. Arthritis Rheum. 2010; 11(62): 3161–72. https://dx.doi.org/10.1002/art.27638.
31. Deane K.D., Norris J.M., Holers V.M. Preclinical rheumatoid arthritis: Identification, evaluation, and future directions for investigation. Rheum Dis Clin North Am. 2010; 2(36): 213–41. https://dx.doi.org/10.1016/j.rdc.2010.02.001.
32. Федеральные клинические рекомендации по диагностике и лечению системной красной волчанки. Ассоциация ревматологов России. 2016. Доступ: https://rheumatolog.su/media/media/2018/07/18/clinrec_skv.pdf (дата обращения – 11.02.2022).
33. Popescu C., Zofota S., Bojinca V., Ionescu R. The significance of rheumatoid factor and anti-cyclic citrullinated peptide antibodies in systemic lupus erythematosus. Rom J Intern Med. 2013; 51(3–4): 179–87.
34. Fedrigo A., dos Santos T.A.F.G., Nisihara R., Skare T. The lupus patient with positive rheumatoid factor. Lupus. 2018; 27(8): 1368–73. https://dx.doi.org/10.1177/0961203318759607.
35. Witte T., Hartung K., Sachse C. et al. Rheumatoid factors in systemic lupus erythematosus: Association with clinical and laboratory parameters. Rheumatol Int. 2000; 3(19): 107–11. https://dx.doi.org/10.1007/s002960050112.
36. Федеральные клинические рекомендации по диагностике и лечению болезни Шегрена. Ассоциация ревматологов России. 2016. Доступ: https://rheumatolog.su/media/media/2018/07/18/clinrec_b_shyogrena.pdf (дата обращения – 11.02.2022).
37. Bournia V.K., Vlachoyiannopoulos P.G. Subgroups of Sjogren syndrome patients according to serological profiles J Autoimmun. 2012; 39(1–2): 15–26. https://dx.doi.org/10.1016/j.jaut.2012.03.001.
38. Wielosz E., Majdan M., Dryglewska M., Zwolak R. Anti-CCP antibodies and rheumatoid factor in systemic sclerosis: Prevalence and relationships with joint manifestations. Adv Clin Exp Med. 2018; 27(9): 1253–57. https://dx.doi.org/10.17219/acem/69921.
39. Ramos-Casals M., Solans R., Rosas J. et al. Primary Sjogren syndrome in Spain: Clinical and immunologic expression in 1010 patients. Medicine (Baltimore). 2008; 87(4): 210–19. https://dx.doi.org/10.1097/MD.0b013e318181e6af.
40. Martel C., Gondran G., Launay D. et al. Active immunological profile is associated with systemic Sjogren’s syndrome. J Clin Immunol. 2011; 31(5): 840–47. https://dx.doi.org/10.1007/s10875-011-9553-3.
41. Fragkioudaki S., Mavragani C.P., Moutsopoulos H.M. Predicting the risk for lymphoma development in Sjogren syndrome. Medicine (Baltimore). 2016; 95(25): e3766. https://dx.doi.org/10.1097/MD.0000000000003766.
42. Peen E., Mellbye O.J., Haga H. IgA rheumatoid factor in primary Sjogren’s syndrome. Scand J Rheumatol. 2009; 38(1): 46–49. https://dx.doi.org/10.1080/03009740802366043.
43. Kitagawa T., Shibasaki K., Toya S. Clinical significance and diagnostic usefulness of anti-centromere antibody in Sjogren’s syndrome. Clin Rheumatol. 2012; 31(1): 105–12. https://dx.doi.org/10.1007/s10067-011-1789-z.
44. Diaz-Lopez C., Geli C., Corominas H. et al. Are there clinical or serological differences between male and female patients with primary Sjogren’s syndrome? J Rheumatol. 2004; 31(7): 1352–55.
45. Диагностика и лечение прогрессирующего системного склероза (системной склеродермии). М34.0. Ассоциация ревматологов России. 2016. Доступ: https://rheumatolog.su/media/media/2019/02/22/ssd_klin_rekomendatsii.pdf (дата обращения – 11.02.2022).
46. Avouac J., Clements P.J., Khanna D. et al. Articular involvement in systemic sclerosis. Rheumatology (Oxford). 2012; 51(8): 1347–56. https://dx.doi.org/10.1093/rheumatology/kes041.
47. Федеральные клинические рекомендации по диагностике и лечению идиопатических воспалительных миопатий. Ассоциация ревматологов России. 2016. Доступ: https://rheumatolog.su/media/media/2018/07/18/clinrec_id_vosp_mio.pdf (дата обращения – 11.02.2022).
48. Ide V., Bossuyt X., Blockmans D., De Langhe E. Prevalence and clinical correlates of rheumatoid factor and anticitrullinated protein antibodies in patients with idiopathic inflammatory myopathy. RMD Open. 2018; 4(2): e000661. https://dx.doi.org/10.1136/rmdopen-2018-000661.
49. Koler R.A., Montemarano A. Dermatomyositis. Am Fam Physician. 2001; 64(9): 1565–72.
50. Shmerling R.H., Delbanco T.L. The rheumatoid factor: An analysis of clinical utility. Am J Med. 1991; 91(5): 528–34. https://dx.doi.org/10.1016/0002-9343(91)90190-9.
51. Cavagna L., Nuno L., Scire C.A. et al. Serum Jo-1 autoantibody and isolated arthritis in the antisynthetase syndrome: Review of the literature and report of the experience of AENEAS Collaborative Group. Clin Rev Allergy Immunol. 2017; 52(1): 71–80. https://dx.doi.org/10.1007/s12016-016-8528-9.
52. Chen L., Somers A., Liu J. Antisynthetase syndrome and pleural effusion: A case report. Chest. 2020; 158(4): 1991–92. https://dx.doi.org/10.1016/j.chest.2020.08.1725.
53. Шаяхметова Р.У., Ананьева Л.П. Смешанное заболевание соединительной ткани. Современная ревматология. 2019; 1: 11–18.
54. Ungprasert P., Crowson C.S., Chowdhary V.R. et al. Epidemiology of mixed connective tissue disease, 1985–2014: A population-based study. Arthritis Care Res (Hoboken). 2016; 68(12): 1843–48. https://dx.doi.org/10.1002/acr.22872.
55. John K.J., Sadiq M., George T. et al. Clinical and immunological profile of mixed connective tissue disease and a comparison of four diagnostic criteria. Int J Rheumatol. 2020; 2020: 9692030. https://dx.doi.org/10.1155/2020/9692030.
56. Garcia-De La Torre I., Salazar-Paramo M., Salmon-De La Torre G. Mixed connective tissue disease. A clinico-serological study of 17 cases. Mol Biol Rep. 1996; 23(3–4): 153–57. https://dx.doi.org/10.1007/BF00351163.
57. Mimura Y., Ihn H., Jinnin M. et al. Rheumatoid factor isotypes in mixed connective tissue disease. Clin Rheumatol. 2006; 25(4): 572–74. https://dx.doi.org/10.1007/s10067-005-0185-y.
58. Colaris M.J.L., de Boer M., van der Hulst R.R., Cohen Tervaert J.W. Two hundreds cases of ASIA syndrome following silicone implants: a comparative study of 30 years and a review of current literature. Immunol Res. 2017; 65(1): 120–28. https://dx.doi.org/10.1007/s12026-016-8821-y.
Вера Валерьевна Лялина, к.м.н., доцент кафедры госпитальной терапии им. академика Г.И. Сторожакова лечебного факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России. Адрес: 117997, г. Москва, ул. Островитянова, д. 1. E-mail:
. ORCID: https://orcid.org/0000-0002-4262-4060
Элина Альбертовна Скрипниченко, аспирант кафедры госпитальной терапии имени академика Г.И. Сторожакова лечебного факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России. Адрес: 117997, г. Москва, ул. Островитянова, д. 1. E-mail:
. ORCID: https://orcid.org/0000-0001-6321-8419
Ростислав Владимирович Биняковский, клинический ординатор кафедры госпитальной терапии имени академика Г.И. Сторожакова лечебного факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России. Адрес: 117997, г. Москва, ул. Островитянова, д. 1. E-mail:
. ORCID: https://orcid.org/0000-0002-7371-0754
Светлана Васильевна Борисовская, к.м.н., доцент кафедры госпитальной терапии имени академика Г.И. Сторожакова лечебного факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России. Адрес: 117997, г. Москва, ул. Островитянова, д. 1. E-mail:
. ORCID: https://orcid.org/0000-0002-9365-1472
Виктория Сергеевна Долгополова, клинический ординатор кафедры госпитальной терапии имени академика Г.И. Сторожакова лечебного факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России. Адрес: 117997, г. Москва, ул. Островитянова, д. 1.
Тамара Темуриевна Демурия, клинический ординатор кафедры госпитальной терапии имени академика
Г.И. Сторожакова лечебного факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России. Адрес: 117997, г. Москва, ул. Островитянова, д. 1.
. ORCID: https://orcid.org/0000-0002-0581-1043
Диана Ваграмовна Бабаян, клинический ординатор кафедры госпитальной терапии имени академика Г.И. Сторожакова лечебного факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России. Адрес: 117997, г. Москва, ул. Островитянова, д. 1. E-mail:
. ORCID: https://orcid.org/0000-0003-4158-0956
Анна Андреевна Бочарова, клинический ординатор кафедры госпитальной терапии имени академика Г.И. Сторожакова лечебного факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России. Адрес: 117997, г. Москва, ул. Островитянова, д. 1. E-mail:
. ORCID: https://orcid.org/0000-0002-1445-050X
Юлия Валентиновна Полякова, врач-терапевт приемного отделения ГБУЗ «Городская клиническая больница им. В.М. Буянова Департамента здравоохранения города Москвы». Адрес: 115516, г. Москва, ул. Бакинская,
д. 26. E-mail:
. ORCID: https://orcid.org/0000-0002-0184-9378
Вадим Александрович Гульшин, врач-терапевт приемного отделения ГБУЗ «Городская клиническая больница им. В.М. Буянова Департамента здравоохранения города Москвы». Адрес: 115516, г. Москва, ул. Бакинская,
д. 26. E-mail:
. ORCID: https://orcid.org/0000-0002-2855-5804
Анна Владимировна Модестова, к.м.н., доцент кафедры госпитальной терапии имени академика Г.И. Сторожакова лечебного факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России. Адрес: 117997, г. Москва, ул. Островитянова, д. 1. E-mail:
. ORCID: https://orcid.org/0000-0002-7980-5500
Игорь Геннадиевич Никитин, д.м.н., профессор, зав. кафедрой госпитальной терапии № 2 лечебного факультета ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, директор ФГАУ «Национальный медицинский исследовательский центр “Лечебно-реабилитационный центр”» Минздрава России. Адрес: 117997, г. Москва, ул. Островитянова, д. 1. E-mail:
. ORCID: https://orcid.org/0000-0003-1699-0881




