В мире наблюдается неуклонный рост распространенности сахарного диабета (СД) 2 типа и связанных с ним материальных затрат. По данным исследования NATION, в настоящее время 5,4% взрослого населения России страдают СД 2 типа, еще у 19,3% – отмечается предиабет [1].
Врачи всех специальностей должны проводить профилактику нарушений углеводного обмена, однако выявление пациентов с высоким риском развития СД 2 типа представляет собой непростую задачу. Международная федерация диабета (International Diabetes Federation – IDF) рекомендует применять с этой целью опросник Finnish Type 2 Diabetes Risk Assessment Form (FINDRISK), который учитывает такие традиционные факторы риска (ФР), как возраст, избыточный вес, абдоминальное ожирение (АО), СД у родственников, отсутствие физической активности, несбалансированное питание, прием антигипертензивных препаратов, эпизоды гипергликемии в анамнезе [2]. Опросник содержит 8 вопросов, ответы на которые оцениваются в баллах. Сумма баллов составляет суммарный счет (СС) и соотносится с определенным риском развития СД 2 типа в последующие 10 лет («низкий», «слегка повышенный», «умеренный», «высокий» и «очень высокий»). Русскоязычная версия опросника представлена в алгоритмах специализированной медицинской помощи больным СД Российской Федерации [3].
Несмотря на простоту метода, он не использовался ранее при ревматических заболеваниях, в том числе при ревматоидном артрите (РА). До настоящего времени также не проводилось работ по оценке распространенности традиционных ФР СД у больных РА.
Цель исследования: оценка распространенности традиционных ФР и 10-летнего риска развития СД 2 типа у больных РА с помощью опросника FINDRISK.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование было включено 418 больных РА (358 женщин, 60 мужчин), поступивших в клинику ФГБНУ НИИР им. В.А. Насоновой с 1 марта 2015 г. по 30 октября 2015 г. и подписавших информированное согласие. Критерием исключения был ранее установленный диагноз СД 1 или 2 типа. Средний возраст участников составил 54 [41; 63] года, средняя длительность заболевания – 6 [2; 12] лет. Большинство пациентов были серопозитивными по ревматоидному фактору (76%) и антителам к циклическому цитруллинированному пептиду (77%), имели умеренную или высокую активность РА по индексу DAS28 (медиана DAS28 4,7 [3,6; 5,5]). Глюкокортикостероиды (ГКС) получали 176 (42,1%), метотрексат – 201 (48%), другие базисные противовоспалительные препараты – 88 (21%), генно-инженерные биологические препараты – 100 (24%) пациентов. Контрольная группа включала 100 человек (86 женщин, 14 мужчин) без воспалительных заболеваний суставов и СД, сходных по полу и возрасту с больными РА.
Все пациенты с РА и участники контрольной группы заполняли опросник FINDRISK на русском языке. Риск развития СД 2 типа оценивался как «низкий» при СС <7 баллов, «слегка повышенный» – при СС от 7 до 11 баллов, «умеренный» – при СС от 12 до 14 баллов, «высокий» – при СС от 15 до 20 баллов и «очень высокий» – при СС ≥20 баллов [2, 3].
Активность РА оценивалась по индексу Disease Activity Score 28 (DAS28), функциональное состояние – с помощью опросника Health Assessment Questionnaire (HAQ) [4].
Статистическую обработку полученных данных проводили с использованием программы Statistica 6.0 (StatSoft, США). Результаты представлены в виде медианы и интерквартильного размаха (Ме [25%; 75%]. При сравнении двух независимых групп по количественному признаку применяли критерий Манна-Уитни, при сравнении 3 групп – тест Краскела-Уоллиса, качественные показатели сравнивались в таблице сопряженности с помощью теста χ2. Корреляционный анализ проводили по методу Спирмена. Различия считались статистически значимыми при р<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
 Распространенность традиционных ФР СД при РА и в контрольной группе оказалась следующей: возраст старше 45 лет – у 289 (69%) пациентов и 79 (79%) здоровых лиц, индекс массы тела (ИМТ) ≥25 кг/м2 – у 212 (51%) и 57 (57%), СД у родственников – у 118 (28%) и 34 (34%), отсутствие физической активности – у 294 (70%) и 62 (62%), несбалансированное питание – у 195 (47%) и 37 (37%), прием антигипертензивных препаратов – у 172 (41%) и 40 (40%), эпизоды гипергликемии в анамнезе – у 78 (19%) больных и 18 (18%) участников без воспалительных заболеваний суставов соответственно (р>0,05 во всех случаях). Достоверные различия были выявлены только по частоте АО, которое наблюдалось у 266 (64%) больных РА и 75 (75%) человек в контрольной группе (р=0,03). Среднее число ФР СД, встречающихся у одного пациента, при РА составляло 4 [2; 5], в контроле – 4 [3; 5] (р=0,23).
Распространенность традиционных ФР СД при РА и в контрольной группе оказалась следующей: возраст старше 45 лет – у 289 (69%) пациентов и 79 (79%) здоровых лиц, индекс массы тела (ИМТ) ≥25 кг/м2 – у 212 (51%) и 57 (57%), СД у родственников – у 118 (28%) и 34 (34%), отсутствие физической активности – у 294 (70%) и 62 (62%), несбалансированное питание – у 195 (47%) и 37 (37%), прием антигипертензивных препаратов – у 172 (41%) и 40 (40%), эпизоды гипергликемии в анамнезе – у 78 (19%) больных и 18 (18%) участников без воспалительных заболеваний суставов соответственно (р>0,05 во всех случаях). Достоверные различия были выявлены только по частоте АО, которое наблюдалось у 266 (64%) больных РА и 75 (75%) человек в контрольной группе (р=0,03). Среднее число ФР СД, встречающихся у одного пациента, при РА составляло 4 [2; 5], в контроле – 4 [3; 5] (р=0,23).
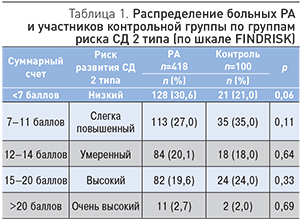
Средние СС при РА (10 [6; 14] баллов) и в контрольной группе (11 [7; 15] баллов) не отличались (р=0,38). Распределение больных РА и участников контрольной группы по риску развития СД 2 типа, согласно FINDRISK, также оказалось сходным (табл. 1).
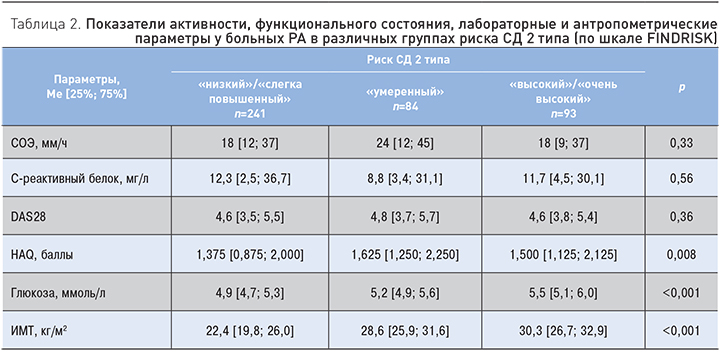
В дальнейшем две первые и две последние группы риска СД 2 типа были объединены, чтобы облегчить статистический анализ результатов. Функциональное состояние по индексу HAQ было наилучшим у пациентов с «низким»/«слегка повышенным» риском СД 2 типа. Активность РА (по DAS28) от группы риска не зависела. Уровни глюкозы и ИМТ были больше у больных с «высоким»/«очень высоким» риском развития СД 2 типа (табл. 2).
Существовала слабая корреляция между числом ФР и DAS28 (r=0,1, p=0,05), HAQ (r=0,19, p<0,001), СС и HAQ (r=0,16, p=0,001).
Прием ГКС в момент исследования не влиял на СС, число ФР, а также на распределение больных по группам риска развития СД 2 типа.
Воспалительные заболевания суставов, такие как РА и псориатический артрит, ассоциируются с увеличением частоты СД 2 типа примерно в 1,5–2 раза по сравнению с общей популяцией [5], что делает актуальным своевременное выявление пациентов с высоким риском развития нарушений углеводного обмена, которым требуется тщательное наблюдение и проведение своевременной профилактики.
Предполагают, что в основе дисбаланса метаболизма глюкозы при ревматических заболеваниях лежит нарушение секреции инсулина и чувствительности к нему периферических тканей не только под воздействием традиционных ФР, но и воспаления [6]. Кроме того, важная роль в формировании инсулинорезистентности отводится лекарственным препаратам, в первую очередь – ГКС [7].
Наше исследование было посвящено оценке традиционных ФР развития СД 2 типа у больных РА, таких как возраст старше 45 лет, отягощенная наследственность, эпизоды гипергликемии в анамнезе, избыточная масса тела, АО, отсутствие регулярных занятий физическими упражнениями и потребления пищевых волокон с овощами и фруктами, прием антигипертензивных препаратов (как эквивалент артериальной гипертензии). Стоит отметить, что большая часть из них может быть отнесена к модифицируемым ФР.
По нашим данным, у одного пациента с РА имелось в среднем 4 ФР, причем, помимо возраста, наиболее часто встречались избыточный вес и ожирение, в том числе АО, а также недостаточная физическая активность.
Ожирение, неотъемлемая часть метаболического синдрома, наблюдается у 63–68% больных РА и ассоциируется с большей активностью заболевания и недостаточной эффективностью противовоспалительной терапии [8, 9]. Клетки жировой ткани, адипоциты, и окружающие их макрофаги способны продуцировать третью часть циркулирующих провоспалительных цитокинов, участвующих в патогенезе РА, например, интерлейкина-6. С другой стороны, провоспалительные цитокины стимулируют дифференцировку адипоцитов и снижают их чувствительность к воздействию инсулина, лептина и других адипоцитокинов [10, 11]. Среди наших пациентов избыточный вес имели 51%, АО – 64%. То, что АО при РА регистрировалось реже, чем в контрольной группе, по-видимому, объясняется развитием в некоторых случаях ревматоидной кахексии на фоне высокой активности заболевания.
Об отсутствии регулярных физических нагрузок сообщили 70% больных РА, но столь высокий процент свидетельствовал, скорее, о неправильном поведенческом стереотипе, чем о наличии выраженных функциональных нарушений, вызванных болью, припухлостью или деформацией суставов, т.к. сходные результаты были получены и у здоровых людей. Все же РА, по-видимому, вносил определенный вклад в сложившуюся ситуацию, поскольку существовала слабая корреляция между активностью РА (по DAS28) и числом ФР, а также индексом HAQ и числом ФР.
В целом спектры ФР при РА и в контрольной группе не отличались. Сходным оказалось также распределение больных РА и лиц без воспалительных заболеваний суставов по группам риска развития СД 2 типа, которые в дальнейшем для облегчения статистического анализа были разделены на три большие категории: в первую вошли пациенты с «низким» и «слегка повышенным» риском, во вторую – больные с «умеренным» риском, в третью – лица с «высоким» и «очень высоким» риском. Такое деление проведено не случайно и основано на принципе необходимости вмешательства: при «низком» и «слегка повышенном» риске какая-либо коррекция поведения и дополнительное обследование не нужны, люди с «умеренным» риском нуждаются в активном наблюдении и изменении стиля жизни, а при «высоком» и «очень высоком» риске возможно применение сахароснижающих препаратов. В нашем исследовании проведение профилактики СД 2 типа требовалось 42% больных РА и 44% в контрольной группе.
Интересно, что при валидации шкалы FINDRISK на европеоидной популяции г. Новосибирска лидирующие позиции в списке занимали те же традиционные ФР, что и в нашей работе: ИМТ ≥25 кг/м2 (73%), АО (43%), недостаточная физическая активность (82%). Консультация эндокринолога для получения рекомендаций по коррекции образа жизни и/или назначению лекарственной терапии требовалась 32% участников [12].
Больные РА с «умеренным», «высоким» и «очень высоким» риском в нашем исследовании имели более выраженное снижение качества жизни, чем пациенты с «низким» и «слегка повышенным» риском СД 2 типа. Уровень глюкозы в венозной крови у них также оказался выше, как и средний ИМТ. В то же время мы не обнаружили прямого влияния текущего приема ГКС ни на число ФР, ни на распределение по группам риска развития СД 2 типа, однако в ряде работ продемонстрировано увеличение частоты нарушений углеводного обмена при использовании данных препаратов. Возможно, ГКС следует рассматривать как дополнительный независимый ФР развития СД 2 типа, в этом случае модификация шкалы FINDRISK с учетом проводимой лекарственной терапии позволит давать более точный прогноз у больных РА.
Несмотря на это, опросник FINDRISK может служить простым, недорогим и эффективным методом для стратификации риска развития СД 2 типа при РА, выявления больных, которые нуждаются в изменении стиля жизни или дополнительном обследовании, с целью исключения у них скрытых симптомов эндокринной патологии.


