ВВЕДЕНИЕ
Амилоидоз представляет собой группу заболеваний, которые характеризуются внеклеточным отложением специфического гликопротеида (амилоида). Этот процесс может быть локальным, с преимущественным поражением отдельных органов (почки, печень, сердце и др.), или системным, с множественным поражением внутренних органов.
Амилоидная кардиопатия относится к наиболее тяжелым проявлениям системного амилоидоза. При этом происходит замещение миокарда амилоидными массами, в результате чего нарушается нормальная архитектура тканей и развивается рестриктивная кардиомиопатия, приводящая к тяжелой и рефрактерной к терапии сердечной недостаточности [1, 2].
Несмотря на детально изученное поражение сердца при амилоидозе, это заболевание диагностируется достаточно поздно в связи с отсутствием специфичных клинических симптомов. Иногда диагноз верифицируется по данным патологоанатомического вскрытия.
В данной статье приводится клинический случай амилоидной кардиомиопатии.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациентка М., 67 лет, впервые обратилась к кардиологу консультативной поликлиники БУ «Республиканский кардиологический диспансер» Минздрава Чувашии (РКД) в августе 2021 г. c жалобами на слабость, утомляемость, инспираторную одышку при нагрузке в пределах самообслуживания, учащенное неритмичное сердцебиение постоянного характера, снижение рабочего артериального давления (АД) до 90/60 мм рт.ст., потерю веса на 8 кг за предшествующие 3 мес.
При инструментальном обследовании по данным электрокардиограммы (ЭКГ) выявлена фибрилляция предсердий с частотой сердечных сокращений (ЧСС) 97 уд/мин, снижение вольтажа зубцов комплекса QRS.
Данные эхокардиоскопии (ЭхоКС): конечно-диастолический размер (КДР) левого желудочка (ЛЖ) 3,5 см, фракция выброса (ФВ) 64%, диастолическая дисфункция по рестриктивному типу, диффузная гипокинезия стенок ЛЖ, систолическое давление в легочной артерии (СДЛА) 50 мм рт.ст., расщепление листков перикарда до 3–7 мм вдоль всех стенок, коллабирование стенок правого предсердия, расщепление листков плевры слева до 45 мм, справа – до 70 мм.
Пациентке был выставлен предварительный диагноз: нарушения ритма по типу персистирующей формы фибрилляции предсердий неизвестной давности. EHRA 2. Риск тромбоэмболических осложнений по шкале CHA2DS2VASC 4 балла. Риск кровотечения по шкале HAS-BLED 2 балла. Рестриктивная кардиомиопатия.
Осложнения: хроническая сердечная недостаточность (ХСН) с сохраненной ФВ (64%) по диастолическому типу, стадия IIБ, функциональный класс (ФК) IV (по NYHA). Двусторонний гидроторакс. Гидроперикард.
Сопутствующие: анемия легкой степени.
В связи с явлениями декомпенсации сердечной недостаточности по обоим кругам кровообращения пациентке была рекомендована госпитализация в кардиологическое отделение № 1 РКД для лечения сердечной недостаточности и уточнения диагноза.
В период госпитализации (12.08.2021–25.08.2021) пациентке были выполнены лабораторно-инструментальные исследования. Результаты общего анализа крови: снижение гемоглобина до 102 г/л, скорость оседания эритроцитов (СОЭ) 12 мм/ч. Данные биохимического анализа крови: креатинин – 64 ммоль/л, скорость клубочковой фильтрации (СКФ, CKD-EPI) 84 мл/ мин/1,73м2. Общий анализ мочи в пределах нормы.
Также пациентке выполнена коронароангиография, которая не выявила признаков атеросклеротического поражения коронарных артерий. На фоне проводимой консервативной терапии (сартаны, бета-блокаторы, анатагонисты альдостерона, петлевые диуретики, ингибитор карбоангидразы, нефракционированный гепарин, глюкокортикостероиды) достигнуто клиническое улучшение: компенсация явлений сердечной недостаточности.
15.09.2021 больной была проведена заочная консультация в ФГБУ «Федеральный центр сердечно-сосудистой хирургии» (г. Пенза), рекомендовано дообследование: эндокардиальное электрофизиологическое исследование (эндоЭФИ) и возможная радиочастотная аблация (РЧА) фибрилляции предсердий. Также была определена дата госпитализации – 29.09.2021.
С 10 по 24.09.2021 пациентка лечилась стационарно в БУ «Центральная городская больница» Минздрава Чувашии по поводу внебольничной пневмонии. Проводилась антибактериальная терапия (цефотаксим, левофлоксацин), пациентка выписана с выздоровлением.
22.10.2021 пациентка была повторно осмотрена кардиологом консультативной поликлиники РКД. При ЭхоКС с учетом выраженной гипертрофии ЛЖ, бивентрикулярного утолщения стенок ЛЖ, феномена «пареза базальных отделов», гидроперикарда, «необъяснимой» сердечной недостаточности, рефрактерной к проводимой терапии, высказано предположение о наличии рестриктивной кардиомиопатии (амилоидной?). Пациентка была направлена на консультацию в ФГБУ «НМИЦ кардиологии» Минздрава России.
28.10.2021 в НМИЦ кардиологии была выполнена сцинтиграфия миокарда: сцинтиграфических признаков острого повреждения миокарда не обнаружено. Накопления радиофармпрепарата в миокарде, характерного для ATTR-амилоидоза, не выявлено.
29.10.2021 по возвращению в г. Чебоксары пациентка отметила нарастание одышки, вызвала 03. При компьютерной томографии органов грудной клетки (КТ ОГК) были определены признаки вирусной пневмонии с поражением до 25%, а также КТ-признаки тромбоэмболии левой легочной артерии с распространением на верхнедолевую и нижнедолевую артерии. Выявлены правосторонний гидроторакс, асцит.
Пациентка была госпитализирована в отделение РКД, перепрофилированное для лечения новой коронавирусной инфекции. От COVID-19 не вакцинирована. ПЦР анализы на новую коронавирусную инфекцию за период госпитализации отрицательные.
Данные лабораторных исследований: С-реактивный белок (СРБ) – до 20 нг/мл; ферритин – 420 нг/л; D-димер – 1,52–5,82–2,8 нг/ мл; триглицериды –до 1,75 ммоль/л; фибриноген – до 4,94 г/л; прокальцитониновый тест – 0,059–0,032; тропонин T – 0,139–0,104 нг/мл.
Результаты эхокардиографии (ЭхоКГ): ФВ 33%. Снижение сократительной способности ЛЖ. Диффузная гипокинезия миокарда ЛЖ. Увеличение размеров предсердий, гипертрофия миокарда ЛЖ, митральная регургитация (МР) 2 степени. Трикуспидальная регургитация (ТР) 2–3 степени, СДЛА 65 мм рт.ст. Расщепление листков перикарда вдоль задней стенки ЛЖ до 3–4 мм. Расщепление листков плевры справа до 29 мм, слева – до 16 мм.
На фоне противовирусной и противовоспалительной терапии глюкокортикостероидами (с учетом явлений «цитокинового шторма») достигнуты критерии выздоровления от COVID (отсутствие лихорадки, устойчивые показатели сатурации О2, отсутствие лейкопении, улучшение клинической картины).
После выписки пациентка была направлена на консультацию к гематологу БУ «Республиканская клиническая больница» Минздрава Чувашии, так как в период лечения, по данным иммунохимического исследования белков крови, был выявлен М-градиент при иммунофиксации белков сыворотки крови (рис. 1).

Гематологом проведена стернальная пункция. В миелограмме от 06.12.2021 выявлены плазматические клетки (27,6%). Выставлен диагноз: множественная миелома, диффузно-узловая форма, ст. 2. Учитывая наличие выраженной постковидной астении, от назначения полихимиотерапии гематологи воздержались.
20.12.2021 в 09:53 пациентка была доставлена по линии 03 в приемный покой РКД в крайне тяжелом состоянии с признаками декомпенсации сердечной недостаточности, госпитализирована в отделение реанимации и интенсивной терапии (АД 100/35 мм рт.ст., ЧСС 73 уд/мин, тропонин Т – 0,18 нг/л).
ЭКГ при поступлении: ритм синусовый. S-тип ЭКГ. Низкоамплитудная ЭКГ. Слабо (-) зубец Т I, avL, V5–V6. Рубцовые изменения боковой стенки ЛЖ.
За время наблюдения состояние пациентки оставалось тяжелым, гемодинамика с поддержкой вазопрессорами держалась на уровне 90–100/50–60 мм рт.ст. Проводилась активная диуретическая терапия, лечение антагонистом рецепторов ангиотензина II в комбинации с ингибитором неприлизина, селективным обратимым ингибитором натрий-глюкозного котранспортера 2-го типа. С учетом лейкоцитоза в общем анализе крови, декомпенсированной сердечной недостаточности с застоем в малом круге кровообращения и высокого риска развития гипостатической пневмонии выполнялась антибактериальная терапия (цефоперазон + сульбактам, линезолид).
29.12.2021 была проведена КТ ОГК: КТ-признаки вирусной пневмонии (в том числе Covid): КТ-1 – легкая (до 25%). КТ-признаки характерны для правосторонней нижнедолевой пневмонии.
Иммунохроматографический анализ (ИХА) на антиген SARS-CoV-2 – отрицательный.
Пациентка переведена в отделение анестезиологии и реанимации (ПРИТ) для лечения новой коронавирусной инфекции.
При обследовании: D-димер – 4,73 мкг/л; прокальцитониновый тест – 0,252 нг/мл; СРБ – 22,2 мг/л; тропонин I – 0,202 нг/мл; ферритин – 1894 нг/л. Проведена терапия левилимабом, глюкокортикостероидами, допамином.
Несмотря на проводимую терапию у пациентки нарастали признаки полиорганной недостаточности (печеночной, почечной, церебральной, сердечно-сосудистой).
30.12.2021 в 07:35 на ЭКГ-мониторе – асистолия. Реанимационные мероприятия в течение 30 мин оказались неэффективными. В 08:05 того же дня была констатирована биологическая смерть.
По данным патологоанатомического вскрытия, непосредственной причиной смерти послужила двусторонняя тотальная пневмония вирусно-бактериальной этиологии (Acinetobacter spp.), осложненная отеком легких. Наличие сочетанной патологии – миеломной болезни с развитием амилоидоза сердца (рис. 2) и почек – усугубило течение заболевания и способствовало наступлению летального исхода.
ОБСУЖДЕНИЕ
В зависимости от белка-предшественника амилоида в настоящее время выделяют 36 типов амилоидоза [3]. Основные типы амилоидоза с поражением сердца представлены в таблице 1.
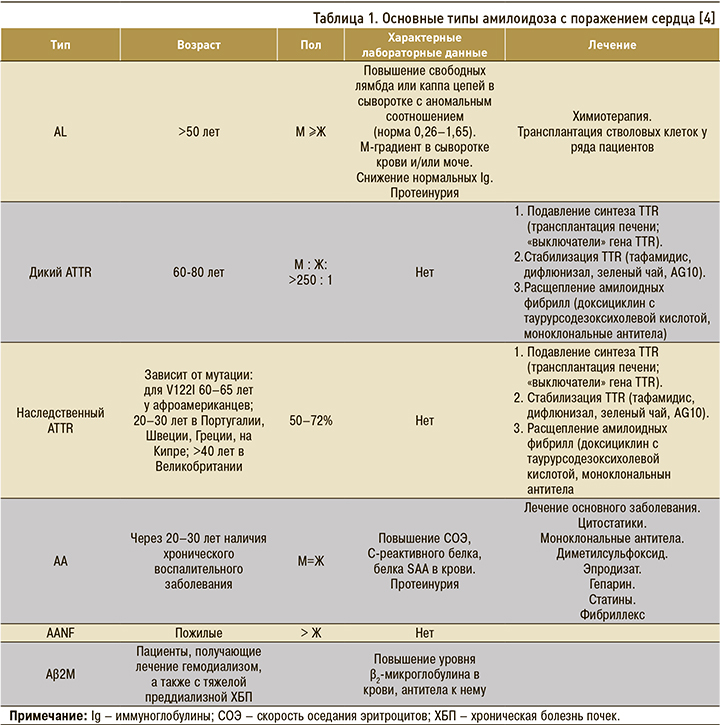
Наиболее распространенной и тяжелой формой амилоидоза сердца является AL-тип, или амилоидоз легких цепей, также называемый первичным или идиопатическим. Клон плазматических клеток продуцирует моноклональные легкие цепи, которые проявляются органотоксичностью и отложением во внутренних органах.
В 10–15% случаев AL-амилоидоз ассоциирован с множественной миеломой [5].
При AL-амилоидозе сердечная недостаточность развивается относительно рано, у 22% больных – уже в дебюте болезни. Поражение сердца при AL-амилоидозе почти всегда происходит на фоне поражения других органов, чаще всего почек, а также сосудов, периферической нервной системы, печени, желудочно-кишечного тракта, мягких тканей. При AL-амилоидозе сердца с клиникой ХСН без лечения летальный исход наступает в среднем в течение нескольких месяцев [6]. Поражение сердца – основной предиктор неблагоприятного прогноза, тяжесть поражения влияет на выбор терапевтической стратегии.
В представленном случае клиническая картина развернулась в течение 5 мес, дебютировала нарушениями ритма в виде фибрилляции предсердий и рефрактерной сердечной недостаточностью с ранним развитием правожелудочковой недостаточности, на фоне псевдонормальной картины ЭхоКС.
«Золотым стандартом» диагностики амилоидоза по-прежнему остается гистологическое исследование с окраской конго красным. Для биопсии при системном поражении исследуют подкожную жировую клетчатку и эндоскопические биоптаты желудочно-кишечного тракта.
Сердечные биомаркеры – натрийуретический пептид B-типа (BNP) и N-концевой proBNP (NT-proBNP) – значительно повышены при сердечном амилоидозе из-за прямой компрессии кардиомиоцитов и стресса, вызванного повышенным давлением наполнения. Они могут быть полезны как для выявления поражения сердца при системном амилоидозе, так и оценки тяжести заболевания [7].
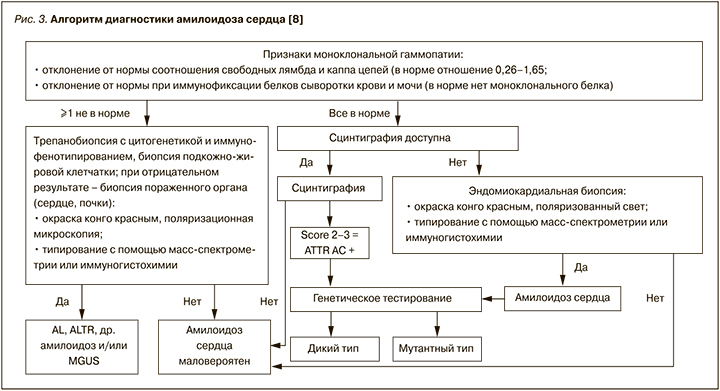
При клинических признаках, данных ЭКГ, ЭхоКГ, МРТ, биомаркерах, позволяющих заподозрить амилоидоз, применяется алгоритм диагностики амилоидоза сердца, представленный на рисунке 3.
По современным представлениям, лечение любого типа амилоидоза включает патогенетическую (антиамилоидную, направленную на уменьшение продукции или на выведение белков-предшественников) и синдромальную терапии.
Для прекращения синтеза легких цепей иммуноглобулинов используются различные химиотерапевтические препараты (алкилирующие агенты, стероиды, ингибитор протеасом бортезомиб) и/или иммуномодулирующие препараты в комбинации с трансплантацией аутологичных стволовых клеток [9]. Напомним, что в представленном клиническом случае имелись противопоказания к химиотерапии. Симптоматическая терапия проводилась в полном объеме по протоколу ХСН.
ЗАКЛЮЧЕНИЕ
Амилоидоз встречается гораздо чаще, чем диагностируется [10]. Вероятнее всего, в рассмотренном клиническом случае у пациентки имел место амилоидоз AL-типа.
Ранний скрининг на амилоидоз очень важен, так как позволяет своевременно начать специфическую для данной формы заболевания терапию. В последние годы в лечении пациентов с самой тяжелой формой, системным AL-амилоидозом, применяют новые химиотерапевтические схемы, в частности, препараты, используемые при лечении миеломы. Они значительно улучшают прогноз у таких пациентов и увеличивают выживаемость до 5 лет и более.


