ВВЕДЕНИЕ
С начала пандемии COVID-19 в мире проводились научные исследования в области этиологии, патогенеза, клиники, гистологии и морфологии новой коронавирусной инфекции [1]. По сравнению с другими вирусами с высокой степенью передачи SARS-CoV-2 характеризуется высокими показателями заболеваемости и смертности, причем патогенез развития связанных с ним жизнеугрожающих осложнений окончательно не установлен [2].
Zhou P. et al. выявили, что SARS-CoV-2 взаимодействует с молекулами ангиотензинпревращающего фермента II (АПФ 2) через белок S [3]. АПФ2 широко экспрессируется в сердце, сосудах, кишечнике, легких (особенно в пневмоцитах и макрофагах 2-го типа), почках, яичках и головном мозге. Легкие являются наиболее уязвимым перед SARS-CoV-2 органом; при этом их поражение сопровождается диффузным альвеолярным повреждением, экссудацией, интерстициальным фиброзом, обширной инфильтрацией иммунными клетками, альвеолярными макрофагами [4]. Одним из вероятных ключевых элементов патогенеза COVID-19 может быть патологический ответ врожденного иммунитета, а именно синдром гиперактивации макрофагов. Макрофаги – это гетерогенная клеточная популяция, основные функции которых включают фагоцитоз чужеродных агентов и клеточно-тканевого детрита, стимуляцию и регулирование иммунного ответа, индукцию воспалительных реакций, участие в репаративных процессах и обмене компонентов внеклеточного матрикса. Одним из основных клеточных маркеров макрофагов, является CD (cluster of differentiation – кластеры дифференцировки) 68. CD68 представляет собой гликозилированный гликопротеин (массой 110 кДа), кодируемый геном на хромосоме 17p13, который с высокой степенью экспрессируется в макрофагах и других мононуклеарных фагоцитах [5].
Ранее проводились исследования наличия макрофагах в тканях при различных заболеваниях. В частности, Yamashita M. et al. выполнили ретроспективный анализ плотности инфильтрации макрофагов при идиопатической интерстициальной пневмонии (ИИП), в ходе которого установили, что при этом заболевании она значимо выше по сравнению с контрольной группой, хотя различий по данному показателю между различными ИИП обнаружено не было [6]. В свою очередь, при изучении Эпштейн–Барр-ассоциированной пневмонии у пациентов с посттрансплантационной лимфопролиферативной болезнью биопсия легкого показала интерстициальные интраальвеолярные инфильтраты, в основном состоящие из CD3 Т-клеток и CD68 макрофагов [7]. Также они были выявлены у пациентов с пневмоцистной пневмонией [8].
Исследования наличия макрофагов в различных органах и тканях при COVID-19 носят фрагментарный характер и преимущественно ограничены исследованием легких, где были обнаружены значительные макрофагальные инфильтрации [9]. Есть данные об обнаружении макрофагов в тканях селезенки и лимфатических узлов [10]. При этом клинически COVID-19 характеризуется мультиорганным поражением, и наличие макрофагов в тканях этих органов требует дальнейшего исследования.
Цель исследования – определить наличие макрофагальной инфильтрации в различных органах и тканях у пациентов с новой коронавирусной инфекцией COVID-19.
МАТЕРИАЛ И МЕТОДЫ
Проведено комплексное патологоанатомическое исследование секционного материала, полученного после аутопсий 23 умерших пациентов с основным диагнозом COVID-19, подтвержденных прижизненными положительными ПЦР-тестами на наличие SARS-CoV-2 в промежутке от 6 до 21 дней до летального исхода, а также посмертными положительными ПЦР-тестами на наличие SARS-CoV-2 в легочной ткани. В качестве непосредственной причины смерти исследованных пациентов было установлено диффузное альвеолярное повреждение с легочно-сердечной недостаточностью вследствие поражения легочной ткани коронавирусом.
Исследование было одобрено Локальным комитетом по медицинской этике ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава России (протокол № 4 от 21.04.2021).
Возраст пациентов варьировал от 33 до 85 лет (средний возраст 64,5±12,9), мужчин было 15 человек (65,2%). Индекс массы тела составил 27,7±3,8 кг/м2. Пациенты ранее были госпитализированы в стационар в среднем на 9,2±5,5 сут от момента появления первых симптомов COVID- 19, длительность госпитализации равнялась 11,1±7,5 дней. Сывороточная концентрация С-реактивного белка (СРБ) в первые сутки госпитализации в стационар была 64,4 [118,8; 39,5] мг/л. Средний объем поражения легочной паренхимы по данным компьютерной томографии (КТ) в первые сутки госпитализации в стационар составил 44,7±17,7%. Гипертоническая болезнь имела место в анамнезе у 15 пациентов, цереброваскулярное заболевание – у 10, ишемическая болезнь сердца – у 9, сахарный диабет – у 8.
Наружный осмотр и полное вскрытие тел всех умерших с положительным ПЦР-тестом на SARS-CoV-2 проводились после соблюдения надлежащих мер безопасности в соответствии с рекомендациями Российского патологоанатомического общества (версия 12 от 21.09.2021), которые согласуются с соответствующими международными рекомендациями. Интервал от смерти до патологоанатомического исследования и вскрытия (посмертный интервал) находился в интервале от 1 до 2,5 дней. При вскрытии были взяты образцы тканей для гистологического исследования из сердца, легких, печени, почек, селезенки, поджелудочной железы, головного мозга, тонкой и толстой кишки. В качестве контроля для сравнения с поврежденной структурой тканей были использованы образцы тканей 5 пациентов, у которых установленной причиной смерти был геморрагический инфаркт головного мозга с отсутствием повреждений со стороны дыхательной системы и без макрофагальной инфильтрации легочной ткани.
При проведении иммуногистохимического анализа свежие ткани фиксировали в 10% нейтральном формалине («Биовитрум», Россия) в течение 72 ч в соответствии с рекомендациями по работе с SARS-CoV-2, проводили дегидратацию с использованием абсолютного изопропанола («Биовитрум», Россия) и заливали в гистологическую парафиновую среду («Биовитрум», Россия). После получения тонких срезов 4 мкм, первичной депарафинизации и регидратации в изопропиловом спирте нисходящей концентрации проводилось собственно иммуногистохимическое окрашивание. Демаскировку антигена выполняли с помощью EnVision Flex Target Retriveal Soluton (Dako, США). Использовались мышиные моноклональное антитела анти-CD68 (клон КР1, Invitrogen, разведение 1:100). Для визуализации реакции антиген-антитело применялась система детекции Novolink Polymer-HRP (Novolink, Leica, Biosystems, UK). Предметные стекла докрашивали раствором гематоксилина. Изображения были получены с использованием светового микроскопа Carl Zeiss Axiocam 506 (Jenamed, Carl Zeiss, Германия).
РЕЗУЛЬТАТЫ
При иммуногистохимическом исследовании образцов тканей были выявлены множественные аберрантные скопления тучных CD68 положительных макрофагов, при этом поражение преимущественно наблюдалось в паренхиме легких и почек. Инфильтрация была обнаружена и в других органах, но носила менее выраженный характер (диффузная и скудная). В легочной ткани отмечались массивные скопления клеток с выраженной экспрессией CD68, немногочисленные подобные клетки были обнаружены в межальвеолярных перегородках. При рассмотрении микропрепарата почек выявлялись единичные CD68-положительные клетки в дистрофичных клубочках и строме с формированием мелких групп (рис. 1).
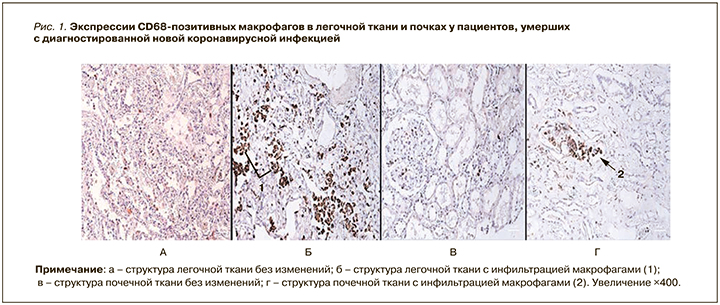
В слизистой оболочке тонкого кишечника были найдены массивные полнокровные паретически расширенные сосуды с косым стоянием лимфоцитов и CD68-положительных клеток, имело место частичное окрашивание ворсинчатой каймы. В ткани толстого кишечника наблюдалась схожая ситуация – диффузно расположенные CD68-позитивные клетки в подслизистом слое и со стороны серозной оболочки паретически расширенных сосудов. В ткани поджелудочной железы по краю долей были выявлены CD68-положительные клетки и участки сгущения макрофагальной инфильтрации с интенсивным прокрашиванием (рис. 2).
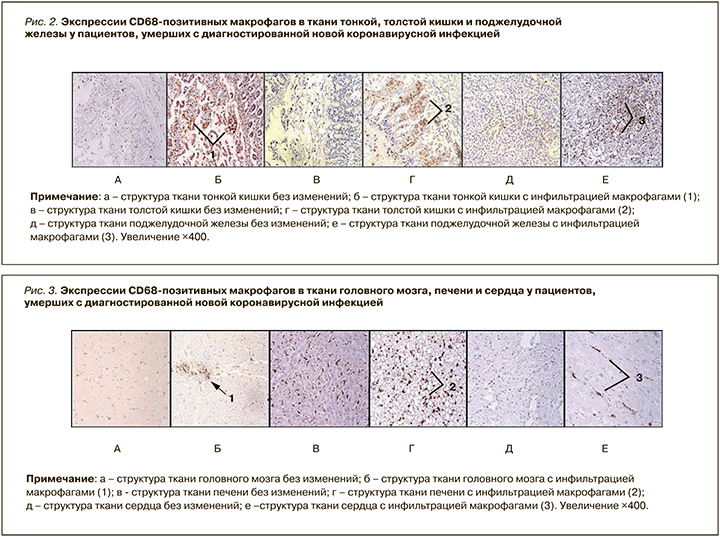
В головном мозге были выявлены паравазальные лимфоидные инфильтраты со скоплениями CD68-позитивных клеток, в печени – значительное увеличение количества макрофагальных элементов в участках с выраженной жировой дистрофией, гипертрофия и гиперплазия купферовских клеток. При рассмотрении микропрепарата ткани сердца отмечались единичные клетки и группы клеток с экспрессией CD68 между резко дистрофичных кардиомиоцитов (рис. 3).
ОБСУЖДЕНИЕ
На сегодняшний день результаты большинства иммуногистологических исследований тканей у пациентов с новой коронавирусной инфекцией COVID-19 согласуются с полученными нами результатами. В исследовании, проведенном Dorward D.A. et al., в ткани почек была выявлена сильная лейкоцитарная инфильтрация, большую часть которой составляли CD68-положительные клетки [11]. Также CD68-положительные макрофаги образовывали основную массу инфильтрации ткани легкого при исследовании аутопсийного материала 11 пациентов с новой коронавирусной инфекцией, причем большее количество депозитов находилось в паренхиме, а не в сосудах или околососудистых пространствах [12]. При этом есть данные об отсутствии CD68-положительных макрофагов в биоптатах ткани легкого и дыхательных путей у единичных пациентов с организующимся альвеолярным поражением, что может быть проявлением как стадийности процесса, так и индивидуальных особенностей реакции организма [13]. В исследовании Duarte-Neto A.N. et al. при иммуногистохимическом окрашивании легочной ткани было выявлено небольшое количество CD20 В-клеток во всех случаях COVID-19 и отсутствие признаков образования лимфоидных агрегатов. Макрофаги CD68 присутствовали в основном в альвеолярных пространствах и зонах ремоделирования тканей. Некоторые многоядерные атипичные гигантские клетки представляли собой CD68 альвеолярные макрофаги [14].
Одним из наиболее полных источников сведений о данных иммуногистологических анализов при COVID-19 является систематический обзор Menezes R.G. et al., содержащий результаты 46 исследований 793 пациентов с новой коронавирусной инфекцией. По данным этого обзора, иммуногистохимические исследования легочной ткани выявили в ней воспалительные клеточные инфильтраты, включавшие CD3, CD4, CD8 и CD45 лимфоциты и CD68 макрофаги в интерстициальном пространстве, альвеолярном пространстве, бронхиолах и кровеносных сосудах у 70 из 194 обследованных пациентов. При исследовании ткани сердечной мышцы иммунологическое окрашивание было выполнено у 93 пациентов, и только у 19 пациентов было обнаружено преобладание CD4 лимфоцитов над CD8 лимфоцитами при меньшем количестве CD3 Т-клеток и еще более редком количестве CD68 макрофагов. В ткани печени окрашивание показало увеличение количества клеток CD68 в печеночных синусоидах, свидетельствующее об активации и пролиферации клеток Купфера. В тканях селезенки не было найдено значительных изменений в распределении и количестве макрофагов CD68, при этом было обнаружено большое количество клеток CD68 в мозговых синусах [15].
Таким образом, результаты большинства исследований указывают на участие макрофагов в патогенезе новой коронавирусной инфекции COVID- 19, которая сопровождается массивным выходом CD68-позитивных клеток из сосудистого русла и общим увеличением количества макрофагальных элементов в тканях, что ведет к возникновению тканеспецифической иммунопатологии [16]. Примечательно, что CD68 положительные макрофаги выявляются и в прижизненных биоптатах, в частности при исследовании слизистой оболочки полости носа у пациентов с измененным на фоне коронавирусной инфекции обонянием [17]. Уникальным результатом нашего исследования является подтверждение макрофагальной инфильтрации головного мозга и кишечника; аналогичных результатов при анализе доступной литературы обнаружено не было.
ЗАКЛЮЧЕНИЕ
Выявлены CD68 положительные макрофаги во всех исследованных органах у больных с новой коронавирусной инфекцией COVID-19, с различной интенсивностью и локализацией инфильтрации. Это может свидетельствовать о едином механизме патогенеза при поражении различных органов у пациентов с этим заболеванием.


