ВВЕДЕНИЕ
Анемия – наиболее распространенное гематологическое заболевание во всем мире. Согласно исследованию Глобального бремени болезней (The Global Burden of Disease, GBD) [1], в 2019 г. было зарегистрировано 1,8 млрд случаев анемии (23 176,2 на 100 тыс. населения). Таким образом, эта патология наблюдалась у 13,4% всего населения планеты. По данным Росстата [2], на 2020 г. заболеваемость анемией в России составляла 1406,8 случая на 100 тыс. населения, при этом 438,9 случая на 100 тыс. были диагностированы впервые.
Частота встречаемости анемии во всем мире зависит от возраста, пола и социально-экономических условий [3]. К группам населения, наиболее предрасположенным к ее развитию, относятся дети в возрасте до 5 лет, женщины репродуктивного возраста, а также лица старше 60 лет [1–3]. Так, у мужчин анемия встречается в 18%, в то время как у женщин – уже в 35% случаев [3, 4]. В возрасте 1–4 лет заболевание выявляется у 43% детей [3, 4]. По некоторым данным, распространенность анемии в России у пожилых людей достигает 23%, при этом у госпитализированных пациентов эта патология диагностируется в 36–80% случаев [5]. В 2010 г. на долю анемии приходилось 68,4 млн лет жизни, прожитых с инвалидностью (англ. disability-adjusted life year – DALY), или 9% от общего глобального бремени инвалидности из-за всех состояний [6]. В связи с высокой заболеваемостью, развитием осложнений, социально-экономическим бременем анемии Всемирная организация здравоохранения (ВОЗ) поставила цель снизить распространенность этой патологии у женщин репродуктивного возраста на 50% к 2025 г. [7].
ПРИЧИНЫ И ЧАСТОТА ВСТРЕЧАЕМОСТИ РАЗЛИЧНЫХ ФОРМ АНЕМИИ
Наиболее частая причина развития анемии – дефицит микроэлементов, в особенности железа. Этот микроэлемент является наиболее распространенным биометаллом, который вовлечен в поддержание биохимических процессов, обеспечивающих нормальный метаболизм организма [8, 9]. В качестве кофактора или составляющей простетических групп (компонентов неаминокислотной природы, прочно соединенных с белком, например, при помощи ковалентной связи, и играющих важную роль в реализации биологической активности соответствующего белка) различных ферментов железо обеспечивает транспорт кислорода и электронов в окислительно-восстановительных реакциях, принимает участие в синтезе дезоксирибонуклеиновых кислот, различных нейротрансмиттеров, белков, отдельных аминокислот, а также в лекарственной детоксикации [8, 9]. Железо не синтезируется в организме человека, и, несмотря на достаточное содержание этого микроэлемента в различных пищевых продуктах, во всем мире основной причиной анемии является именно снижение его содержания в организме.
Дефицит железа может как способствовать развитию анемии, так и выступать в качестве самостоятельной патологии. Под латентным дефицитом железа (ЛДЖ) в таком случае понимают сохранение нормального уровня гемоглобина в пределах референсных значений на фоне уменьшения запасов железа в организме, отражающегося лабораторно в виде снижения уровня ферритина сыворотки менее 40 мкг/л [3]. По данным ВОЗ [10], ЛДЖ встречается у 3,6 млрд человек, а железодефицитная анемия (ЖДА) диагностирована у 2 млрд пациентов во всем мире, т. е. примерно у 30% всего населения земного шара.
В исследовании GBD [1] установлено, что распространенность дефицита железа на 2019 г. составила 14,4%, при этом ЛДЖ являлся независимым фактором 28,5 млн лет, прожитых с инвалидностью. Согласно результатам наблюдательного исследования Philip K.E.J. et al. [11] (n = 4451, возраст старше 50 лет, период наблюдения 14 лет), ЛДЖ был верифицирован у 10,9% женщин (95% доверительный интервал (ДИ): 9,7–12,3%) и у 6,4% мужчин (95% ДИ: 5,3–7,5%). У пациентов с диагностированным ЛДЖ за период наблюдения отмечалось увеличение летальности на 58% (относительный риск (ОР) 1,58; 95% ДИ: 1,29–1,93) [11]. На долю ЖДА приходится примерно 80% всех случаев анемии [12]. ЖДА способствует ухудшению течения сопутствующей патологии, а также выступает независимым предиктором неблагоприятных исходов у пациентов с сердечно-сосудистыми заболеваниями, что подтверждает необходимость своевременной диагностики этого состояния и проведения рациональной фармакотерапии [3].
Еще одной частой причиной развития анемии может служить дефицит витаминов, в особенности B12 и В9 (фолиевой кислоты). Вклад дефицита B12 и фолиевой кислоты в распространенность анемии как во всем мире, так и в России неизвестен. По данным отдельных исследований, в которых статус B12 оценивался по определению витамина B12, гомоцистеина или метилмалоновой кислоты в сыворотке крови, распространенность его дефицита составляла около 5% [13–15]. Результаты проекта Biomarkers Reflecting Inflammation and Nutritional Determinants of Anemia (BRINDA) [15] по оценке уровня витаминов и микроэлементов у женщин репродуктивного возраста продемонстрировали значимое различие в частоте встречаемости дефицита B12 и фолиевой кислоты в зависимости от страны проживания. Так, в Мексике и США распространенность недостаточности этих витаминов не превышала 3%, тогда как в Кот-д’Ивуаре эти показатели приближались к 15 и 80% соответственно. В свою очередь, частота встречаемости дефицита B12 в Колумбии достигала 15%, а недостаточности фолиевой кислоты в Грузии – 80% (!). Как было установлено в исследовании McLean Е. et al. [14], к самым уязвимым группам населения в отношении дефицитов фолатов относятся дети дошкольного возраста (33,8%), беременные женщины (25,5–48,8%) и пожилые люди (15,0%).
Недостаточность и дефицит витамина B12 – серьезная медицинская проблема в мире и в России. Распространенность дефицита B12 среди населения индустриально развитых стран составляет около 20% [16], а среди особых групп пожилых лиц риск развития этого состояния доходит до 56% в возрасте 65–74 лет и до 93% у лиц старше 75 лет [17]. Прием лекарственных средств для снижения кислотности в желудке (ингибиторов протонной помпы, блокаторов гистаминовых Н2-рецепторов, антацидов), часто длительный, значимо снижает всасывание витамина B12, поскольку негативно влияет на процесс его высвобождения из связи с пищевыми белками при поступлении с пищей. Поэтому риск развития недостаточности B12 в этой когорте пациентов достигает 83% [18], а распространенность его дефицита – 29% [19]. В метаанализе 31 исследования авторы показали, что пациенты с сахарным диабетом 2-го типа, принимающие метформин, имеют более высокий риск дефицита витамина B12 и более низкий уровень этого витамина в крови по сравнению с больными, находящимися на другой сахароснижающей терапии [20]. Частота дефицита витамина B12 у данных пациентов может быть весьма высокой – до 50% случаев [21].
Следует обратить внимание на возможность сочетания у пациентов различных дефицитных состояний, требующего комплексного лечения. Имеются лишь единичные данные о распространенности таких патологических состояний, что объясняется трудностью их диагностики из-за отсутствия патогномоничных лабораторных и клинических признаков. К примеру, по результатам исследования Remacha A.F. et al. [22], низкий уровень витамина B12 был обнаружен у 17,8% пациентов с ЖДА. Учитывая значимость данной проблемы, далее будут рассмотрены метаболизм железа и патофизиологические основы развития витамин-B12- и фолиеводефицитных анемий.
МЕТАБОЛИЗМ ЖЕЛЕЗА, ВИТАМИНА В12 И ФОЛИЕВОЙ КИСЛОТЫ
Основное количество железа, содержащегося в организме (около 3–5 г), входит в состав миоглобина и гемоглобина в клетках крови и костного мозга [3, 9, 23]. Большая часть микроэлемента находится в метаболически активной, связанной с белками форме, при этом доля железа в виде свободных ионов практически незначима. Ежедневная потребность в железе для осуществления процессов эритропоэза и биосинтетической функции составляет 20–30 мг, и основной его объем организм получает в ходе рециркуляции высвобожденного из разрушенных эритроцитов железа [23, 24]. За сутки потери, обусловленные в большей степени слущиванием эпителия, соотносятся с количеством железа, поступающего с пищей, и не превышают 1,5–2 мг [23, 24].
Поступающее с пищей железо в основном находится в трехвалентной форме. Для обеспечения доставки в энтероциты двенадцатиперстной кишки (ДПК) микроэлемент при участии ферроредуктазы дуоденального цитохрома В (англ. Duodenal cytochrome B, DcytB), расположенной на апикальной поверхности клеток, подвергается восстановлению до двухвалентного [24–26]. Именно в таком виде с помощью белка-транспортера ионов двухвалентных металлов-1 (Divalent Metal Transporter 1, DMT-1) железо импортируется в энтероцит. Далее абсорбируемый биометалл или депонируется в клетке в составе ферритина, или за счет ферропортина (единственного транспортного белка, экспортирующего ионы двухвалентного железа из энтероцитов, макрофагов, а также гепатоцитов) попадает в кровоток, где происходит уже окисление железа вновь до трехвалентной формы с помощью гефестина, и формируется комплекс Fe3+ с трансферрином [25–27].
Трансферрин является белком, обеспечивающим внеклеточный транспорт железа от места абсорбции, т. е. энтероцитов ДПК, депо, а также мест его высвобождения в результате разрушения эритроцитов (печень, селезенка) к клеткам-мишеням в костном мозге для последующего использования [24–27]. В связи с этим при дефиците железа отмечается повышение концентрации трансферрина или, наоборот, снижение его уровня при перегрузке организма железом.
При лабораторном контроле оценивают также и взаимосвязанные с трансферрином показатели: общую железосвязывающую способность сыворотки (ОЖСС), уровень сывороточного железа, коэффициент насыщения трансферрина железом (НТЖ). Следует отметить, что показатель сывороточного железа отражает уровень транспортируемого железа, связанного не только с трансферрином, но и другими белками. ОЖСС дает представление о резервном объеме трансферрина, на данный момент не используемом для транспорта железа. НТЖ представляет собой расчетное соотношение этих показателей [28].
Ферритин – внутриклеточный белок, который содержится в клетках ретикулоэндотелиальной системы, печени, а также костного мозга. Он обеспечивает депонирование и высвобождение железа по мере необходимости, в связи с чем его уровень в плазме крови коррелирует с запасами железа в организме в физиологических условиях [25–26]. Будучи острофазовым белком, ферритин значимо повышается при наличии в организме воспалительного или опухолевого очага.
В качестве регулятора метаболизма железа выступает гепсидин – пептид, образующийся в печени [29–31]. Его действие основано на принципе отрицательной обратной связи. В условиях избыточного содержания железа в организме гепсидин способствует снижению всасывания микроэлемента в кишечнике за счет ингибирования экспрессии транспортного белка DMT-1, препятствует функционированию ферропортина путем присоединения к этому белку и последующего поступления внутрь клетки, где осуществляется разрушение образованного комплекса в лизосомах [29–31]. В результате этого происходит блокировка высвобождения и попадания железа в кровь и соответственно его накопление внутри энтероцитов, которые впоследствии удаляются за счет слущивания. И, напротив, в условиях сидеропении железо тут же высвобождается в кровоток и циркулирует в составе трансферрина [29–31].
В виде молекул трансферрина железо доставляется к основным клеткам-мишеням: в клетки костного мозга, в гепатоциты для создания депо в составе ферритина и другие, имеющие рецепторы к трасферрину. В кровотоке железо циркулирует в течение времени, не превышающего период жизни эритроцитов (не более 120 дней), которые под действием клеток макрофагальной системы подвергаются разрушению. Высвобожденное железо повторно окисляется церулоплазмином с образованием трехвалентной формы и в составе трансферрина экспортируется к клеткам-мишеням [23, 24].
Отдельно упомянем, что гепсидин также является острофазовым белком, и при хроническом воспалительном процессе в организме происходит его избыточная секреция под влиянием интерлейкина 6 (ИЛ-6), фактора некроза опухоли-альфа (ФНО-α) и других цитокинов [29, 30]. Этот механизм лежит в основе развития анемии хронических заболеваний (АХЗ).
Немаловажное значение в проведении рациональной фармакотерапии анемии и дефицитных состояний имеет понимание патофизиологических процессов метаболизма витамина В12 и фолиевой кислоты.
Абсорбция витамина B12 или кобаламина проходит в несколько этапов. В желудке благодаря действию соляной кислоты происходит высвобождение кобаламина и дальнейшее его связывание с транспортным белком слюны гаптокоррином [32–35]. В виде такой молекулы кобаламин поступает в ДПК, где витамин B12 соединяется с внутренним фактором Кастла – еще одним транспортным белком, синтезируемым париетальными клетками желудка. В подвздошной кишке образованный двухмолекулярный комплекс благодаря рецептору кубилину импортируется в энтероциты, откуда в дальнейшем за счет активного транспорта попадает в кровь [31–35]. В плазме кобаламин соединяется с транскобаламином, функциональным аналогом трансферрина, и транспортируется к клеткам-мишеням или образует депо в печени [34, 35].
Аналогичным образом происходит метаболизм фолиевой кислоты. Поступление фолатов в энтероциты обеспечивается специальными трансмембранными транспортерами фолиевой кислоты [36–37]. Образующийся в энтероцитах метаболит N5-метилтетрагидрофолат, экспортируясь в кровь, в дальнейшем свободно циркулирует в плазме или запасается в печени [36–37].
КЛАССИФИКАЦИЯ ДЕФИЦИТА ЖЕЛЕЗА
На основе описанных выше механизмов регуляции обмена железа выделяют 3 вида нарушений его метаболизма [28, 38]:
- абсолютный дефицит железа (АДЖ), характеризующийся снижением запасов железа в организме и проявляющийся уменьшением концентрации ферритина в плазме крови;
- перераспределительный (функциональный) дефицит железа, обусловленный наличием нормальных запасов железа на фоне железодефицитного эритропоэза;
- перегрузка железом.
Исходя из этого, можно дать такую характеристику дефицитным состояниям: ЛДЖ представляет собой абсолютный дефицит железа без развития анемии, ЖДА характеризуется сочетанием абсолютного дефицита железа с анемией, а АХЗ обусловлена функциональным дефицитом железа на фоне анемии [28–30].
Некоторыми авторами предложена следующая классификация АДЖ [38].
1. Прелатентный дефицит железа развивается на фоне повышенной потребности железа. Лабораторно он проявляется низким уровнем ферритина на фоне нормальных показателей гемоглобина и сывороточного железа.
2. ЛДЖ вызван сохраняющимся высоким расходом железа, истощением его депо. В анализах крови наблюдается снижение сывороточного железа, НТЖ, в то время как уровень гемоглобина в пределах нормы.
3. ЖДА – исчерпание запасного и транспортного пула железа, в результате чего нарушается эритропоэз, приводящий к снижению гемоглобина.
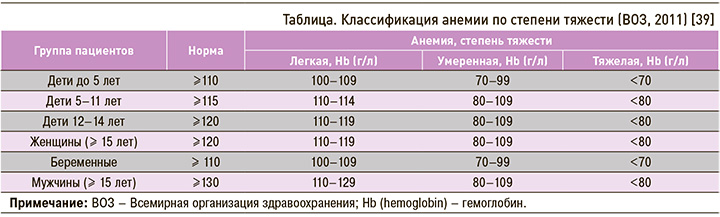
Подчеркнем, что в действующих клинических рекомендациях Минздрава России по ведению пациентов с ЖДА [3] нет классификации этого заболевания по степени тяжести. В связи с этим в клинической практике применяют классификацию анемии, предложенную ВОЗ в 2011 г. (табл.) [39].
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ДЕФИЦИТА ЖЕЛЕЗА
Клинические проявления дефицита железа, которые чаще всего встречаются при наличии анемии, включают сочетание гипоксического и сидеропенического синдромов. Первый проявляется в виде бледности кожных покровов и видимых слизистых оболочек, плохой переносимости физических нагрузок, усиленного сердцебиения, шума в ушах, головной боли и слабости. Эти симптомы неспецифичны и характерны для любой анемии [3, 40, 41].
К проявлениям сидеропенического синдрома, который обусловлен снижением активности ферментов, содержащих железо, относят сухость кожи, изменение ногтей, выпадение волос, ангулярный стоматит, жжение языка. У пациента может присутствовать извращенное обоняние (пристрастие к резким запахам лака, красок, ацетона, бензина) и вкус (пристрастие к мелу, песку, глине, сырым продуктам), кроме того, дефицит железа сопряжен с поражением желудочно-кишечного тракта (ЖКТ) в виде хронического гастрита и синдрома нарушения всасывания в кишечнике, что обусловливает возникновение различных диспепсических симптомов [3]. Такое многообразие клинических проявлений дефицита железа объясняется широким спектром метаболических нарушений, к которым приводит дисфункция железосодержащих и железозависимых ферментов [3].
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ДЕФИЦИТА ВИТАМИНА В12
Клинические проявления раннего, не выраженного дефицита В12 неспецифичны: раньше и чаще других среди них наблюдаются неврологические расстройства, существенно опережающие гематологические или иные изменения. В основе клинической картины тяжелого дефицита витамина B12 3 синдрома: гипоксический (характерный для всех анемий), поражение нервной системы и ЖКТ. Этот дефицит проявляется постепенно с нарастанием общей слабости, быстрой утомляемостью, одышкой и сонливостью [40].
В результате повышенного разрушения эритроидных клеток (неэффективный эритропоэз) могут выявляться субиктеричность склер, желтушность кожи и увеличение печени.
Патология ЖКТ нередко сопровождается потерей аппетита и диспепсией, вызывающими уменьшение веса, Гунтеровским (Хантеровским) глосситом, снижением желудочной секреции и развитием атрофического гастрита [40].
Вследствие поражения периферической нервной системы происходит дегенерация спинного мозга, которой сопутствуют слабость в ногах и парестезии, мигрирующие боли, «онемение» конечностей и постепенная утрата чувствительности пальцев рук. В ряде случаев неврологическая симптоматика возникает изолированно без развития других клинических проявлений. Особенно часто такая картина встречается у пациентов старшей возрастной группы, поэтому необходимо исключить дефицит витамина B12 у больных с неврологической симптоматикой неизвестного генеза [40].
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ДЕФИЦИТА ФОЛИЕВОЙ КИСЛОТЫ
Клинические проявления дефицита фолиевой кислоты во многом схожи с симптоматикой при В12-дефицитной анемии, но обычно менее выражены. В отличие от В12-дефицита, для фолиеводефицитной анемии (ФДА) не характерно поражение нервной системы (исключение составляют пациенты с алкоголизмом и эпилепсией, имеющие неврологическую симптоматику по другой причине) [41]. Также могут наблюдаться ангулярный стоматит, глоссит и диспепсические расстройства (тошнота, рвота, боли в животе, диарея). Возможна легкая желтушность кожи и склер, обусловленная неэффективным эритропоэзом в костном мозге и вследствие этого повышенным разрушением гемоглобинсодержащих клеток, что приводит к повышению в крови уровня непрямого билирубина. При тяжелых формах ФДА может отмечаться небольшое увеличение селезенки (реактивная гиперплазия); в этом случае требуется дифференциальная диагностика ФДА с гемолитической анемией [41].
ПОДХОДЫ К ДИАГНОСТИКЕ И ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКЕ АНЕМИИ
Для выявления и подтверждения диагноза анемии любого генеза необходимо комплексно оценивать клиническую картину, анамнез заболевания, а также изменения лабораторных показателей [3, 42]. Всем пациентам рекомендуется проводить лабораторное дообследование в следующем объеме:
- общий анализ крови с оценкой количества эритроцитов, содержания ретикулоцитов, показателей гематокрита и эритроцитарных индексов (MCH – среднего содержания гемоглобина в эритроците, MCV – среднего объема эритроцитов, MCHC – средней концентрации гемоглобина в эритроците), а также исследование морфологии и концентрации нейтрофилов и тромбоцитов для определения уровня цветового показателя, регенераторной функции костного мозга, типа кроветворения и соответственно характера анемии;
- оценка показателей метаболизма железа – концентрации сывороточного железа, трансферрина, ферритина, ОЖСС и НТЖ [3, 42].
При этом следует помнить, что упомянутые биомаркеры необходимо исследовать только совместно с показателями биохимической активности печени и почек, такими как лактатдегидрогеназа (ЛДГ), аспартатаминотрансфераза (АСТ), аланинаминотрансфераза (АЛТ), гамма-глутамилтрансфераза, щелочная фосфатаза, всеми фракциями билирубина (общего, прямого и непрямого), альбумином, креатинином, мочевиной. Это связано с тем, что большая часть маркеров железа синтезируется в печени, при нарушении функций которой низкие показатели трансферрина и ферритина будут ассоциированы с недостаточностью белково-синтетической активности гепатоцитов. Вместе с тем некоторые виды анемий, в частности мегалобластная при наличии дефицита витаминов В12 и В9, сопровождаются повышением ферментов печени (ЛДГ, всех фракций билирубина) [3, 40, 42].
Для исключения анемии, вызванной дефицитом фолиевой кислоты или витамина В12, выполняют оценку их концентрации в сыворотке крови. Также рекомендуется определять уровень голотранскобаламина, снижаемый при В12-дефицитной анемии, и проводить прямой антиглобулиновый тест (прямая проба Кумбса) в целях исключения аутоиммунной гемолитической анемии [40, 41].
Рутинная пункция костного мозга с цитологическим исследованием для диагностики анемий на фоне дефицитных состояний не рекомендована. Рассмотреть выполнение этой процедуры следует при выявлении глубокой макроцитарной анемии неясного генеза [3, 41].
Для получения достоверных результатов при оценке маркеров метаболизма железа забор материала следует проводить строго натощак, утром, не ранее чем через 1–2 нед. после окончания курса ферротерапии или гемотрансфузий. Необходимо исключить наличие островоспалительных заболеваний, на фоне которых многие регуляторные белки обмена железа значительно повышаются.
К характерным признакам ЖДА относятся низкие показатели эритроцитов, гемоглобина, гематокрита, эритроцитарных индексов (MCH, MCHC, MCV), что соответствует гипохромной микроцитарной норморегенераторной анемии. Отмечаются пониженный уровень ферритина, отражающий истощение депо железа, высокие концентрации ОЖСС и трансферрина. Показатели сывороточного железа и НТЖ, как правило, снижены, однако их концентрации сильно зависят от принятой пищи, проведения ферротерапии в анамнезе, а потому их нормальный уровень не исключает диагноз ЖДА [3, 42].
Ключевой момент для верификации ЖДА – дифференциальная диагностика и исключение функционального дефицита железа на фоне АХЗ. Последняя сопровождается повышением показателя ферритина как острофазового белка, небольшим уменьшением или сохранением в пределах референсных интервалов уровней ОЖСС и трансферрина [3, 42].
B12-дефицитная анемия и ФДА представляют собой макроцитарные гиперхромные анемии, для которых характерны снижение гемоглобина на фоне повышения эритроцитарных индексов MCH и MCV (MCHC, как правило, находится в пределах нормы), анизопойкилоцитоз. К другим особенностям этих анемий относят выявление базофильной пунктации эритроцитов, телец Жолли и колец Кебота в эритроцитах. Частым их признаком является присутствие нейтрофилов с гиперсегментацией ядер, обычно на фоне нейтропении, тромбоцитопении. В биохимическом анализе выявляются высокий уровень ЛДГ, гипербилирубинемия и соответственно низкий уровень витамина B12 или фолиевой кислоты [40, 41].
ПОДХОДЫ К ТЕРАПИИ ДЕФИЦИТА ЖЕЛЕЗА И ЖЕЛЕЗОДЕФИЦИТНОЙ АНЕМИИ
Согласно российским клиническим рекомендациям «Железодефицитная анемия» (2021) [3], цель лечения ЖДА – введение железа в количестве, необходимом для нормализации уровня гемоглобина (у женщин 120–140 г/л, у мужчин 130–160 г/л) и восполнения тканевых запасов железа (ферритин сыворотки > 40–60 мкг/л). Во всем мире пероральные препараты железа рассматриваются как первая линия и стандарт терапии для профилактики и лечения анемии. На сегодняшний день на фармацевтическом рынке доступны многочисленные формы лекарственных препаратов железа, имеющие различный количественный и качественный состав: высоко- и низкодозированные, односоставные и комбинированные.
Соли двухвалентного железа (сульфат железа, фумарат железа и глюконат железа) являются наиболее распространенными и широко используемыми пероральными препаратами железа во всем мире [43]. Например, в 2012 г. в Англии было выписано 6,8 млн рецептов на препараты железа для перорального применения, при этом в более чем 97% случаев это были соли Fe2+ [44]. Препараты, содержащие двухвалентное железо, считают более предпочтительными в сравнении с трехвалентными формами (Fe3+) в связи с тем, что последние характеризуются меньшей биодоступностью и плохим растворением в щелочных средах [43]. В то же время именно средства, содержащие соли Fe2+, ассоциируются с развитием многих побочных эффектов, обычно приписываемых пероральным препаратам железа, включая металлический привкус во рту и различные желудочно-кишечные расстройства. Во многом из-за неблагоприятных явлений, связанных с приемом этих препаратов, большинство пациентов не соблюдает рекомендованные схемы дозирования [44, 45]. Согласно результатам систематического обзора [44], среди желудочно-кишечных нежелательных реакций на пероральные препараты железа наиболее частыми являются запор, тошнота и диарея. Это, как уже отмечено, может отрицательно сказываться на приверженности пациентов к лечению, вплоть до отказа от терапии, и, как следствие, приводить к неадекватному терапевтическому эффекту [46].
В соответствии с рекомендациями ВОЗ оптимальная доза железа для лечения ЖДА составляет 120 мг/ сут., для профилактики железодефицита – 60 мг/сут. [3]. При этом на сегодняшний день нет единого мнения относительно идеальной стратегии дозирования препаратов железа. Необходимо добавить, что во многих препаратах указывается доза как общего железа (неэлементное + элементарное железо), так и элементарного (например, стандартные препараты сульфата железа часто содержат 325 мг общего железа и 65 мг элементарного железа), и при выборе дозировки лекарственного средства важно учитывать именно дозу элементарного железа.
В настоящее время накапливаются доказательства того, что низкодозированные препараты железа, применяемые короткими курсами (2 нед. в месяц) или в альтернативном режиме (через день в течение месяца), имеют более высокую эффективность и меньшую частоту побочных эффектов, чем применявшиеся ранее высокодозированные препараты, в том числе в виде повторных (2–3 раза в день) приемов [47–49]. Сообщалось, что от 30 до 60 мг элементарного железа оказывают такое же действие на показатели крови, как и двойная доза. Эти эффекты в первую очередь обусловлены гепсидином, содержание которого возрастает с увеличением дозы перорального препарата железа [50]. После приема таблетки железа уровень гепсидина повышается, а всасывание железа снижается. Концентрация гепсидина достигает пика на отметке 8 ч, остается повышенным до 24 ч и возвращается к норме примерно через 48 ч, что подтверждает парадигму «альтернативного дня» [48]. Уровень гепсидина в плазме подчиняется циркадному ритму и обычно возрастает в течение дня, поэтому пероральные препараты железа лучше всего назначать однократно утром [50]. Дозы, превышающие 60–120 мг элементарного железа в день или через день, вряд ли принесут значительную пользу с точки зрения восполнения запасов железа, но зато с большей долей вероятности вызовут побочные реакции [50].
Обоснование схемы дозирования препаратов железа в режиме через день базируется на результатах недавних проспективных клинических исследований, которые продемонстрировали, что такой порядок приема лекарственных средств минимизирует экспрессию гепсидина и увеличивает фракционную абсорбцию железа [49, 51]. Несмотря на это, общее количество абсорбируемого железа при использовании через день немного ниже, чем при ежедневном приеме (например, прогнозируется, что кумулятивная общая абсорбция железа в этих случаях составит соответственно 261 и 175 мг через 28 дней). Таким образом, ежедневный прием препаратов железа следует рассматривать у пациентов с отсутствием нежелательных лекарственных реакций (НЛР) или слабо выраженными НЛР [49]. В рандомизированном исследовании [52], где пожилым пациентам с ЖДА назначались 15, 50 или 150 мг элементарного железа в сутки, через 2 мес. среднее повышение уровня гемоглобина оказалось одинаковым во всех группах (1,4 г/дл). Однако НЛР статистически значимо чаще встречались при применении более высоких доз (150 мг/ cут.): дискомфорт в животе наблюдался в 70% (р < 0,05 между этой группой и группой больных, получавших 15 мг железа), тошнота/рвота – в 67% (в группе 15 мг – 13%, в группе 50 мг – 36%; р < 0,05), запор – в 23% случаев (0% на фоне приема 15 мг, 10% в группе 50 мг; р < 0,05). Кроме того, у 67% пациентов, получавших 150 мг железа в сутки, имел место черный стул (в группе 15 мг эта НЛР не отмечалась, а в группе 50 мг была зафиксирована в 30% случаев; р < 0,05) [52].
Предполагается, что витамин С создает более кислую среду в желудке и предотвращает окисление двухвалентного железа в трехвалентное и уже давно рекламируется как средство для улучшения восполнения запасов железа при пероральном приеме препаратов [53]. Имеются также данные, позволяющие предположить, что аскорбиновая кислота нейтрализует негативные эффекты некоторых ингибиторов всасывания железа, включая соли фитиновой кислоты, полифенолы и кальций [54]. Так, в 2023 г. были опубликованы результаты исследования [49], в котором авторы оценили влияние диетических факторов и времени суток на всасывание железа из пероральных добавок у 34 женщин с ЖДА. Участники исследования применяли 3 различных изотопа железа (54Fe, 57Fe или 58Fe) в дозе 100 мг, каждое в 6 различных условиях: «(1) прием с водой утром; (2) с 80 мг аскорбиновой кислоты; (3) с 500 мг аскорбиновой кислоты; (4) с кофе; (5) на завтрак, включающий кофе и апельсиновый сок (содержащий 90 мг витамина C); и (6) с водой во второй половине дня». Впоследствии рассчитывалось фракционное поглощение железа. Исследование показало, что употребление добавок железа утром с апельсиновым соком привело примерно к 4-кратному увеличению его абсорбции по сравнению с приемом железосодержащих добавок с кофе или во время завтрака. Они пришли к выводу, что максимальная эффективность пероральных добавок двухвалентного железа наблюдалась, когда они принимались утром, отдельно от еды или кофе, и предпочтительно с пищей или напитком, богатым аскорбиновой кислотой [55].
Назначение комбинированных препаратов железа в сочетании с фолиевой кислотой является патогенетически обоснованным, так как часто наблюдается одновременный дефицит этих соединений, особенно у беременных и женщин молодого возраста [56]. Недостаток фолатов прочно ассоциирован с гипергомоцистеинемией, при которой отмечается снижение концентраций метионина и S-аденозилметионина, что оказывает токсическое действие на нервную систему и вызывает развитие неврологических нарушений [57–61]. Вследствие описанных патологических процессов гипергомоцистеинемия служит индикатором и ассоциируется с более высоким риском выкидыша и возникновения таких осложнений беременности, как эклампсия, преждевременная отслойка плаценты, повышение вероятности развития гестационного сахарного диабета [62]. В связи с этим в 2018 г. ВОЗ [63] рекомендовала беременным ежедневный пероральный прием железа и фолиевой кислоты для предотвращения анемии и различных нарушений развития плода. Кроме того, комбинация железа и фолиевой кислоты может быть полезной по соображениям безопасности, особенно в случае длительного приема железосодержащих добавок, поскольку фолиевая кислота может подавлять перегрузку железом печени и уменьшать ее вредное воздействие [64].
Таким образом, учитывая, что прием более высоких доз перорального железа может быть сопряжен с уменьшением ответа на терапию из-за индукции экспрессии гепсидина и усилением побочных эффектов со стороны ЖКТ, пероральное введение железа должно быть ограничено одной дозой, вводимой ежедневно или через день. Примером современного лекарственного низкодозированного средства с Fe2+ является комбинированный препарат Ферро-Фольгамма Нео®: одна его таблетка содержит 114 мг железа сульфата (что эквивалентно 36,77 мг железа), 0,8 мг фолиевой кислоты, а также вспомогательные компоненты (витамин С), улучшающие усвояемость железа. Препарат характеризуется послойным высвобождением действующих веществ: за счет наличия в лекарственной форме кишечнорастворимого слоя Fe2+ высвобождается непосредственно в ДПК, где происходит его всасывание, что позволяет минимизировать риск развития нежелательных реакций [65]. Эффективность и безопасность данного препарата изучались в проспективном наблюдательном исследовании с участием 28 женщин с ЖДА и дефицитом железа (срок наблюдения 2 мес.). В результате терапии комбинированным препаратом двухвалентного железа и фолиевой кислоты в лекарственной форме с послойным высвобождением действующих веществ у пациенток были восстановлены показатели клинического анализа крови, восполнено депо железа и купированы субъективные жалобы. При этом отмечалась хорошая переносимость исследуемого лекарственного средства, обеспечившая высокую приверженность лечению: так, в ходе исследования ни одна пациентка не прекратила прием препарата [66].
ПОДХОДЫ К ТЕРАПИИ B12-ДЕФИЦИТНЫХ СОСТОЯНИЙ
В действующих российских клинических рекомендациях «Витамин-B12-дефицитная анемия» в качестве терапии и профилактики В12-дефицитных состояний рассматривается только применение внутримышечных инъекций витамина В12. В зависимости от тяжести симптомов суточные дозировки заместительной терапии цианокобаламином варьируют от 100 до 500 мкг [40].
Вместе с тем существуют и альтернативные способы введения препарата, среди которых пероральный прием витамина В12. Отметим, что в различных странах именно такой способ его применения рассматривается в качестве первого выбора для лечения В12-дефицитных состояний [67]. Так, в Швеции и Канаде на долю пероральных форм В12 приходится 70–73% от всех назначений витамина [67]. Приоритетность перорального введения витамина В12 прежде всего обусловлена тем, что использование инъекционных форм в большей степени сопряжено с развитием аллергических реакций, а также различных нежелательных явлений в месте введения (включая внутримышечные гематомы), что способствует ухудшению качества жизни пациентов и снижению их приверженности к лечению [67–69]. Это особенно важно, когда заместительную терапию витамином В12 необходимо проводить пожизненно, например, при пернициозной анемии или необратимых заболеваниях пищеварительного тракта.
На сегодняшний день доступно множество исследований и метаанализов, доказывающих эффективность и безопасность приема пероральных препаратов у лиц с дефицитом витамина В12, в том числе в сравнении с парентеральной формой [70–79].
Так, в метаанализе 2024 г. [80], в который были включены 13 исследований с участием в общей сложности 4275 пациентов, было продемонстрировано отсутствие статистически значимых различий в достижении целевых значений гемоглобина при пероральном и внутримышечном введении витамина В12. В двух разных исследованиях Andres Е. et al. [81, 82] показана эффективность перорального приема В12 в отношении снижения как биохимических, так и клинических признаков дефицита кобаламина [81, 82]. После ежедневного приема 2000 мкг перорального цианокобаламина было зафиксировано устойчивое повышение уровня кобаламина в сыворотке крови, причем через 4 мес. наблюдения его уровни в сыворотке крови были даже выше по сравнению с теми, которые регистрировались в ответ на парентеральную терапию [70]. Кроме того, у сопоставимого процента участников в обеих группах отмечался регресс таких неврологических симптомов, как двусторонняя парестезия и нарушение координации [72, 74, 83]. В исследованиях продемонстрировано, что самая низкая эффективная доза перорального цианокобаламина, необходимая для коррекции умеренного дефицита витамина В12 у пожилых людей, более чем в 200 раз превышает рекомендуемую диетическую норму (3 мкг/сут.) и составляет от 647 до 1032 мкг [84]. Следовательно, рекомендуемая суточная доза перорального цианокобаламина должна быть не менее 1000 мкг; благодаря такой повышенной дозировке препарата за счет диффузного механизма абсорбции достигаются достаточные концентрации кобаламина в крови, в том числе у пациентов с нарушениями его всасывания различной этиологии (вследствие дефицита внутреннего фактора Кастла, атрофического гастрита, хирургических вмешательств, приема антисекреторных средств и др.) [83–87]. Различные экспертные сообщества, такие как Американская ассоциация клинических эндокринологов (American Association of Clinical Endocrinologists), Общество ожирения (Obesity Society), Американское общество метаболической и бариатрической хирургии (American Society for Metabolic & Bariatric Surgery), рекомендуют применение витамина В12 в дозе 1000 мкг/сут. с профилактической целью всем пациентам, перенесшим бариатрическую операцию с целью уменьшения массы тела [86].
В настоящее время также изучается эффективность и безопасность сублингвального использования витамина В12, однако пока доказательные данные о соответствующей лекарственной форме крайне ограниченны [88–90].
Таким образом, высокодозные пероральные препараты цианокобаламина могут служить эффективной, безопасной и более удобной для длительной терапии альтернативой инъекционным формам витамина В12. На данный момент на российском рынке для лечения В12-дефицитных состояний представлен таблетированный препарат В12 Анкерманн® (дозировка – 1 мг цианокобаламина), отвечающий необходимым требованиям к высокодозным пероральным препаратам витамина В12.
ЗАКЛЮЧЕНИЕ
Анемия является широко распространенным заболеванием во всем мире, самой частой причиной ее развития служит дефицит микроэлементов и витаминов, таких как железо, фолиевая кислота и витамин B12. В арсенале врача присутствует множество различных составов и лекарственных форм для лечения анемии, выбор которых должен быть основан на эффективности и безопасности назначаемых препаратов. Так, при терапии железодефицитных состояний целесообразно использовать низкие дозы препаратов железа для безопасной и в то же время эффективной коррекции дефицита железа. При этом приоритет необходимо отдавать лекарственным средствам, содержащим дополнительные компоненты, улучшающие усвояемость железа. Привычная же инъекционная коррекция B12-дефицитных состояний может быть заменена на прием высокодозного перорального препарата цианокобаламина, который не только не уступает парентеральным формам в эффективности, но и характеризуется меньшим риском аллергических реакций.


