ВВЕДЕНИЕ
Мигрень – вторая среди ведущих глобальных причин нетрудоспособности в мире: этой формой головной боли (ГБ) страдает более 1 млрд человек, на ее долю приходится более 5% от количества лет, прожитых с нетрудоспособностью [1]. Являясь самостоятельным заболеванием (первичная ГБ), мигрень связана с генетически обусловленными реакциями организма на молекулярном уровне. Для постановки соответствующего диагноза требуется соблюдение следующих критериев Международной классификации головной боли 3-го пересмотра (МКГБ-3) [2].
A. По меньшей мере 5 приступов, отвечающих критериям B–D.
B. Продолжительность приступов 4–72 ч (без лечения или при неэффективном лечении).
C. ГБ имеет как минимум 2 из 4 следующих характеристик:
- односторонняя локализация;
- пульсирующий характер;
- умеренная или высокая интенсивность;
- ухудшается при обычной физической активности или заставляет пациента избегать обычной физической активности (например, ходьбы или подъема по лестнице).
D. ГБ сопровождается как минимум одним из следующих симптомов:
- тошнотой и/или рвотой;
- фотофобией и фонофобией.
E. Не соответствует другому диагнозу МКГБ-3.
Отметим, что для верификации мигрени не требуется проведения никаких дополнительных лабораторных или инструментальных методов обследования, так как ни в одном из них не могут быть отражены биохимические аспекты, лежащие в основе патогенеза этого заболевания.
В клинической практике в зависимости от частоты приступов выделяют 2 формы мигрени:
- эпизодическую (ЭМ), сопровождающуюся приступами < 15 дней в месяц;
- хроническую (ХМ), которая характеризуется как ГБ, возникающая в течение ≥ 15 дней в месяц на протяжении более 3 мес. и имеющая признаки мигренозной головной боли по крайней мере в течение 8 дней в месяц [2].
Однако граница между этими формами условна и в последние годы подвергается критике, поскольку не отражает полноценно тяжесть заболевания и потребность в лечении [3]. В исследовании Zamparella C.T. et al. [4], в котором принимали участие 111 пациентов с мигренью, добровольцев после проведения комплекса тестов для оценки нейропсихологического профиля (шкалы оценки когнитивных функций, депрессии, тревоги, стресса, влияния ГБ на качество жизни) распределили на 2 кластера в зависимости от выраженности симптомов. Несмотря на выраженные различия по этому критерию, соотношение пациентов с ЭМ и ХМ в кластерах статистически не отличалось, более того, между лицами с ЭМ и ХМ не было выявлено различий по нейропсихологическим показателям. В то же время в множественных исследованиях, проводившихся ранее, было показано выраженное влияние мигрени на социальное и личное благополучие пациентов, при этом тяжесть имеющихся последствий напрямую коррелировала с частотой ГБ и была наиболее выражена у пациентов с ХМ [5].
Формальность разделения мигрени на эпизодическую и хроническую с помощью пограничной отметки в 15 дней в последнее время принято преодолевать путем выделения эпизодической мигрени высокой частоты (ЭМВЧ), которая регистрируется при частоте приступов ГБ более 9–10 дней в месяц. По таким клиническим параметрам, как качество жизни, нетрудоспособность, депрессия, тревога, уровень центральной сенситизации, пациенты с ЭМВЧ существенно отличаются от тех, кто страдает ЭМ, но не имеют существенных отличий от больных с ХМ [6, 7]. В связи с этим были пересмотрены показания к назначению таргетной профилактической терапии мигрени.
Большое значение для клинической практики имеют результаты исследования Lipton R.B. et al. [8], в котором рассматривался риск прогрессирования ЭМ в ХМ в зависимости от сопутствующих патологий. В нем было установлено, что наличие ≥ 1 коморбидного соматического или психического заболевания повышает риск прогрессирования мигрени: чем больше таких заболеваний, тем выше этот риск. Большинство коморбидных заболеваний увеличивает вероятность хронизации мигрени более чем в 5 раз (отношение рисков 5,34). Состояниями, в наибольшей степени повышающими данную угрозу, оказались тревога, депрессия, боль в шее, синусит, инсомния, хроническая боль в спине, аллергия и бронхит.
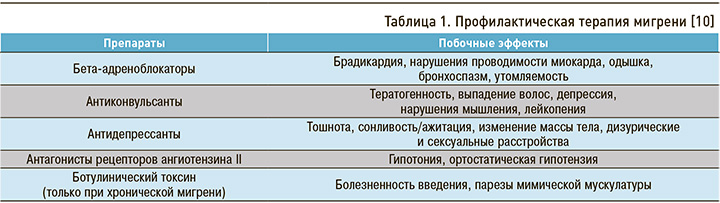
Важный вопрос клинической практики – своевременное лечение как уже развившейся ХМ, так и ЭМ для улучшения качества жизни пациентов и предотвращения усугубления течения ГБ. Одной из глобальных проблем в течение многих лет остается рациональный подбор профилактической терапии мигрени. Таблетированные препараты, одобренные для применения с этой целью, являются неспецифичными и используются по основным показаниям при иных заболеваниях: речь о бета-адреноблокаторах, антиконвульсантах, антидепрессантах и др. Многие из них обладают плохой переносимостью (табл. 1), что определяет низкую приверженность пациентов к профилактической терапии – более 80% из них прекращают прием этих лекарственных средств в течение года [9].
Моноклональные антитела к кальцитонин-ген родственному пептиду (CGRP) или его рецептору (анти-CGRP мАТ) стали первым средством таргетной терапией мигрени. Механизм действия анти-CGRP мАТ основан на периферической блокаде эффектов CGRP посредством антагонизма к рецептору CGRP (эренумаб) либо путем связывания лиганда кальцитонин-ген родственного пептида (фреманезумаб, эптинезумаб, галканезумаб). Как показывают исследования, CGRP опосредует тригеминоваскулярный путь передачи болевых импульсов и способствует поддержанию вазодилятации, которая возникает в процессе нейрогенного воспаления, лежащего в основе патогенеза мигренозного приступа [11]. Первые мАТ были одобрены к применению в США и Европе в 2018 г., в России препараты этой группы (эренумаб, фреманезумаб) используются с осени 2020 г. Назначение анти-CGRP мАТ возможно, если у пациента отмечается 4 и более дня с мигренью в месяц, что позволяет применять такое лечение как при ЭМ, так и при ХМ.
Цель исследования – определить эффективность и безопасность эренумаба в реальной клинической практике у пациентов с ЭМ и ХМ.
МАТЕРИАЛ И МЕТОДЫ
В исследование были включены 76 пациентов с мигренью, проходящих лечение в Клинике головной боли и вегетативных расстройств им. академика А. Вейна.
Критерии включения: диагноз ЭМ и ХМ согласно МКГБ-3 [2], возраст старше 18 лет, подписанное информированное добровольное согласие на участие в исследовании.
Критерии невключения: соматические, неврологические и психические заболевания в стадии декомпенсации, беременность и лактация. Исключение пациентов из исследования происходило в случае отказа от дальнейшего участия, потери пациента для наблюдения и декомпенсации сопутствующих расстройств. Допускалось применение иной профилактической терапии мигрени при условии отсутствия ее изменений в течение курса лечения, а также лекарственных средств по иным медицинским показаниям. Кроме этого, допускалось наличие такого состояния, как избыточное употребление анальгетических средств, которое диагностируется при использовании простых анальгетиков с частотой ≥ 15 дней в месяц в течение как минимум 3 мес. либо в случае приема триптанов или комбинированных анальгетиков ≥ 10 дней в месяц на протяжении как минимум 3 мес. [2]. В связи с этим отметим, что рекомендации экспертов свидетельствуют об отсутствии влияния избыточного употребления анальгетиков на эффективность терапии анти-CGRP мАТ [12].
На исходном визите выполнялись сбор жалоб и анамнеза, анализ сопутствующих заболеваний и болевых синдромов, общий и неврологический осмотр, оценка частоты ГБ, применения анальгетических средств и интенсивности боли по визуально-аналоговой шкале (ВАШ). Наряду с этим пациентам предлагалось самостоятельно заполнить следующие опросники: шкалу депрессии Бека, опросник для оценки тревоги ГТР-7, опросник влияния ГБ на качество жизни HIT-6, опросник качества сна PSQI.
Участникам исследования ежемесячно подкожно вводился эренумаб в дозировке 70 мг, проводилось клиническое интервью с оценкой дневника ГБ и заполнением опросников. Динамика показателей оценивалась через 3 мес. после начала лечения, поскольку, согласно рекомендациям экспертов, именно этот срок является необходимым и достаточным для оценки эффективности терапии анти-CGRP мАТ и решения вопроса о продолжении курса. Что касается срока дальнейшей терапии, то при ЭМ редкой частоты он может составлять 6–12 мес., при ЭМВЧ и ХМ – 12–18 мес. и более в случае клинической необходимости [12].
Статистический анализ данных и построение графиков осуществлялись при помощи программы Microsoft Excel 2016 и онлайн-программ Statistics Kingdom, Social Science Statistics и SRPlot. Различия показателей считались статистически значимыми при достижении p < 0,05 (для их обозначения был принят символ *).
РЕЗУЛЬТАТЫ
Клинические и демографические характеристики пациентов
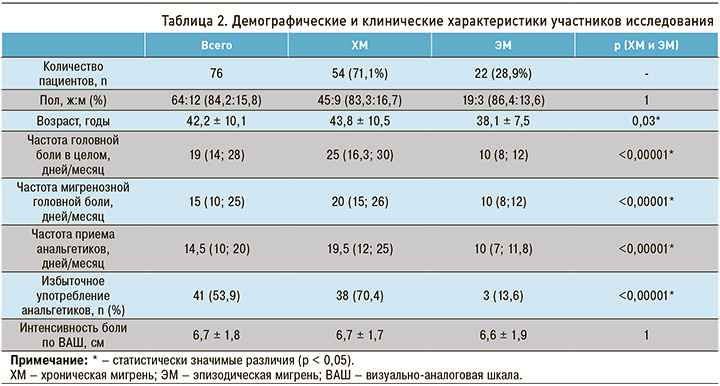
Среди 76 пациентов (возраст от 20 до 64 лет), вошедших в исследование, было 64 (84,2%) женщины и 12 (15,8%) мужчин. Диагноз ХМ был выставлен 54 участникам (71,1%), ЭМ – 22 (28,9%); среди последних у 14 человек отмечалась ЭМВЧ (≥ 10 и более дней с приступами мигрени в течение месяца). Группы ХМ и ЭМ статистически значимо отличались по частоте ГБ в целом и мигренозной ГБ в месяц, частоте приема анальгетиков, распространенности избыточного употребления анальгетиков и по возрасту, тогда как различий по полу и интенсивности боли не наблюдалось. Характеристики пациентов представлены в таблице 2.
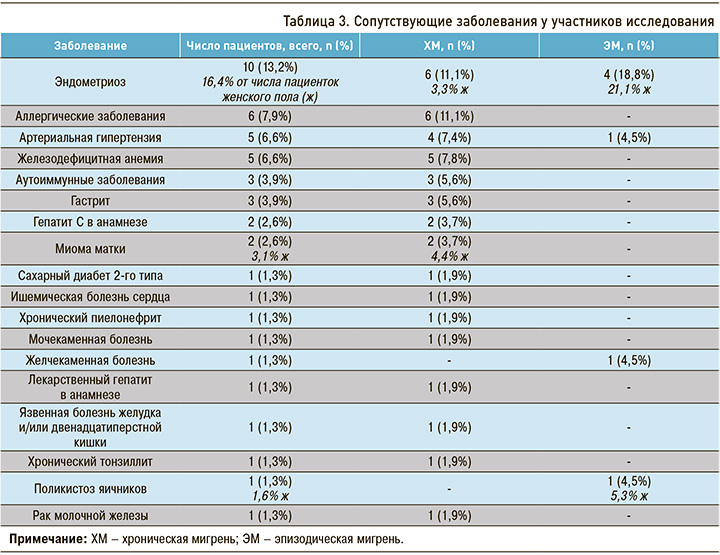
У 32 пациентов (42,1%) имелись сопутствующие соматические заболевания, при этом у 13 человек (17,1%) – не менее двух. Наиболее распространенным среди них как в общей выборке, так и в группах пациентом ХМ и ЭМ был эндометриоз (табл. 3), что согласуется с данными исследований в мировой литературе [13]. Более высокая представленность сопутствующих патологий наблюдалась в группе ХМ. Таким образом, изученная выборка пациентов соответствовала картине реальной клинической практики, что отличает нашу работу от тех клинических исследований, в которых многие соматические заболевания относились к критериям невключения.
Динамика частоты головной боли за 3 мес.
Оценка эффективности лечения проводилась через 1 и 3 мес. после первого введения эренумаба. В общей выборке снижение частоты ГБ на 50% и более (рис. 1 – серые отделы гистограммы) через месяц было зарегистрировано у 39,5% пациентов, через 3 мес. лечения этот показатель возрос и достиг 53,9%. В группе ХМ наблюдалась аналогичная тенденция со снижением частоты ГБ на 50% и более через месяц у 32,1% пациентов, а через 3 мес. – у 52%. Среди больных с ЭМ аналогичное снижение частоты ГБ уже на 1-м месяце терапии фиксировалось у 59,1% пациентов, и к 3-му месяцу лечения сохранялось на прежнем уровне.
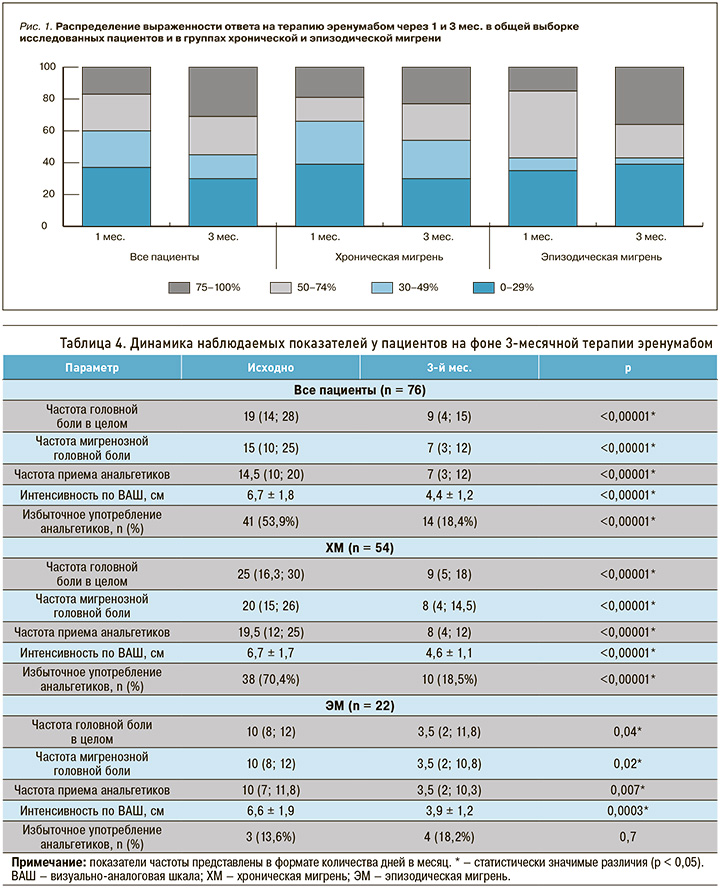
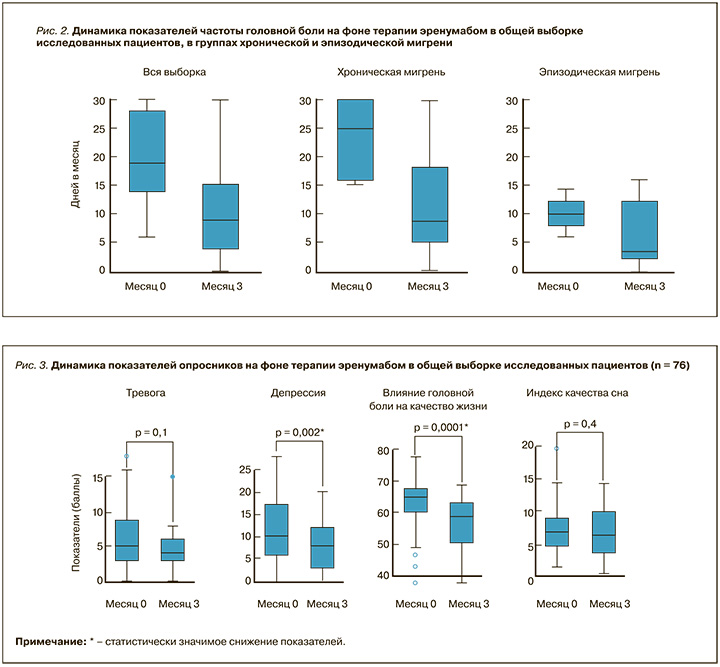
Также нами было установлено значимое снижение частоты ГБ в целом, мигренозной ГБ, количества дней с приемом анальгетиков, интенсивности боли и количества пациентов с избыточным использованием анальгетиков через 3 мес. применения эренумаба как в общей выборке, так и в группе ХМ. Для группы ЭМ не отмечалось значимого уменьшения избыточного употребления анальгетиков, что, возможно, связано с малым объемом выборки. Соответствующие данные представлены в таблице 4 и на рисунке 2.
Динамика показателей опросников
У всех пациентов проводилась оценка сопутствующих симптомов тревоги, депрессии, влияния ГБ на качество жизни и нарушений сна. Медиана показателей тревоги в общей выборке и группе ХМ соответствовала умеренной тревожности, тогда как в группе ЭМ – легкой тревожности. Медиана показателей депрессии во всех трех когортах варьировала в пределах нормы (до 14 баллов), однако значения 3-го квартиля указывали на наличие депрессии. Медиана влияния ГБ на качество жизни в общей выборке, группах ХМ и ЭМ соответствовала уровню тяжелого влияния. Что касается индекса качества сна, то его величины в общей выборке, группах ХМ и ЭМ свидетельствовали о нарушениях сна (показатель ≥ 5).
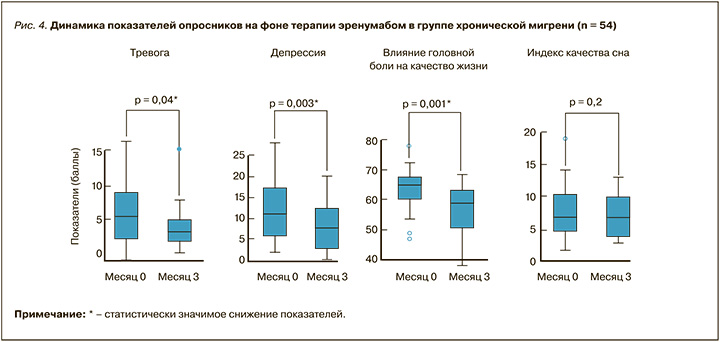
На фоне лечения эренумабом [14] без назначения дополнительной терапии, направленной на коррекцию указанных симптомов, в общей выборке и группах ХМ и ЭМ наблюдалось значимое уменьшение показателей депрессии и влияния ГБ на качество жизни, при этом в общей выборке
и среди пациентов с ХМ уровни влияния ГБ на качество жизни достигли снижения от тяжелых к выраженным (менее дезадаптирующим). Также было зафиксировано достижение легкого уровня (< 5 баллов) медиан тревоги для общей выборки, ХМ и ЭМ, при этом значимое снижение данного показателя имело место именно у пациентов с ХМ. Отсутствие значимой динамики во всех группах отмечалось в отношении параметров качества сна. Соответствующие данные графически отображены на рисунках 3 (динамика показателей в общей выборке пациентов) и 4 (динамика показателей в группе ХМ). Динамика показателей для ЭМ не приводится по причине малой выборки пациентов с этой формой заболевания.
Нежелательные явления терапии
В процессе лечения нежелательные явления (НЯ) были обнаружены у 10 пациентов (13,1%). Наиболее распространенным среди них оказалась констипация после инъекции, которая была выявлена у 4 человек (5,3%), носила легкий характер и купировалась самостоятельно. У 3 участников (3,9%) имелась выраженная болезненность в месте инъекции в течение нескольких дней после введения препарата. 1 пациент (1,3%) сообщил об аллергической реакции в месте инъекции (покраснение, зуд), которая разрешилась самостоятельно, без применения антигистаминных средств. У 1 пациента (1,3%) после 2-го и 3-го введения эренумаба произошел спазм мышц в поясничной области, сопровождавшийся болевым синдромом высокой интенсивности и потребовавший добавления анальгетической терапии. Несмотря на высокую эффективность в отношении ГБ, этот участник отказался от дальнейшей терапии эренумабом. Один пациент (1,3%) высказывал жалобы на эпизодические затруднения дыхания в течение 3 дней после 2-го и 3-го введения препарата. Однако при выполненном обследовании у него не наблюдалось признаков патологии сердечно-сосудистой и дыхательной систем, аллергической реакции, в связи с чем совместно с больным было принято решение продолжить терапию. Еще у 1 участника исследования (1,3%) после 1-й инъекции стало отмечаться выпадение волос, которое далее продолжило прогрессировать. Он был направлен к трихологу и продолжил лечение эренумабом: на момент 3-й инъекции выпадение волос нерегрессировало, трихолог не выявил дефицитарных состояний и рекомендовал дальнейшее наблюдение. Этот пациент настроен на продолжение терапии эренумабом в связи с выраженным положительным эффектом и снижением количества дней с ГБ.
ОБСУЖДЕНИЕ
Применение препаратов в реальной клинической практике после их регистрации и выхода на фармацевтической рынок всегда сопровождается высоким уровнем как позитивных, так и негативных ожиданий со стороны врачей и пациентов. С одной стороны, появление высокоэффективных средств, доказавших свое влияние на заболевание и низкий уровень побочных эффектов в условиях клинического исследования, позволяет предположить хороший результат в практике. С другой стороны, не всегда понятная реальная эффективность препаратов у полиморбидных пациентов и неизвестные ранее НЯ, которые так или иначе всегда дополнительно возникают при их применении, зачастую порождают осторожное отношение к новым лекарственным средствам. Для пациента наиболее настораживающим фактором становится неизвестность отсроченных побочных эффектов и влияния препарата на организм, так как с точки зрения обывателя клинические испытания лекарств не являются показательными.
Мигрень представляет собой тяжелое дезадаптирующее заболевание. Как показывают наши данные, иХМ, и ЭМ сопровождаются выраженным негативным влиянием боли на качество жизни пациентов, симптомами тревоги и депрессии, нарушениями сна. Более того, всегда существует риск перехода ЭМ в хроническую форму заболевания. Пациенты с мигренью в амбулаторной практике чаще всего обращаются с жалобами к терапевту или врачу общей практики, первоочередные задачи которого – дальнейшее назначение профилактического лечения и маршрутизация больного. При этом с учетом частого наличия у пациента сопутствующих заболеваний и ограничений по времени, сопровождающих амбулаторный прием, подбор рациональной терапии нередко становится серьезной проблемой.
По этой причине появление препаратов, влияющих непосредственно на патогенетические звенья мигренозного приступа путем блокады CGRP или его рецептора и не оказывающих широкого спектра побочных эффектов, можно считать прорывом для повседневной клинической практики. Эренумаб, будучи человеческим моноклональным антителом, не метаболизируется изоферментами цитохрома P450, печеночный путь выведения не является для него основным, что исключает взаимодействие этого препарата с другими лекарственными средствами [14].
Показанная в ранее проведенных зарубежных клинических исследованиях эффективность эренумаба по целому ряду параметров (снижение частоты ГБ в целом, мигрени, дней с приемом анальгетиков, в том числе у пациентов с избыточным использованием обезболивающих средств, уменьшение интенсивности приступов как при ХМ, так и при ЭМ) [15, 16] подтверждается как результатами нашей работы, так и данными российской и мировой литературы [17–20]. У половины пациентов в группе ХМ наблюдался выраженный ответ на терапию (снижение дней с ГБ более чем на 50%) уже к 3-му месяцу лечения, что сложно достижимо при применении классической профилактической терапии мигрени. В свою очередь, у пациентов с ЭМ выраженное снижение частоты ГБ достигалось уже через месяц лечения и стабильно удерживалось на достигнутом уровне. Эти данные позволяют сделать вывод о возможности развития быстрого эффекта эренумаба как при ХМ, так и при ЭМ, что повышает комплаентность пациента к дальнейшему продолжению терапии для увеличения и закрепления полученного результата.
Большое значение для клинической практики имеет показанное в нашем исследовании улучшение качества жизни пациентов с мигренью даже за такой достаточно непродолжительный срок, как 3 мес., а также уменьшение выраженности симптомов тревоги и депрессии на фоне применения эренумаба. Улучшение эмоционального состояния благоприятно сказывается на общем самочувствии пациента и также увеличивает его приверженность к лечению.
Еще одно преимущество анти-CGRP мАТ – возможность назначения при частоте мигрени от 4 дней в месяц: это позволяет врачу более уверенно чувствовать себя при подборе профилактического лечения в тех ситуациях, когда пациент затрудняется с точной оценкой частоты ГБ и невозможно установить, является ли его мигрень хронической или эпизодической. Помимо этого, возможность назначения препарата при достаточно низкой частоте боли позволяет удовлетворить запрос пациента на улучшение качества жизни, которое может всерьез страдать и при редкой ЭМ, если приступы являются дезадаптирующими и плохо поддаются купированию обезболивающими средствами. Необходимо помнить, что первичная оценка эффективности эренумаба производится не ранее чем через 3 мес. лечения, и в нашем исследовании результаты терапии и целесообразность ее продолжения определялись именно по прошествии указанного срока. В связи с этим отметим, что дальнейший курс применения эренумаба может составлять от 6 до 18 мес. и далее в зависимости от исходной частоты ГБ и динамики показателей [12].
Частота и выраженность НЯ при лечении эренумабом, выявленные в нашей работе, сопоставимы с данными клинических исследований и реальной клинической практики [15–20]. Серьезных побочных эффектов, приводящих к госпитализации и/или летальному исходу, на фоне исследованной терапии отмечено не было.
ЗАКЛЮЧЕНИЕ
Эренумаб является высокоэффективным средством для профилактического лечения мигрени при ее частоте более 4 дней в месяц. Таргетное воздействие на молекулу CGRP, отсутствие печеночного метаболизма и взаимодействия с другими лекарствами, малое количество побочных эффектов расширяют возможности его применения в реальной клинической практике, в том числе у полиморбидных пациентов.


