Черепно-мозговая травма (ЧМТ) представляет актуальную медико-социальную и экономическую проблему для всех развитых стран, затрагивая более 10 млн человек ежегодно, и связана с высокими показателями летальности, стойкой нетрудоспособностью, инвалидизацией наиболее социально активной части общества [1–3]. В Российской Федерации летальность в результате ЧМТ занимает второе место среди всех причин и составляет при тяжелой степени тяжести 60% и более, а среди причин развития инвалидизации ЧМТ занимает первое место [4]. Огромны и экономические потери в связи с временной или стойкой утратой трудоспособности у пострадавших с ЧМТ, например, в США ежегодные расходы, которые включают в себя потерю потенциального дохода пациента и родственников, стоимость неотложной помощи, а также другие медицинские расходы, такие как постоянный амбулаторный уход и реабилитация, оценивают в среднем в 4 млрд долларов США [5].
 Хотя уровень выживаемости при ЧМТ в последние десятилетия постоянно повышается, особенно в развитых странах, основной проблемой остаются последствия травмы, а основной целью лечения ЧМТ является профилактика развития инвалидизации путем повышения уровня восстановления функций головного мозга после травмы [6]. Организация адекватной медико-социальной реабилитации больных с последствиями ЧМТ является важной медико-социальной задачей и включет в себя многие составляющие, одной из которых является медикаментозное лечение [7]. На сегодняшний день почти все проведенные клинические испытания различных лекарственных препаратов не показали достаточную эффективность с точки зрения доказательной медицины. Таким образом, в настоящее время не существует одобренных рекомендаций лекарственной терапии последствий ЧМТ.
Хотя уровень выживаемости при ЧМТ в последние десятилетия постоянно повышается, особенно в развитых странах, основной проблемой остаются последствия травмы, а основной целью лечения ЧМТ является профилактика развития инвалидизации путем повышения уровня восстановления функций головного мозга после травмы [6]. Организация адекватной медико-социальной реабилитации больных с последствиями ЧМТ является важной медико-социальной задачей и включет в себя многие составляющие, одной из которых является медикаментозное лечение [7]. На сегодняшний день почти все проведенные клинические испытания различных лекарственных препаратов не показали достаточную эффективность с точки зрения доказательной медицины. Таким образом, в настоящее время не существует одобренных рекомендаций лекарственной терапии последствий ЧМТ.
При ЧМТ выделяют два основных механизма повреждения мозга: первый – это разрушительное воздействие механической энергии на мозговое вещество в момент получения травмы, второй – действие вторичных факторов повреждения мозга, реализующих свое действие уже после травмы, что непосредственно определяет результаты лечения и исход травматической болезни [5].
Важным итогом доказательных исследований по патофизиологии ЧМТ стало представление об универсальности механизмов вторичного повреждения травмированного мозга, которые не зависят от тяжести первичной травмы, поскольку в основе этих механизмов лежит развитие ишемии и гипоксии мозга [8]. Согласно современным представлениям, вторичное повреждение мозга при ЧМТ, так же как при ишемическом инсульте, реализуется в виде нарушений мозгового кровообращения, реакций ишемического каскада, эксайтотоксичности, воспалительных изменений и метаболических расстройств [9]. Разница заключается только в том, что для формирования ишемии при инсульте можно представить нулевую точку отсчета временного интервала развития ишемического каскада, тогда как при ЧМТ вторичные ишемические нарушения могут развиваться на всем протяжении различных периодов травмы, что и определяет необходимость целенаправленного воздействия на них на всем протяжении травматической болезни. Все это обосновывает актуальность использования достижений, полученных при лечении острого инсульта и хронической ишемии мозга, для терапии последствий травматического повреждения мозга [7].
Обращает на себя внимание то, что с позиций доказательной медицины в современных рекомендациях отсутствуют какие-либо указания относительно медикаментозной составляющей терапии вторичной ишемии мозга в различные периоды травматической болезни. Большинство методов медикаментозного лечения ЧМТ, исследованных на сегодняшний день, потерпели неудачу, вероятно, потому что изучались лекарственные препараты, действие которых направлено на какой-либо один патологический фактор, а не на патогенез травматической болезни мозга. К перспективному направлению относится поиск и применение препаратов, которые действуют на несколько патофизиологических звеньев последствий ЧМТ, обладают нейропротективным действием и способны стимулировать восстановление церебральных функций и репаративные процессы в ткани мозга после травмы [9].
Современные знания о патофизиологических механизмах ЧМТ позволяют рассматривать применение достижений доказательной медицины, полученных у больных с острым инсультом и хронической ишемией мозга, в качестве возможного варианта для лечения пациентов с последствиями ЧМТ [10]. С этой точки зрения большой интерес вызывает клинический опыт успешного применения цитиколина (Цераксон) при лечении ишемического инсульта, особенно учитывая высокий уровень доказательности полученных результатов (уровень А) [11, 12].
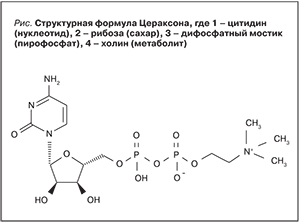
Цитиколин представляет собой эндогенное соединение, образующееся во время синтеза мембранных фосфолипидов и сфингомиелина, которое играет важную роль в восстановлении и поддержании мембран нервных клеток, внутриклеточных структур (микросом, митохондрий), миелиновых оболочек нервных стволов, в обмене нейромедиаторов, т.е. соединение, обладающее мультимодальным действием [13–15]. Мультимодальный эффект цитиколина объясняется его уникальной структурой, в которую входит цитидин, дифосфат, рибоза и холин, что отличает его от других донаторов холина – субстанции, необходимой для репарации мембран нейронов головного мозга, миелиновых оболочек нервных стволов и улучшения синаптической передачи (рисунок). Такое сочетание активных компонентов в структуре препарата позволяет не просто доставить холин (метаболит) к месту потребления (в поврежденные ткани мозга), но и запустить процессы метаболизации путем активации энергообменных механизмов с восстановлением мембранных комплексов нейрональных клеток и миелиновых оболочек нервных стволов [16–19].
Помимо эффекта активации биосинтеза фосфатидилхолина, поддержания нормального уровня кардиолипина (белок мембраны митохондрий) и сфингомиелина (основы мембраны нейронов и миелиновой оболочки нервных волокон), цитиколин принимает прямое участие в синтезе ацетилхолина, стимуляции синтеза глутатиона, в ингибировании процессов перекисного окисления липидов, восстановлении активности Na+-K+-АТФ-азы, угнетении активности фосфолипазы А2, снижении глутаматиндуцированного апоптоза, оптимизации процессов энергообеспечения в нейронах и активации цитохромоксидазы в митохондриях нейронов (улучшение тканевого дыхания) [20]. Структурная формула препарата отражает перечисленные фармакологические эффекты, поскольку в ней присутствуют и нуклеотидная составляющая, и СН3 группы, и двойные мостики связей, и многое другое [21].
Препарат является аналогом эндогенного холина, обладает 100% биологической доступностью, на 84% включается в обменные процессы в тканях мозга, что объясняет благоприятный профиль действия и отсутствие побочных эффектов при его клиническом применении, в том числе у пожилых и ослабленных больных с последствиями ЧМТ [22–24]. Более чем 25-летний опыт клинических исследований по применению цитиколина у больных с ЧМТ, в том числе результаты исследования R. Lozano [25], продемонстрировали два важных эффекта препарата: 1) высокую клиническую эффективность при сочетанном применении с базовой терапией; 2) высокий профиль безопасности [26, 27]. Сравнительный мета-анализ результатов многоцентрового двойного слепого плацебо-контролируемого исследования (CORBIT) по применению цитиколина (Цераксон) более чем у 1200 больных с ЧМТ различной степени тяжести [28] подтвердил результаты более ранних исследований с высокой степенью доказательности [29, 30].
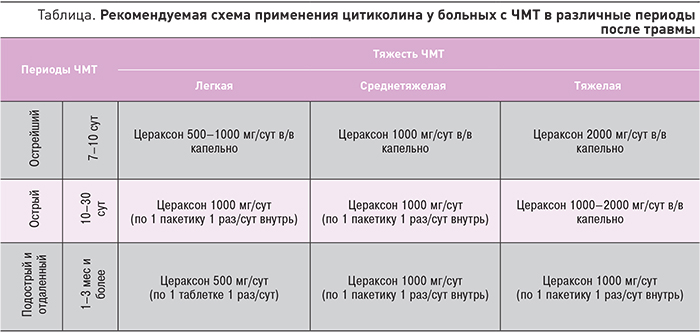
Использование эффективной дозировки цитиколина очень актуально для достижения клинического эффекта и важно не только для острого, но и для всех последующих периодов травматической болезни (таблица). Период восстановления после ЧМТ может продолжаться до 5 лет [31], поэтому курс лечения данным препаратом, в сочетании с другими средствами реабилитации, должен быть продолжительностью от 45 дней до 1 года [9, 32].
Во многих странах цитиколин уже вошел в рекомендуемый протокол лечения больных с травмой мозга [33]. В Российской Федерации с 2012 г. препарат вошел в стандарты лечения инсульта, что привело к значительному снижению летальности и степени инвалидизации. Социальное и экономическое бремя ЧМТ очень велико, и сегодня есть обоснованная насущность и необходимость включения препарата в протоколы лечения больных с последствиями ЧМТ в нашей стране. Обоснованием вышеуказанному служат важные положения:
- ЧМТ – одна из наиболее важных социально-экономических и медицинских проблем современности, определяющая необходимость усиления борьбы с последствиями травмы, с целью ускорения медицинской и социальной реабилитации пострадавших.Внедрение более эффективных стратегий медикаментозной борьбы при повреждениях мозга необходимо для профилактики вторичного его повреждения, ускорения восстановления и снижения степени инвалидизации.
- Универсальный (биологический) механизм ишемическо-гипоксического вторичного повреждения мозга определяет сходные подходы к медикаментозной терапии последствий травмы и инсульта, к цито/нейропротективной терапии при церебральных повреждениях.
- Особое место в ряду лекарственных средств с нейропротективным действием занимает цитиколин (Цераксон, citicolin, CDP-choline), препарат, прошедший барьер доказательных медицинских исследований при ишемии мозга и рекомендованный для применения при церебральном инсульте.
- Совокупность фармакологических эффектов препарата и результатов клинических исследований при острой и хронической ишемии мозга позволяет рекомендовать практическое применение цитиколина при терапии последствий травмы мозга, в том числе в комбинации с другими препаратами, улучшая результаты лечения за счет комплаентного взаимно усиливающего действия препарата.



