Сосудистая деменция (СД) – необратимое состояние, связанное в основном с различными цереброваскулярными заболеваниями (гипоперфузия, гипоксия, ишемия и инсульт), для которых характерно прогрессирующее ухудшение когнитивных функций и проблемы с социальной адаптацией. Как известно, деменция относится к возраст-зависимым состояниям, и общемировая тенденция к старению населения ведет к прогрессирующему увеличению заболеваемости. По оценкам ВОЗ, к 2050 г. численность населения, страдающего деменцией, утроится и превысит 100 млн. СД является вторым наиболее распространенным типом деменции после болезни Альцгеймера (БА) и составляет около 15% от общего количества ее случаев [1].
МКБ-10 определяет СД (F01) как деменцию, которая возникает после цереброваскулярных заболеваний. Ее наиболее характерными клиническими проявлениями служат нарушения внимания и исполнительных функций, умеренные нарушения памяти, трудности при выполнения многоэтапных задач, замедленное мышление, уменьшенные способности планирования, рассуждения, решения проблем, нарушается активность повседневной жизни [2, 3].
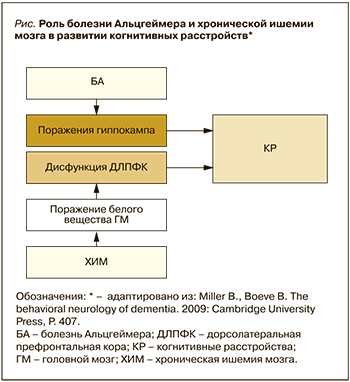 При постановке диагноза СД необходимо помнить о возможности клинического сосуществования СД и БА (так называемые смешанные когнитивные расстройства) и о том, что хроническая ишемия мозга (ХИМ), возникающая при любых цереброваскулярных заболеваниях (ЦВБ), может стимулировать развитие субклинически существующего нейродегенеративного процесса (например, БА) или значительно ухудшать уже имеющиеся когнитивные нарушения [4, 5] (рис.). Около 40% пациентов с БА имеют некоторые формы сосудистых когнитивных нарушений и деменции [6]. С другой стороны, амилоидная патология способствует страданию мелких сосудов и уменьшает кровоток через суженные сосуды [7]. Кроме того, надо учитывать, что, хотя СД часто рассматривается как один тип нарушений памяти, на самом деле существуют различные его подтипы, неодинаковые по клинической картине [8–12].
При постановке диагноза СД необходимо помнить о возможности клинического сосуществования СД и БА (так называемые смешанные когнитивные расстройства) и о том, что хроническая ишемия мозга (ХИМ), возникающая при любых цереброваскулярных заболеваниях (ЦВБ), может стимулировать развитие субклинически существующего нейродегенеративного процесса (например, БА) или значительно ухудшать уже имеющиеся когнитивные нарушения [4, 5] (рис.). Около 40% пациентов с БА имеют некоторые формы сосудистых когнитивных нарушений и деменции [6]. С другой стороны, амилоидная патология способствует страданию мелких сосудов и уменьшает кровоток через суженные сосуды [7]. Кроме того, надо учитывать, что, хотя СД часто рассматривается как один тип нарушений памяти, на самом деле существуют различные его подтипы, неодинаковые по клинической картине [8–12].
МКБ-10 выделяет следующие подгруппы СД:
- СД с острым началом (F01.0);
- мультиинфарктная деменция (F01.1);
- подкорковая СД (F01.2);
- смешанная корковая и подкорковая СД (F01.3);
- другая СД (F01.8);
- СД неуточненная (F01.9).
ЦВБ часто начинаются исподволь и прогрессируют постепенно. На ранней стадии выделяют умеренные когнитивные расстройства (УКР), при которых наблюдается когнитивное снижение, выходящее за рамки возрастной нормы, но не приводящее к утрате независимости в повседневной жизни. Для описания УКР сосудистого происхождения P. Sachdev в 1999 г. впервые предложил термин «сосудистые когнитивные расстройства» (СКР) [13]. СКР подразумевает когнитивный дефицит по крайней мере в одной когнитивной области без нарушения повседневной активности [14]. При СД напротив, имеются нарушения двух или более когнитивных функций, приводящие к снижению повседневной активности.
ДИАГНОСТИКА СОСУДИСТЫХ КОГНИТИВНЫХ НАРУШЕНИЙ
Диагностика СКР и СД включает оценку когнитивных функций и поведенческих симптомов, сбор анамнеза; кроме этого, обязательно учитываются показатели нейровизуализации.
Хотя в арсенале современной медицины есть различные клинические диагностические инструменты [15, 16] и критерии СД, такие как NINDS-AIREN [17], DSM-IV [18], ADDTC [19], разработка единых критериев до сих пор вызывает затруднения.
При исследовании когнитивных функций в рамках диагностики СКР и СД прежде всего оцениваются:
- исполнительные функции (планирование и внимание);
- речь (импрессивная и экспрессивная);
- память (заучивание и воспоминание);
- визуально-пространственные навыки (способность иметь дело с невербальной, графической или географической информацией);
- активность повседневной жизнедеятельности (шкала ADL).
Поведенческие и эмоциональные расстройства часто возникают при сосудистой патологии. Например, так называемая сосудистая депрессия (депрессия у пожилого человека с ЦВБ) возникает более чем у половины пациентов с ЦВБ. Синдром характеризуется ярко выраженной фронто-стриатной лимбической дисфункцией. У таких больных в большей степени, чем у пациентов с «несосудистой» депрессией, выражены апатия, психомоторная заторможенность, нарушение повседневной деятельности, снижение понимания, в меньшей степени – волнение и чувство вины. Также у них отмечается более слабый, замедленный и нестабильный ответ на терапию антидепрессантами, при этом они лучше реагируют на лечение основного сосудистого заболевания. Эти наблюдения легли в основу гипотезы «сосудистой депрессии», в соответствии с которой ЦВБ могут предрасполагать, ускорять или усугублять некоторые гериатрические синдромы депрессии.
При диагностике сосудистых УКР и СД первостепенное значение имеют данные анамнеза:
- наличие сердечно-сосудистых факторов риска (неконтролируемая гипертензия, диабет и др.);
- данные магнитно-резонансной томографии (МРТ) в пользу наличия церебральных инсультов (диффузная гиперинтенсивность белого вещества, очаги гиперинтенсивного сигнала в перивентрикулярных и глубинных областях белого вещества) [20].
Следует учитывать, что, кроме типичных «сосудистых» факторов риска, органы кровообращения также могут быть повреждены и другими агрессивными воздействиями, например лучевой терапией мозга [21], злоупотреблением психоактивными веществами и др.
Немаловажную роль при диагностике сосудистых когнитивных нарушений играет сбор семейного анамнеза. Генетическая основа сосудистых УКР и СД описана для ряда моногенных нарушений [22], таких как церебральная аутосомно-доминантная лейкоэнцефалопатия (CADASIL), болезнь моя-моя и др. Генетические характеристики спорадических случаев сосудистых УКР и СД на сегодня мало изучены, но в этом направлении проводится активная научная работа. Так, метаанализ исследований генетики сосудистых когнитивных расстройств выявил ассоциацию эпилонов аллелей APOE; ɛ4 с восприимчивостью к сосудистым УКР и СД [23].
В качестве фактора риска СД рассматривается рекуррентный инсульт, поскольку он увеличивает объем мозгового повреждения, уменьшает сердечно-сосудистый резерв и как минимум удваивает частоту постинсультной деменции по сравнению с первым инсультом [24].
Обнаружено также, что синдром «старческой астении» служит краткосрочным предиктором развития деменции, в частности СД [25].
Сахарный диабет увеличивает долгосрочный риск развития деменции в 2 раза. Диабет 2 типа выступает фактором риска развития атеросклероза и заболеваний мелких сосудов [26] и усиливает прогрессирование когнитивных нарушений вплоть до деменции [27]. Следствием инсулинорезистентности становятся клеточный энергетический дефект, повышенное содержание липидов в плазме и артериальная гипертензия [28], которые отрицательно коррелируют с вербальной когнитивной деятельностью [29]. Показано, что у пациентов с плохо контролируемым длительным диабетом распространенность СД доходит до 40% [30].
Пожилой возраст – один из самых мощных факторов провоцирующих развития деменции [31]. Старение приводит к истощению цереброваскулярного резерва, разрушению гематоэнцефалического барьера (ГЭБ), уменьшению числа капилляров, утолщению фиброзной базальной мембраны, снижению перфузии головного мозга и уязвимости к гипоксии. Все это указывает на снижение перфузии крови в ткани мозга и повышенную уязвимость клеток к ишемическому повреждению.
Ишемическая гипоперфузия считается ведущей патогенетической предпосылкой развития СД [32], так как сосудистые когнитивные нарушения обычно рассматриваются как функциональное последствие уменьшения притока крови к мозгу. Сокращение запасов кислорода и питания ухудшает работу синапсов и митохондрий, что усугубляет повреждение нейронов [33]. Цереброваскулярные заболевания и ишемическая гипоперфузия обычно сопровождаются повреждением ГЭБ (включая ГЭБ в гиппокампе) [34, 35]. ГЭБ защищает мозговую среду от различных вредных веществ и молекул, находящихся в периферической крови, и его дисфункция играет важную роль в патогенезе СД [36].
Считается, что основную защитную функцию при приступе гипоперфузии выполняет эндотелий капилляров – цереброваскулярные эндотелиальные клетки. Общая длина капилляров в головном мозге человека оценивается примерно в 400 миль с поверхностью около 20 м2 [37]; таким образом, цереброваскулярный эндотелий служит огромной и специфической транспортной системой и химическим барьером. Его дисфункция вызывает нарушение ГЭБ, подвергая нервные клетки воздействию вредных веществ [38], а также влияет на нейрососудистую связь, заставляя мозговой кровоток несвоевременно реагировать на нейрональную активность [39]. Наиболее значимо то, что цереброваскулярная дисфункция и церебральная гипоперфузия влияют друг на друга, являясь двумя основными участниками патогенеза СД. Однако механизм, лежащий в основе нарушения функции цереброваскулярного эндотелия, и его влияние на когнитивные функции на сегодняшний день до конца не понятен. Установление патологической роли цереброваскулярных эндотелиальных клеток в неврологической и когнитивной дисфункции необходимо для выявления потенциальных молекул-мишеней, на которые можно будет воздействовать уже на ранних стадиях сосудистых когнитивных расстройств, чтобы предотвратить или отсрочить развитие СД.
Визуализация головного мозга, особенно МРТ [40], позволяет отслеживать цереброваскулярную патологию, включая гиперинтенсивность белого вещества (лейкоарайоз), мелкие субкортикальные инфаркты и микрокровоизлияния [41–43].
Как уже говорилось, сосудистые когнитивные нарушения являются гетерогенным заболеванием: они отличаются по основной причине возникновения, размеру поражаемых сосудов, локализации, тяжести и продолжительности заболевания. Структуры мозга, наиболее уязвимые для гипоксии и нехватки энергии при снижении кровотока, всегда поражаются первыми и оказываются наиболее сильно повреждены. Повреждение может быть острым или хроническим [44], но в любом случае вызванное гипоперфузией когнитивное расстройство начинается тогда, когда нарушается функционирование гиппокампа, префронтальных связей коры с базальными ганглиями и, возможно, перивентрикулярного белого вещества [45].
ЛЕЧЕНИЕ СОСУДИСТЫХ КОГНИТИВНЫХ РАССТРОЙСТВ
Терапия сосудистых когнитивных нарушений складывается из лечения непосредственно когнитивного дефицита и ЦВБ. Существующие стратегии ведения таких пациентов включают:
- симптоматическое лечение сосудистых УКР и СД;
- управление факторами риска;
- нефармакологические подходы, направленные на предотвращение прогрессирования УКР до СД.
Что касается средств, улучшающих когнитивные функции, то для лечения сосудистых УКР и СД не существует каких-либо специальных препаратов. При СД средствами первой линии выбора выступают ингибиторы холинэстеразы (донепезил, галантамин и ривастигмин) и антагонист NMDA (N-метил-d-аспартата) рецепторов мемантин. Эти лекарственные средства единственные, которые в настоящее время официально рекомендуются для лечения БА и обладают некоторым положительным эффектом при СД. Основная проблема в том, что они вызывают лишь небольшое кратковременное улучшение в случаях легкой и умеренной деменции и незначительно влияют на тяжелую деменцию [46]. Кроме того, иногда преимущества этих препаратов перекрываются неблагоприятными последствиями терапии [47, 48].
Лечение УКР более перспективно с точки зрения достижения положительного эффекта: существует большой перечень препаратов с различными механизмами действия (улучшение кровоснабжения и метаболизма мозга, антиоксидантное и нейротрофическое действие, регуляция нейромедиаторного состава и пр.) и большей или меньшей степенью доказанной эффективностью при этом состоянии.
Известно, что при различных вариантах деменций наблюдается дефицит ацетилхолина – одного из важнейших медиаторов когнитивных процессов. Для его восполнения у пациентов с нарушениями памяти и другими когнитивными расстройствами легкой и умеренной степени выраженности рекомендуются холиномиметики.
Холина альфосцерат (Церетон®) обладает центральным холиномиметическим действием и относится к группе ноотропных средств. В его составе содержится 40,5% метаболически защищенного холина. Метаболическая защита помогает препарату проникать через ГЭБ и именно в головном мозге расщепляться с помощью ферментов на холин и глицерофосфат. Из холина в персинаптических терминалях холинергических нейронов синтезируется ацетилхолин, а глицерофосфат служит одним из предшественников фосфатидилхолина – компонента фосфолипидной составляющей мембраны нейрона. Экспериментально показаны следующие эффекты холина альфосцерата [49–52]:
- стимуляция дозозависимого выделения ацетилхолина в физиологических условиях нейротрансмиссии;
- восполнение дефицита ацетилхолина в ЦНС в патологических условиях;
- влияние на синтез ряда гормонов, включая соматотропин;
- повышение пластичности нейрональных мембран;
- замедление развития астроглиоза;
- препятствие разрушению фосфорилированных нейрофиламентов;
- уменьшение зоны экспериментального ишемического инсульта.
Предполагается, что холина альфосцерат обладает собственными нейропротекторными свойствами, которые связаны не только с прямым холинергическим эффектом.
В ряде клинических исследований (КИ) показано, что холина альфосцерат улучшает кровоток и усиливает метаболические процессы в ЦНС, активирует ретикулярную формацию, способствует восстановлению биоэлектрической активности мозга. Так, при травматическом поражении мозга на фоне его применения выявляется увеличение линейной скорости кровотока на пораженной стороне.
Максимальный эффект холина альфосцерат демонстрирует при легкой/умеренной степени когнитивных расстройств, поэтому его прием рекомендуется начинать как можно раньше [53]. При деменции препарат также может применяться в качестве дополнительного средства [54] и сочетаться с ингибиторами ацетилхолинэстеразы.
Эффективность холина альфосцерата у пациентов с различными видами когнитивных расстройств (БА, СД, возрастное когнитивное снижение) доказана в нескольких рандомизированных двойных слепых КИ [55–57]. Эффективность препарата Церетон® продемонстрирована у пациентов с болезнью Паркинсона с когнитивными нарушениями [58]. В большой серии отечественных работ описан положительный опыт применения холина альфосцерата у пациентов с ЦВБ. В частности, наблюдались улучшения памяти и других когнитивных функций, регресс очаговой неврологической симптоматики и нормализация поведенческих реакции [59–65]. При острых нарушениях мозгового кровообращения (ОНМК) применение препарата Церетон® способствовало расширению двигательного режима и более активному проведению реабилитационных мероприятий. Препарат хорошо переносился и практически не вызывал побочных эффектов.
В исследовании С.А. Гавриловой была произведена оценка эффективности и безопасности терапии препаратом Церетон® у лиц с синдромом мягкого когнитивного снижения амнестического типа (amnestic mild cognitive impairement, aMCI). Пациенты получали Церетон® (альфосцерат холина) в капсулах по 400 мг 3 раза в день (1200 мг в сутки). Продолжительность курса терапии составляла 90 дней. У большинства пациентов с синдромом аMCI после лечения препаратом Церетон® было выявлено резкое повышение содержания фосфатидилхолина в плазме крови и увеличение экспрессии гена кислой сфингомиелиназы, после лечения Церетоном. По результатам однократного курса терапии у пациентов было установлено статистически значимое улучшение по большинству психометрических параметров. Хотя через 7—9 мес после окончания лечения показатели большинства тестов, достигнутые к окончанию курса терапии, ухудшались, все же уровень когнитивного функционирования пациентов оставался более высоким по сравнению с началом лечения. Проведение повторного курса терапии препятствовало нарастанию когнитивного дефицита в течение периода наблюдения (10—12 мес). [66 ]
Другой многоплановый препарат, широко применяемый в неврологической и терапевтической практике, в том числе для лечения когнитивных расстройств – этилметилгидроксипиридина сукцинат (Нейрокс®). Он действует как мощный антиоксидант и антигипоксант, улучшает энергетический обмен в клетке, в частности повышает эффективность дыхательной цепи, благодаря наличию в его формуле янтарной кислоты (сукцинат – метаболит цикла трикарбоновых кислот). Химическая формула и механизм действия этилметилгидроксипиридина сукцината (ЭМГПС) объясняют его чрезвычайно малые побочные эффекты, хорошую переносимость и минимум противопоказаний [67].
Применение ЭМГПС в неврологии основывается на следующих его фармакологических эффектах [68]:
- восстановление энергопродукции мозга в условиях ишемии;
- торможение истощения запасов углеводов и накопления лактата;
- ингибирование перекисного окисления липидов;
- улучшение реологических свойств крови: уменьшение агрегации тромбоцитов и стабилизация биологических мембран (в частности, мембран эритроцитов и тромбоцитов), ингибирование синтеза тромбоксана A, лейкотриенов и усиление синтеза простациклина;
- гиполипидемическое действие: снижение содержания атерогенных липопротеидов и триглицеридов, повышение уровня липопротеидов высокой плотности;
- улучшение синаптической передачи и транспорта нейромедиаторов, стабилизация клеточных мембран;
- модулирование активности мембраносвязанных ферментов (кальций-независимой фосфодиэстеразы, аденилатциклазы, ацетилхолинэстеразы), рецепторных комплексов (бензодиазепинового, ГАМК, ацетилхолинового);
- ноотропное и анксиолитическое действие, не сопровождающееся сонливостью и миорелаксацией.
Клиническое действие ЭМГПС выражается в нормализации когнитивных и поведенческих функций, соматовегетативных показателей, восстановлении циклов «сон–бодрствование», уменьшении очаговой неврологической симптоматики. Препарат способен оказывать выраженное потенцирующее действие на эффекты нейропсихотропных препаратов (транквилизаторов, нейролептиков, снотворных, антиконвульсантов и анальгетиков), что позволяет снижать их дозы и таким образом уменьшать дозозависимые побочные эффекты. ЭМГПС рекомендуется использовать в комплексной терапии инсульта и ХИМ, а также при широком спектре заболеваний нервной системы, которые сопровождаются повышением скорости перекисного окисления липидов, гипоксией, нарушениями мозгового метаболизма. В ряде случаев бывает целесообразно сочетанное применение препаратов Нейрокс® и Церетон® для усиления клинического эффекта.
Для повышения целостности нервных клеток и их связей в профилактических и терапевтических целях с успехом применяется цитидин-5-дифосфохолин, или цитиколин (Нейпилепт®). Он химически идентичен природному эндогенному соединению, непосредственное участвующему в биосинтезе фосфатидилхолина – одного из основных структурных компонентов клеточной мембраны (структурных фосфолипидов). Фосфатидилхолин и его компонент фосфатидилэтаноламид – два наиболее важных компонента клеток эукариот, на которые приходится более половины фосфолипидов мембран. Нейпилепт® обладает широким спектром действия: способствует восстановлению поврежденных клеточных мембран, ингибирует действие фосфолипаз, препятствует избыточному образованию свободных радикалов, предотвращает гибель клеток, воздействуя на механизмы апоптоза. Его нейропротекторная активность показана эксепериментальным путем на моделях церебральной ишемии и травмы.
Клинические особенности цитиколина при ишемическом инсульте и травматическом повреждении мозга активно изучаются [69–72]. В частности, показано, что при ОНМК он снижает объем поражения ткани головного мозга, улучшает холинергическую передачу и уменьшает неврологический дефект. При хронической гипоксии мозга цитиколин эффективен в лечении когнитивных расстройств (ухудшение памяти, внимания, безынициативность, трудности в бытовых делах и самообслуживании). При черепно-мозговой травме препарат снижает длительность посттравматической комы и выраженность неврологических симптомов, способствует сокращению восстановительного периода.
Нейпилепт® производится из японской субстанции в виде раствора для внутривенного и внутримышечного введения (125 и 250 мг/мл), а также для приема внутрь во флаконах по 30 и 100 мл.
Препарат подтвердил терапевтическую эквивалентность оригинальному цитиколину в терапии ишемического инсульта в многоцентровом сравнительном исследовании (n=152) [73].
В исследовании Т.В. Шутеевой изучалась возможность использования цитиколина (Нейпилепт®) для коррекции когнитивных и тревожно-депрессивных проявлений у пациентов с ХИМ на фоне традиционной терапии. Пациенты, имевшие в анамнезе артериальную гипертонию, церебральный атеросклероз, острые нарушения мозгового кровообращения, ожирение, получали цитиколин (Нейпилепт®) по 1000 мг внутрь в течение 30 дней. Лечение приводило к улучшению статолокомоторных и когнитивных функций, что подтверждалось динамикой показателей шкалы Тинетти, КШОПС и ШОЛД. Через 30 дней в группе пациентов, получавших Нейпилепт®, было отмечено статистически значимое снижение выраженности симптомов тревожности (НАМ-А, показатели до лечения 14,3+/-2,2 после лечения снижение до 7,1+/- 2,0 баллов) и депрессии (НАМ-D показатели до лечения 13,3+/-2,1 после лечения 7,2+/- 2,2 баллов), что можно объяснить увеличением активности норадренергической, дофаминергической и серотонинергической систем на фоне приема цитиколина[74].
В исследования Э.Ю. Соловьевой, у больных с установленной ХИМ 2-й степени с декомпенсацией на фоне гипертонического криза и/или нарушения сердечного ритма после завершения лечения препаратами Нейрокс® и Нейпилепт® было отмечено уменьшение жалоб и улучшение общего состояния. Субъективные положительные изменения подтверждались результатами объективной оценки неврологического статуса пациентов по шкале А.И. Федина. Было отмечено достоверное снижение выраженности симптоматики с Ме=54 [LQ=60,5; OQ=47,5] до Ме=34 [LQ=41,1; OQ=26,9]. Было выявлено достоверное увеличение активности супероксиддисмутазы в плазме крови, повышение содержания в крови восстановленных SH-групп, играющих важную роль в мембраностабилизации и обеспечивающих транспорт холина в клетки.
Комбинированная терапия препаратами Нейрокс® и Нейпилепт® демонстрирует синергизм антиоксидантного действие двух препаратов. Со стороны Нейрокса это увеличение активности супероксиддисмутазы и глутатионпероксидазы, со стороны Нейпилепта — восстановление структуры поврежденных мембран и увеличение уровня внутриклеточного глутатиона[75].
Цитиколин следует рассматривать в качестве универсального мембранопротектора, способного сохранять основные свойства биологических мембран у пациентов с тяжелой соматической патологией, в остром восстановительном периодах ишемического инсульта и черепно-мозговой травмы, у пациентов с болезнью Паркинсона, сахарным диабетом, гипертонической энцефалопатией с выраженными когнитивными расстройствами.
ТАРГЕТНАЯ ТЕРАПИЯ ДЕМЕНЦИИ
Таргетная терапия деменции направлена непосредственно на устранение причины и главных патогенетических звеньев заболевания. В настоящее время появляется все больше новых данных, свидетельствующих, что средства против деменции могут быть разработаны с помощью синаптической фармакологии. Подобно синаптическому повреждению мозга при БА, повреждение и/или утрата синапсов, по-видимому, лежат в основе сосудистых когнитивных расстройств. Таким образом, фармакологическое воздействие должно быть нацелено на восстановление синаптических функций и способности мозга обрабатывать информацию, связанную с памятью, посредством синаптических взаимосвязей.
Существуют различные пути передачи сигналов, на которые можно воздействовать для улучшения синаптических функций [76], например:
- Bryostatin-1 – относительно селективный активатор протеинкиназы Cε, способный сохранять синаптогенез и когнитивную функцию после глобальной церебральной ишемии. Напомним, что протеинкиназа Cε преимущественно экспрессируется в головном мозге, обладает антиапоптотическим действием и подавляется в нейронах после церебральной ишемии [77, 78];
- нейротрофический фактор (BDNF). Этим вещество особенно богато представлено в гиппокампе и коре, оно играет важную роль в синаптических функциях и обработке связанной с памятью информации. Показано, что терапевтические эффекты в высокой степени коррелируют и согласуются с повышенной экспрессией и активностью в гиппокампе и коре головного мозга, вызванными BDNF [79];
- антиапоптотическое воздействие;
- уменьшение повреждения от церебральной реперфузии после ишемии [80];
- фосфорилирование митохондриальных K+-АТФ-каналов и увеличение синаптосомального митохондриального дыхания.
Остается выяснить, какие из этих путей синаптической передачи сигналов наиболее эффективны в контексте фармакологических воздействий.
ПРОФИЛАКТИЧЕСКИЕ МЕРЫ
Профилактика сосудистых УКР и СД включает два типа вмешательств:
- раннее выявление и медицинское лечение сердечно-сосудистых заболеваний;
- создание церебрального резерва.
Правильный контроль над модифицируемыми сердечно-сосудистыми факторами риска может быть более эффективным, чем современное фармакологическое лечение когнитивных расстройств [81, 82]. Он включает своевременное и адекватное лечение АГ и диабета, тромболитическую терапию острого ишемического инсульта и др. При этом, разумеется, должны использоваться как лекарственные, так и нелекарственные методы.
Доказано, что поддержание здоровья сердечно-сосудистой системы в среднем возрасте связано с лучшими когнитивными функциями в пожилом возрасте [83]. Например, считается, что антигипертензивные препараты у пациентов с АГ оказывают профилактическое влияние на когнитивный дефицит в дальнейшей жизни. В частности, недавний метаанализ показал, что антигипертензивные препараты, нацеленные на ренин-ангиотензивную систему, эффективно снижают частоту возникновения сосудистых когнитивных расстройств [84]. Однако причинная связь между АГ и слабоумием сложна и пока не до конца ясна [85]. Еще предстоит изучить, насколько пациентам с сосудистыми когнитивными расстройствами приносит пользу снижение холестерина. Недавний Кокрановский обзор баз данных показал, что статины не предотвращают снижение когнитивных способностей, если их дают в конце жизни людям с высоким риском сосудистых заболеваний [86].
Вторая стратегия профилактики сосудистых когнитивных расстройств заключается в создании церебрального резерва. Концепция церебрального резерва описывает различия между людьми по их способности компенсировать возрастную патологию мозга. Согласно ей, если рассмотреть двух человек с одинаковой степенью невропатологического процесса, приводящего к когнитивному дефекту, то у одного могут иметься клинические признаки деменции, а у другого – нет [87, 88]. Считается, что такая разница связана с их индивидуальным уровнем мозгового резерва, а не выраженностью церебральной патологии. Церебральный резерв включает [89, 90]:
- резерв мозга, связанный с различиями в размерах и структуре мозга, такими как нейрональная и синаптическая плотность;
- когнитивный резерв, обусловленный различием в способностях гибко и эффективно использовать имеющиеся ресурсы мозга в процессе решения познавательной задачи;
- резерв поддержания работы нейрональной сети, относящийся к различной способности инициировать синаптическое восстановление, синаптогенез и нейрогенез.
Эти три компонента работают вместе и поддерживают когнитивный отдых, построенный на жизненном опыте. Доказано, что образ жизни и факторы окружающей среды, особенно те, что стимулируют когнитивные функции, сильно влияют на формирование экспрессии церебрального резерва. Например, повышению мозгового резерва способствуют более высокий IQ, образование, полученное в молодости, знание двух и более языков. Было показано, что билингвизм задерживает начало БА в среднем на 5,1 года [91] по сравнению с монолингвизмом. Считается, что, хотя факторы, повышающие когнитивный резерв, во всех случаях способны отсрочить возраст начала деменции всего на 5 лет, они в тоже время могут резко сокращать общее количество случаев деменции [92].
В целом среди нефармакологических методов профилактики сосудистых когнитивных расстройств наиболее часто рассматриваются следующие:
- коррекция образ жизни (диета, упражнения, здоровая окружающая среда, социальная активность);
- предварительное и последующее поддержание хорошей физической формы;
- повторная транскраниальная магнитная стимуляция и электростимуляция [93, 94];
- когнитивная тренировка;
- замена потерянных из-за инсульта клеток стволовыми клетками – потенциально возможный в будущем вариант терапии [95].
Увеличение мозгового резерва с помощью лекарственных средств наверняка в недалеком будущем станет реальностью. Уже разрабатываются фармакологические агенты, которые могут имитировать когнитивный отдых и повышение когнитивных способностей [96]. Их цель – усилить церебральный резерв, чтобы задержать и/или предотвратить СД и другие расстройства памяти.



