Мировая статистика показывает, что по распространенности колоректальный рак (КРР) находится на третьем месте среди онкологических заболеваний у мужчин (663 000 случаев, 10,0% от общего числа) и на втором месте – у женщин (571 000 случаев, 9,4% от общего числа) [1]. В 2007 г. ожидаемая заболеваемость раком толстой кишки составила 153 760 случаев, а смертность от этого заболевания – 52 180 случаев [2]. Ежегодно ожидаемая заболеваемость составляет 1 032 152 новых случая, смертность – 528 978 случаев [3].
В настоящее время существует совокупность методов и подходов диагностики КРР, разработаны молекулярные маркеры и лабораторные показатели, используемые в клинической практике [4–9]. Однако большая часть из них трудоемка, дорогостояща, труднодоступна из-за необходимости специального оборудования и реактивов. Поэтому поиск подходов скрининга, диагностики КРР на ранних стадиях, оценки эффективности проводимой терапии остается актуальной задачей.
Гипотеза данного исследования основывалась на том, что структурные нарушения протеинов и липопротеинов, развивающиеся в результате канцерогенеза, распространяются за пределы опухолевой клетки в ее микроокружение, включая кровь. При этом происходят изменения в профиле цитокинов, ферментов, других протеинов, что создает положительные условия для развития опухолевой клетки [10]. Возникающее на фоне неопластической трансформации при КРР напряжение эритроидного ростка кроветворения приводит к декомпенсации эритропоэза, изменению состояния мембран эритроцитов, нарушению микрореологических свойств крови, что усиливает явления гипоксии, осложняя течение основного заболевания [10]. При опухолевом росте большое значение может иметь оценка качественного состояния периферического звена эритрона, поскольку изменения структуры мембран и метаболизма, функции эритроцитов периферической крови, как правило, предшествуют изменениям количественных показателей красной крови [11].
По мере утяжеления стадии КРР в сыворотке крови происходят все более выраженные сдвиги, связанные с метаболическими, иммунологическими нарушениями, проявлениями интоксикации, нарушением белоксинтетической функции печени, нарастанием синдромов цитолиза, холестаза, иммуно-воспалительного синдрома (в случаях с наличием метастазов в печень), нарушениями кальциевого обмена. Поскольку между эритроцитами и сывороткой крови происходит постоянный обмен компонентами, эритроциты способны адсорбировать на своей поверхности белки, иммунные комплексы, независимо от их антигенной структуры, взаимодействовать с липопротеинами сыворотки крови, можно ожидать развития выраженных изменений параметров красной крови, нарастающих по мере утяжеления заболевания [11, 12].
Цель исследования: выявить особенности электрических, вязкоупругих параметров эритроцитов, оценить взаимосвязь показателей красной крови с биохимическими параметрами у пациентов с различными стадиями КРР для определения возможностей их использования в диагностике заболевания, оценке эффективности проводимой терапии.
МАТЕРИАЛЫ И МЕТОДЫ
Исследованы эритроциты и сыворотка крови у 36 пациентов (19 женщин и 17 мужчин) в возрасте от 47 до 65 лет с КРР и 20 лиц группы сравнения (условно здоровые) сопоставимого возраста.
Из 36 пациентов у 18 диагностирован рак прямой кишки, у 12 – рак анального канала, у 6 – выявлены первично множественные опухоли (рак сигмовидной и прямой кишки). У 20 пациентов опухоль диагностирована в поздних стадиях (Т3–4), у 16 в стадии Т1–2 (диагноз верифицирован в клинике Областного онкологического диспансера). Гистологически у всех пациентов установлена аденокарцинома. Наличие метастазов (в область печени) выявлено у 8 пациентов, у остальных метастазирование не наблюдалось. Степень вовлеченности лимфоузлов у большей части пациентов была не определена (Nх), у 9 – она соответствовала N1, у одного – N0. 6 пациентов были обследованы в динамике проводимой комбинированной терапии.
Всем больным были выполнены общеклинические, биохимические исследования, проведены рентгеноскопия, колоноскопия с биопсией, ректороманоскопия, ультразвуковое исследование, у 24 была проведена магнитно-резонансная томография органов брюшной полости.
Диагноз был верифицирован на основании результатов клинического, биохимического и инструментальных методов исследования.
В качестве группы сравнения изучали 20 практически здоровых человек, из них 11 мужчины и 9 женщин в возрасте от 35 до 60 лет, средний возраст 47±5 лет, у которых по данным биохимических и инструментальных методов исследования не было выявлено клинически манифестирующих хронических заболеваний внутренних органов, а оцениваемые биохимические и гематологические показатели крови находились в нормальных пределах.
У всех обследуемым изучение биохимических параметров и показателей красной крови проводилось стандартными методами [13].
Обследование было выполнено с одобрения Этического комитета ФГБУ «НИИТПМ» СО РАМН (протокол заседания № 36 от 18.09.2012). Все обследуемые подписали информированное согласие пациента на участие в обследовании.

Электрические, вязкоупругие параметры эритроцитов методом диэлектрофореза изучали в неоднородном переменном электрическом поле с помощью автоматизированной специализированной установки [14]. Оценивали электропроводность клеток, индексы агрегации и деструкции эритроцитов, емкость мембран клеток, скорость движения эритроцитов к электродам, положение равновесной частоты, амплитуду деформации эритроцитов, поляризуемость клеток, обобщенные показатели вязкости и жесткости, величины индуцированного дипольного момента.
Для компьютерной обработки данных использовался пакет оригинальных программ CELLFIND. Ошибка воспроизводимости метода составляла 7–12%.
Статистическая обработка данных была выполнена с использованием программы SPSS, ver. 10. Характер распределения количественных признаков определялся методом Колмогорова–Смирнова. В случае нормального распределения вычислялось среднее значение (М) и стандартная ошибка среднего (m). Достоверность различия показателей оценивали по критериям Стьюдента, Пирсона (при нормальном распределении), в случаях отклонения распределения от нормального использовали непараметрические критерии (U-критерий Манна–Уитни, Колмогорова–Смирнова). Связи между признаками оценивали путем вычисления коэффициента корреляции Спирмена (r). Во всех процедурах статистического анализа критический уровень значимости нулевой гипотезы (p) принимался равным 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При анализе показателей красной крови у пациентов с различными стадиями КРР до и после проведенной терапии отмечено достоверное снижение количества эритроцитов, уровня гемоглобина, среднего содержания, концентрации гемоглобина в эритроците, среднего корпускулярного объема клеток, гематокрита от начальных стадий опухоли к терминальным стадиям и состоянию после проведенной терапии (p<0,001–0,05). Скорость оседания эритроцитов (СОЭ) нарастала от Т1–2 к Т3–4, после проведенной терапии отмечено достоверное снижение СОЭ (табл. 1). Среди возможных патогенетических механизмов влияния опухоли на эритроциты, по мнению ряда авторов, следует назвать аутоиммунные процессы, осуществляющиеся с участием клеток красной крови, нейроэндокринные нарушения, метаболические сдвиги [11, 15, 16].
При анализе биохимических показателей у пациентов с различными стадиями опухоли и после проведенной терапии отмечено снижение уровней общего белка, альбуминов, протромбинового индекса и повышение активности амилазы крови (АМК), щелочной фосфатазы (ЩФ), уровней прямого билирубина, мочевины и глюкозы по мере нарастания стадии заболевания и после курса проведенной терапии (p<0,0001–0,043). Наблюдаемые сдвиги могут быть связаны со снижением синтеза целого ряда соединений в печени (в т.ч. белков сыворотки крови, факторов свертывания и др.) или/и усилением их распада при терминальных стадиях КРР [11, 17].
В отношении уровней активности трансаминаз, общего билирубина, креатинина выявлено нарастание показателей от стадий Т1–2 к Т3–4 (p<0,0001–0,05), после проведенной терапии отмечена тенденция к снижению вышеописанных показателей, не достигающая уровня достоверности (табл. 2). Следует отметить, что наиболее достоверные различия между группами с начальными и терминальными стадиями заболевания продемонстрировал уровень активности АЛТ (p<0,0001), несколько меньше по степени достоверности – уровень активности АСТ, уровень общего белка, протромбиновый индекс (p<0,01) и, наконец, еще в меньшей степени – уровни альбумина и креатинина (p<0,05). Подобные изменения, вероятно, связаны с выраженностью синдрома цитолиза в терминальной стадии и снижением синтетической функции печени; они также могут быть проявлением нарушения функции почек [10, 11]. Стабильность в отклонении биохимических параметров в ходе проведения комбинированного лечения обусловлена, возможно, токсическим действием противоопухолевых препаратов, лучевой терапии [10, 18]. При использовании метода диэлектрофореза для выявления особенностей электрических и вязкоупругих параметров эритроцитов у пациентов с КРР в зависимости от стадии процесса и проводимой терапии обнаружились характеристики эритроцитов, наиболее значимые для верификации диагноза.
По мере утяжеления заболевания у больных КРР отмечено увеличение полиморфизма клеток красной крови: преобладающими в терминальных стадиях оказались шиповидные, сфероцитарные, деструктивные формы эритроцитов с выраженными явлениями анизо-, пойкилоцитоза и анизохромии (p<0,05). Преобладание деформированных клеток отражает истощение внутриклеточного уровня АТФ, что в свою очередь затрудняет транспорт кислорода из эритроцита тканям и усугубляет гипоксию [12].
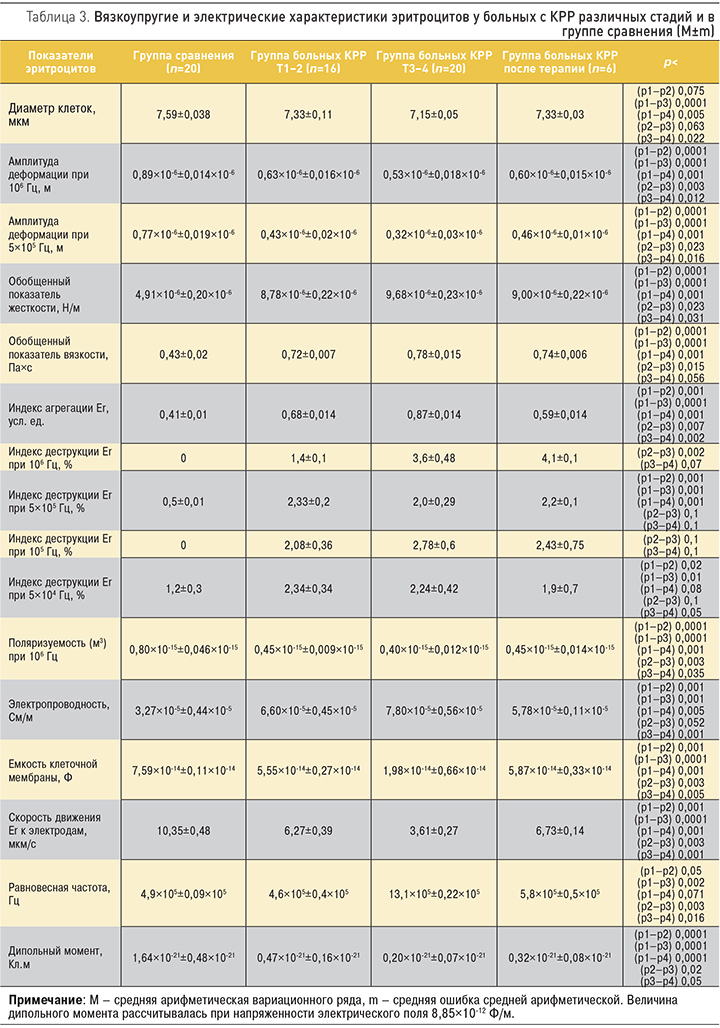
У пациентов с КРР по мере нарастания тяжести заболевания показатели электропроводности, обобщенные показатели жесткости, вязкости, индексы агрегации, деструкции на всех частотах нарастали, а диаметр клеток, амплитуда деформации на высоких частотах (5×105, 106 Гц), поляризуемость мембран на частоте 106 Гц, дипольный момент, электрическая емкость мембран эритроцитов достоверно уменьшались (p<0,0001–0,05; табл. 3). Терминальные стадии опухоли ассоциировались со смещением равновесной частоты в высокочастотный диапазон (p<0,002–0,05). Наиболее достоверные различия в значениях параметров эритроцитов у пациентов с начальными стадиями опухоли от здоровых обследуемых выявлены в отношении амплитуды деформации клеток, обобщенных показателей вязкости и жесткости, поляризуемости на частоте 106 Гц и дипольного момента (p<0,0001). Наиболее значимыми в отношении дискриминирования различных стадий КРР между собой оказались амплитуда деформации эритроцитов и поляризуемость на частоте 106 Гц, емкость мембран, скорость движения клеток к электродам, положение равновесной частоты и уровни агрегации и деструкции на частоте 106 Гц (p<0,002–0,007). Получены обратные корреляции стадии заболевания с амплитудой деформации (r=-0,592; p<0,015), прямые – с обобщенными показателями жесткости (r=0,571; p<0,01) и вязкости эритроцитов (r=0,501; p<0,018), индексом агрегации (r=0,644; p<0,001) и деструкции эритроцитов на высоких частотах (r=0,600; p<0,001).
Наблюдаемые изменения электрических и вязкоупругих параметров эритроцитов, вероятно, связны с изменениями структуры их мембран в связи с адсорбцией крупномолекулярных белков, иммуноглобулинов, иммунных комплексов, которых «экранируют» отрицательный заряд клетки, снижая ее скорость движения к электродам, дипольный момент и емкость мембран [11, 14, 17, 19]. С другой стороны, изменяется состав мембран, происходит перераспределение в их структуре холестерина, фосфолипидов с нарастанием лизофракций, снижается уровень арахидоновой и повышаются уровни олеиновой и стеариновой жирных кислот, что, возможно, сказывается на обобщенном показателе вязкости и электропроводности [11, 12]. Нарастание количества трансформированных клеток под действием опухолевого процесса сопровождается нарушениями ультраструктуры клеток, выражающимися в перераспределении в цитоплазме гемоглобина, усилением образования эндо- и экзовезикул, разрыхлением, уплотнением, деструкцией цитолеммы и т.д., что влияет на обобщенный показатель жесткости и амплитуду деформации [11]. Нарушение формы и снижение деформируемости клеток красной крови, вероятно, возникают в результате разнообразных воздействий на мембрану (гипоксических, иммунных, токсических), имеющих место и при развитии опухолевого процесса [10–12]. Сниженная поляризуемость отражает низкую резистентность клеток красной крови, возможно, на фоне угнетающего влияния опухоли на эритропоэз [15, 18]. Это предрасполагает клетки к гемолизу на разных частотах, что усугубляет склонность к агрегации, микроциркуляторным нарушениям [20]. С другой стороны, неопластический рост сопровождается выраженными серологическими перестройками мембран эритроцитов и появлением в крови аутоантител, которые могут быть причиной гемолитических явлений [21].
Положительная динамика в ходе проводимой противоопухолевой терапии ассоциирована с нарастанием деформируемости эритроцитов на фоне снижения обобщенных показателей вязкости, жесткости, снижением склонности эритроцитов к деструкции, образованию агрегатов, уменьшением электропроводности, толщины мембраны, смещением равновесной частоты в низкочастотный диапазон. Клетки с большей скоростью и возросшим дипольным моментом двигались к электродам, повышалась их резистентность к воздействию стрессов высокой интенсивности (p<0,001–0,05). При этом наиболее быстро реагировали на эффект терапии такие показатели эритроцитов, как поляризуемость, электропроводность, емкость мембран и величина дипольного момента (p<0,001). Улучшение вязкоупругих параметров эритроцитов в процессе лечения снижает выраженность микроциркуляторных нарушений, которые существенно утяжеляют течение основного процесса [10, 18].
Установлены корреляции электрических и вязкоупругих параметров с показателями красной крови и биохимическими параметрами, сила которых нарастала у пациентов в терминальных стадиях КРР. Следует отметить, что количество эритроцитов, уровень гемоглобина высокодостоверно прямо и со значительной силой связи коррелировали с поляризуемостью на частоте 106 Гц (r=0,65; p<0,02; r=0,71; p<0,03) и обратно электропроводностью (r=- 0,57; p<0,01; r=-0,62; p<0,014). Вероятно, данные параметры в большей степени отражают эффективность эритропоэза. Количество эритроцитов оказалось обратно связано с обобщенным показателем жесткости (r=-0,65; p<0,02). Показатель скорости движения эритроцитов был прямо ассоциирован с емкостью мембран эритроцитов (r=0,51, p<0,05).
Показатели, характерные для синдрома цитолиза (повышение активности индикаторных ферментов АСТ, АЛТ), находились в прямой сильной высокодостоверной связи с электропроводностью (r=0,47; p<0,027; r=0,63; p<0,04) и обратной – с поляризуемостью (r=-0,42; p<0,05; r=-0,44; p<0,03). Гипербилирубинемия с повышением как прямой, так и непрямой фракций оказалась прямо связанной с величиной среднего диаметра эритроцитов (для общего билирубина r=0,56; p<0,04; для прямого билирубина r=0,49; p<0,013), уровень непрямого билирубина коррелировал с уровнем гемолиза на высоких частотах (r=0,82; p<0,016). Последнее обстоятельство позволяет оценить вклад гемолиза эритроцитов в уровень непрямого билирубина.
Биохимические проявления синдрома холестаза (повышение активности экскреторных ферментов ЩФ, γ-глутаматтранспептидазы) находились в обратной достоверной связи с емкостью клеточной мембраны (r=-0,51; p<0,03; r=-0,47; p<0,042); повышение уровня общего холестерина было прямо связано с обобщенными показателями жесткости и вязкости клеток (r=0,65; p<0,05; r=0,70; p<0,02). Гипербилирубинемия была ассоциирована с величиной среднего диаметра эритроцитов, как показано ранее.
Синдром печеночно-клеточной недостаточности с проявлениями в виде снижения содержания в сыворотке крови общего белка, особенно альбуминов, протромбина, холестерина оказался обратно достоверно связан с величиной дипольного момента (r=- 0,761; p<0,035), скоростью движения клеток к электродам (r=-0,77; p<0,03), амплитудой деформации эритроцитов (r=-0,631; p<0,037). Подобные ассоциации, вероятно, связаны с постоянным взаимодействием между компонентами сыворотки крови и эритроцитами [12].
ВЫВОДЫ
У пациентов с КРР выявлено снижение количества эритроцитов, уровня гемоглобина, среднего содержания, концентрации гемоглобина в эритроците, среднего корпускулярного объема клеток, гематокрита от начальных стадий опухоли к терминальным.
По мере утяжеления заболевания у больных КРР отмечено увеличение полиморфизма клеток красной крови с выраженными явлениями анизо-, пойкилоцитоза и анизохромии.
Наиболее достоверные различия в значениях параметров эритроцитов у пациентов с начальными стадиями опухоли от здоровых обследуемых выявлены в отношении амплитуды деформации клеток на высоких частотах, обобщенных показателей вязкости и жесткости, поляризуемости на частоте 106 Гц и дипольного момента.
Наиболее значимыми в отношении дискриминирования различных стадий КРР между собой оказались амплитуда деформации эритроцитов и поляризуемость на частоте 106 Гц, емкость мембран, скорость движения клеток к электродам, положение равновесной частоты и уровни агрегации и деструкции на частоте 106 Гц.
Установлены параметры эритроцитов, наиболее чувствительные к проводимой терапии: поляризуемость на высоких частотах, электропроводность, емкость мембран и величина дипольного момента.


