Акромегалия – это хроническое нейроэндокринное заболевание, характеризующееся длительной патологической гиперсекрецией гормона роста (ГР) [1]. В подавляющем большинстве случаев основным источником избыточной продукции ГР является соматотрофная опухоль гипофиза (соматотропинома). В ответ на продукцию ГР в печени вырабатывается инсулиноподобный ростовой фактор 1 типа (ИРФ-1), концентрация которого отражает суммарную продукцию ГР за предшествующие сутки. У пациентов с акромегалией этот показатель значительно превышает половозрастные референсные значения и наравне с ГР используется как для диагностики, так и для контроля над проводимым лечением.
В связи с широкой доступностью гормональных методов диагностики и магнитно-резонансной томографии опухоли гипофиза перестали считать редкими заболеваниями. В исследованиях с активным скринингом частота выявляемости акромегалии составила от 90 до 120 случаев на 1 млн жителей [2, 3], что примерно в 2 раза чаще, чем считалось ранее. Период от возникновения первых признаков заболевания до его диагностики колеблется, по данным разных авторов, от 6 до 10 лет и более [1, 4], что объясняется постепенным развитием и многообразием клинической симптоматики, которая маскируется под другие, более распространенные заболевания: артериальная гипертензия, нарушения сердечного ритма, полиартропатия, различные нарушения углеводного обмена, нарушения дыхания во сне, многоузловой зоб и др. К таким «маскам» относится и поражение желудочно-кишечного тракта (ЖКТ), которое является характерным проявлением акромегалии и встречается у 65–70% больных [5].
В эпидемиологических исследованиях было показано, что при акромегалии уменьшается продолжительность жизни. Если общепопуляционный стандартизированный уровень смертности принять за 1,0, то, по данным мета-анализа 16 крупных исследований, средневзвешенный стандартизированный уровень смертности пациентов с акромегалией составляет 1,72 (95% доверительный интервал (ДИ) 1,62–1,83) [6]. При отсутствии контроля над секрецией ГР и ИРФ-1 среди пациентов с акромегалией, отмечено повышение риска общей смертности на 32% по сравнению с общепопуляционными показателями [7]. Приблизительно 60% больных акромегалией умирают от сердечно-сосудистых заболеваний, 25% – от легочных осложнений и 15% – от онкологических заболеваний (в первую очередь рака толстого кишечника, кожи, щитовидной железы) [8]. Поэтому своевременная диагностика акромегалии является актуальной проблемой.
Международные и федеральные рекомендации по диагностике и лечению акромегалии из всех многообразных клинических проявлений этого заболевания выделяют 12 наиболее характерных:
- сахарный диабет или нарушения углеводного обмена;
- боли в суставах;
- артериальная гипертензия;
- гипертрофия левого желудочка, аритмии, систолическая/диастолическая дисфункция;
- слабость, утомляемость;
- головные боли;
- карпальный туннельный синдром (парестезии);
- апноэ сна (храп с нарушением дыхания);
- избыточная потливость;
- нарушения зрения;
- полипы кишечника;
- прогрессирующие проблемы с прикусом.
При наличии двух симптомов и более рекомендуется определение уровня ИРФ-1 как первого этапа скрининга акромегалии [9]. Конечно, некоторые симптомы являются малоспецифичными, однако следует обращать внимание на возраст пациента и особенности симптоматики: чем моложе пациент и труднее поддаются коррекции те или иные клинические проявления, тем больше оснований для исключения акромегалии.
Одним из наиболее распространенных признаков акромегалии является полипоз кишечника. В одном из первых исследований по оценке состояния толстого кишечника частота полипоза при акромегалии составила 22 против 8% у лиц без акромегалии [10]. В других исследованиях у пациентов с акромегалией полипоз толстого кишечника был обнаружен в 41–53% случаев против 8–14% случаев у лиц без акромегалии [11–14]. Основным местом локализации полипов при акромегалии многие исследователи называют восходящий отдел толстого кишечника [10, 13, 15]; размер полипов обычно больше, чем в общей популяции [15, 16]. Если акромегалия является активной, частота выявления полипов и их способность к озлокачествлению существенно возрастают. В системном обзоре осложнений и заболеваний, ассоциированных с акромегалией, было показано, что при умеренно повышенных концентрациях ИРФ-1 развиваются гиперпластические полипы кишечника, более высокие концентрации ИРФ-1 ассоциированы с аденоматозными полипами [17]. Однако при достижении биохимического контроля над акромегалией полипоз обычно не прогрессирует [16].
Среди 107 пациентов с акромегалией по данным колоноскопии дивертикулез кишечника встречался у 39% (и у 19% из 214 здоровых лиц, сопоставимых по полу и возрасту), долихоколон – у 34%, аденоматозные полипы – также у 34%, и выявлялись при акромегалии в более молодом возрасте, чем в общей популяции [17]. По сравнению с лицами без акромегалии относительный риск развития этих состояний при акромегалии составил: для дивертикулеза кишечника 3,6 (95% ДИ 1,4–5,7), для долихоколона – 12,4 (95% ДИ 6,8–18,0), для аденоматозных полипов – 4,1 (95% ДИ 1,9–6,4). После коррекции по длительности активной фазы заболевания было отмечено, что дивертикулез кишечника ассоциирован с более высокими концентрациями ГР и ИРФ-1 в момент диагностики заболевания (по сравнению с пациентами с акромегалией без дивертикулеза), а долихоколон и аденоматозные полипы – с более высокими концентрациями только ИРФ-1. Это исследование подтвердило необратимое влияние высоких концентраций ГР на коллаген толстого кишечника, что дополнило известные аналогичные эффекты ГР на коллаген суставов и сердечных клапанов [18, 19].
Долихоколон также является характерным симптомом акромегалии, и многими исследователями было отмечено удлинение толстого кишечника, а также изменение его строения [20, 21]. Вероятно, это также является отражением действия избыточных концентраций ГР и/или ИРФ-1 на нижние отделы ЖКТ.
Повышение частоты колоректального рака при акромегалии варьирует по данным различных исследований от 2 до 14 раз [10, 13–16, 22]. Была отмечена прямая зависимость между активностью акромегалии и уровнем смертности от колоректального рака. Предрасполагающими факторами рака толстого кишечника при акромегалии считают множественные кожные поражения, мужской пол, семейный анамнез колоректального рака, а также возраст старше 50 лет.
Мета-анализ 9 крупных исследований по оценке риска колоректальных неоплазий (701 пациент с акромегалией и 1573 здоровых лица) показал [28] увеличение частоты полипов толстого кишечника (23% при акромегалии против 12% у здоровых лиц, относительный риск развития полипов 2,5 (95% ДИ 1,9–3,2), гиперпластических полипов – 3,6 (95% ДИ 2,6–4,9)) и рака толстого кишечника (5% при акромегалии против 1% у здоровых лиц, относительный риск колоректального рака 4,4 (95% ДИ 1,5–12,4)) с тенденцией к более агрессивному течению.
На основании этих наблюдений были сформулированы рекомендации выполнять колоноскопию всем пациентам с акромегалией при выявлении заболевания, а затем с периодичностью каждые 3–4 года у пациентов старше 50 лет, особенно если сохраняется активность заболевания [24, 25].
Сходство структуры эпителия толстого кишечника и желчного пузыря позволило предположить, что при акромегалии также должна быть высокая частота полипов желчного пузыря. При обследовании 31 пациента с акромегалией (14 женщин, 17 мужчин в возрасте от 27 до 76 лет, средний возраст 54,7 года) было подтверждено это предположение: частота полипов желчного пузыря составила 29% при акромегалии и 4,6% – без акромегалии (относительный риск 6,29, ДИ 95% 3,6–10,9). При этом уровни ГР были выше у пациентов с полипами по сравнению с пациентами без полипов (30,8 (10,9–39,1) нг/мл и 8,2 (6,0–16,0) нг/мл соответственно), однако уровни ИРФ-1 существенно не различались [26]. Это первое исследование, которое продемонстрировало повышение выявляемости полипов желчного пузыря при впервые выявленной акромегалии. Необходимы дальнейшие исследования для определения риска карцином желчного пузыря и целесообразности обязательного проведения УЗИ желчного пузыря всем пациентам с акромегалией.
В ходе проспективного наблюдательного исследования с участием 210 пациентов с впервые выявленной акромегалией (111 женщин, 99 мужчин, возраст от 20 до 82 лет) было показано, что относительный риск полипоза кишечника повышается в зависимости от тощакового уровня инсулина. Новообразования кишечника были выявлены у 38,6% пациентов, среди которых были гиперпластические полипы (15,7%), аденоматозные полипы (20%) и аденокарциномы (2,8%). В большинстве случаев полипы были множественные (73% пациентов из числа имеющих новообразования). Уровень инсулина натощак был существенно ниже у лиц без новообразований (16,0±7,5 мкЕд/л) по сравнению c пациентами с гиперпластическими полипами (22,4±8,8 мкЕд/л, р<0,01), аденоматозными полипами (38,0±15,9 мкЕд/л, р<0,0001) и аденокарциномами (59,0±30,6 мкЕд/мл, р<0,0001). Наличие сахарного диабета или нарушения толерантности к глюкозе также было фактором риска неоплазий кишечника [27].
В отношении патологии верхних отделов ЖКТ при акромегалии данных немного. При обследовании когорты больных с акромегалией из Московской области было показано, что частыми симптомами являются эзофагит (24%), несостоятельность кардии (35,8%), гастродуоденит (100%), эрозии желудка (21,7%) [11]. У 27,3% пациентов были выявлены полипы желудка с преимущественной локализацией в антруме. Высокой оказалась частота контаминации Helicobacter pylori (78,5% пациентов: 1 степени – 16,4%, 2 степени – 16,4%, 3 степени – 37,7%). Поражение верхних отделов ЖКТ при акромегалии требует дальнейшего изучения.
Таким образом, акромегалия является заболеванием, ассоциированным с поражением ЖКТ, а также увеличением риска колоректального рака. При выявлении характерных изменений ЖКТ, особенно у лиц молодого возраста, необходимо проводить определение уровня ИРФ-1 в крови для скрининга акромегалии. При подтверждении акромегалии должно обязательно проводиться лечение, направленное на достижение биохимического контроля над заболеванием. Главными целями лечения акромегалии являются достижение контроля над секрецией ГР и ИРФ-1, а также полное или частичное удаление опухоли гипофиза для предотвращения ее дальнейшего роста [25, 28]. Восстановление адекватной секреции ГР и ИРФ-1 является ключевым условием регресса клинических проявлений и снижения уровня смертности. В эпидемиологических исследованиях было показано, что восстановление среднепопуляционной продолжительности жизни у пациентов с акромегалией наблюдается при среднесуточном уровне ГР ≤1–2 нг/мл и содержании ИРФ-1, соответствующем полу и возрасту пациента [8]. Поэтому именно эти показатели ГР и ИРФ-1 являются целевыми в ходе лечения и соответствуют термину «биохимический контроль над акромегалией» [25]. Если уровни гормонов выше целевых, акромегалию называют активной.
Основные методы лечения акромегалии заключаются в воздействии на соматотропную опухоль гипофиза (т.е. первоисточник заболевания) – это нейрохирургическое удаление опухоли или медикаментозное лечение. Особенности соматотропиномы таковы, что даже квалифицированным нейрохирургам, специализирующимся на аденомах гипофиза, радикально удалить эту опухоль гипофиза удается не более чем у 50–60% больных [29]. Поэтому возможности медикаментозного лечения избыточной секреции ГР и ИРФ-1 являются крайне важными для пациентов с акромегалией.
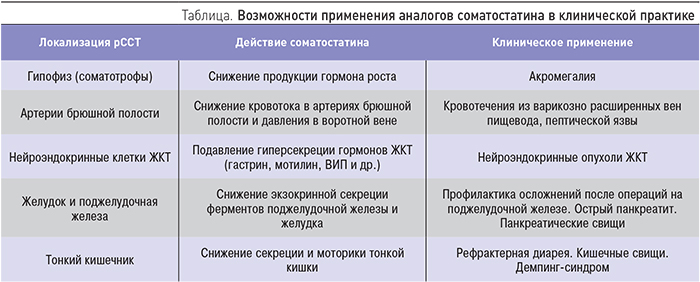
Основными препаратами, использующимися в лечении акромегалии, являются аналоги соматостатина. Соматостатин – природный гипоталамический гормон, который тормозит продукцию ГР гипофизом и пролиферацию соматотрофов. В клинической практике использовать соматостатин невозможно из-за его быстрого ферментного расщепления (период полужизни 2–3 мин), необходимости внутривенного инфузионного введения и феномена «рикошета» (уровень ГР после прекращения введения соматостатина значительно повышается по сравнению с показателями до начала введения). Поэтому были разработаны аналоги соматостатина – октреотид и лантреотид. Молекулы этих веществ несколько изменены, что дает более медленное ферментативное расщепление и высокую избирательность действия по отношению к соматостатиновым рецепторам. В настоящее время выделено 5 типов рецепторов к соматостатину (рССТ). Аналоги соматостатина связываются в основном с 2 типом рССТ, которые присутствует на клетках большинства соматотропином. Кроме гипофиза, рССТ широко присутствуют на нейроэндокринных клетках ЖКТ, что дало возможность применения этой группы препаратов при других патологических состояниях (таблица).
При акромегалии применяют депонированные формы препаратов, которые можно вводить не чаще чем 1 раз в 4 нед. Например, препарат российского производства Октреотид-депо (ЗАО «Фарм-Синтез») представляет собой субстанцию октреотида (в дозе 10, 20, или 30 мг), смешанную с полимерным матриксом с образованием биодеградирующих микросфер. После внутримышечного введения происходит постепенное высвобождение активного вещества из микросфер с последующим полным распадом полимерной основы. При регулярных инъекциях препарата (с периодичностью 1 раз в 28 дней) поддерживается стабильная терапевтическая концентрация активного вещества в крови. Длительный клинический опыт использования депонированных форм аналогов соматостатина при акромегалии показал увеличение продолжительности жизни и улучшение качества жизни пациентов независимо от степени тяжести заболевания. В ходе лечения аналогами соматостатина значительно снижались уровни ГР и ИРФ-1 у 65–70% больных, целевые уровни гормонов достигались примерно у 45–60% больных [30]. Кроме того, примерно у половины больных отмечали значимое уменьшение объема соматотропиномы (в среднем примерно на 50% от исходного объема опухоли) [31]. Опыт применения Октреотид-депо в лечении акромегалии продемонстрировал клиническую эффективность и безопасность, не уступающую зарубежным аналогам, и в плане регресса клинической симптоматики, и по снижению уровней ГР и ИРФ-1, и по туморсупрессивному эффекту [32–34].
Поддержание целевых значений ГР и ИРФ-1 является условием успешного лечения поражений ЖКТ у больных с акромегалией. Поэтому курация таких больных должна проводиться совместно гастроэнтерологом и эндокринологом.



