Cахарный диабет (СД) приобрел характер «неинфекционной» эпидемии, с каждым годом численность больных СД увеличивается. Осложнения, вызываемые диабетом, могут изменить качество жизни пациента, его социальный статус, нередко приводят к инвалидизации. Поражение периферической нервной системы относится к наиболее частым осложнениям СД, оно может сочетаться с другими микрососудистыми осложнениями, такими как ретинопатия и нефропатия, что говорит об общих механизмах их патогенеза. По современным оценкам частота встречаемости диабетической полинейропатии (ДПН) у больных СД составляет в мире от 8 до 80%. ДПН является одним из основных факторов риска развития язвенных дефектов стоп, синдрома диабетической стопы, нетравматических ампутаций. Частота возникновения невропатии зависит не только от продолжительности СД, но и от эффективности его лечения [1].
Любой специалист, занимающийся лечением СД и его осложнений, чаще всего в своей практике встречается с сенсомоторной дистальной полинейропатией. Клинически это может проявляться следующими симптомами: колющие, режущие или дергающие боли, чувство «ползания» мурашек (парастезии), жжение, онемение стоп (как будто человек «отсидел» конечность). На приеме врач сталкивается как с болевыми, так и с безболевыми проявлениями ДПН. Дистальная симметричная локализация болей – характерный признак ДПН, отличающий ее от других видов нейропатии. С течением времени жалобы могут усиливаться и приобретать постоянный характер. Обращаясь к специалисту с характерными жалобами, пациент иногда не в состоянии в полной мере объективно оценить выраженность симптомов, в таких случаях помогает использование шкалы интенсивности болей (0–10 баллов) – визуальной аналоговой шкалы (ВАШ) [2]. На данной шкале пациент самостоятельно указывает силу своей боли, делая отметку. Наличие ≥5 баллов по шкале ВАШ соответствует выраженному болевому синдрому. К сожалению, чаще всего для купирования боли врачами общей практики назначаются нестероидные противовоспалительные препараты, хотя это патогенетически нецелесообразно. Помимо неприятных ощущений, стойкий болевой синдром приводит к развитию депрессии, уменьшению количества белого вещества головного мозга, что, безусловно, требует назначения специального лечения.
 Мы не всегда задумываемся над тем, что именно испытывают наши пациенты. Вот пример того, как человек с длительным стажем СД и нейропатией характеризует свое состояние: «Ноги все время ноют, особенно когда я нажимаю педали машины, ношу туфли или просто долгое время нахожусь на ногах. Все время приходится менять положение ног, приподнимать их, но подошвы все время горят... Постоянная боль чрезвычайно изматывает. Я все время была оптимисткой, но мрачные мысли одолевают все чаще и чаще…».
Мы не всегда задумываемся над тем, что именно испытывают наши пациенты. Вот пример того, как человек с длительным стажем СД и нейропатией характеризует свое состояние: «Ноги все время ноют, особенно когда я нажимаю педали машины, ношу туфли или просто долгое время нахожусь на ногах. Все время приходится менять положение ног, приподнимать их, но подошвы все время горят... Постоянная боль чрезвычайно изматывает. Я все время была оптимисткой, но мрачные мысли одолевают все чаще и чаще…».
Однако даже если пациент ни на что не жалуется, это не означает, что у него нет ДПН. В связи с этим диагностика ДПН должна войти в общую практику.
Стандарты диагностики ДПН [2, 3]:
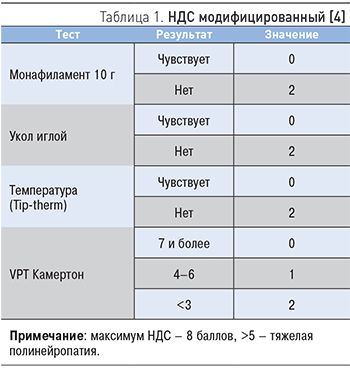
- для оценки изменений тактильной чувствительности применяется монофиламент весом 10 г (5,07 Semmens-Weinstein);
- для оценки болевой чувствительности – укол тыльной поверхности большого пальца специальной иглой с притупленным концом;
- оценку температурной чувствительности проводят при помощи определения разницы в ощущениях тепла и холода инструментом Tip-therm;
- для оценки вибрационной чувствительности используется камертон;
- для оценки нарушения моторной функции проверяют ахилловый и коленный рефлексы.
Целесообразно по полученным данным посчитать модифицированный нейропатический диабетический счет (НДС), который позволит оценить тяжесть состояния пациента (табл. 1).
Для более раннего выявления и детального исследования ДПН применяется стимуляционная электронейромиография с определением скорости проведения импульса по нервному волокну. К современным методам диагностики ДПН также относят корнеальную конфокальную микроскопию и биопсию кожи; последний метод позволяет получить морфологическую картину, количественно отражающую состояние иннервации кожи мелкими нервными волокнами. Показано, что данная методика имеет высокую чувствительность, поскольку изменения выявляются даже у пациентов с нарушением толерантности к глюкозе; у лиц без признаков поражений нервной системы по данным нейромиографии или количественных методов оценки чувствительности, к сожалению, ее проведение в настоящее время затруднено [5]. Корнеальная конфокальная микроскопия – современный неинвазивный метод, дающий точную оценку состоянию нервных волокон роговицы. Процедура занимает около 2 мин, позволяет оценивать состояние тонких нервных волокон организма. Метод является объективным, т.к. дает возможность документировать данные и проводить динамическую оценку. Даже на этапе преддиабета выявляются изменения в количестве и качестве тонких нервных волокон роговицы, тем самым обеспечивается более ранняя и детальная диагностика нейропатии [6].
 После установления диагноза ДПН возникает вопрос, с чего именно следует начинать лечение? Для этого необходимо четко представлять, что лежит в основе патогенеза полинейропатии. Согласно современным представлениям, ключевая роль в патогенезе ДПН принадлежит глюкозотоксичности (хроническая гипергликемия) [1]. Исследование DCCT (Diabetes Control and Complication Trial) показало, что именно гипергликемия ответственна за развитие ДПН. В ходе исследования выявлен феномен метаболической памяти, который имеет выраженный долгосрочный характер; чем лучше контроль гликемии на ранних этапах СД, тем меньше вероятность развития поздних осложнений [1]. Вариабельность гликемии и оксидативный стресс приводят к активизации полиолового пути метаболизма, его результатом является накопление сорбитола и фруктозы, которые способствуют повышению внутриклеточной осмолярности, снижению выработки глутатиона, вследствие чего усиливается окислительный стресс, происходит нарастание тканевой гипоксии, образуются конечные продукты гликирования (AGEs – advanced glycosylationend products) [1, 3, 7]. Они являются этиологическими факторами процесса старения и ряда заболеваний: атеросклероза, болезни Альцгеймера и СД. Наиболее известный из AGEs – гликированный гемоглобин (HbA1c). Гликированный белок теряет свою физиологическую функцию. Структурные изменения стенки сосудов, вызванные АGEs, приводят к развитию микроангиопатии. Вовлечение в процесс vasa nervorum приводит к нарушению питания нервов и является дополнительным фактором возникновения полинейропатии. Также на функцию эндотелия негативно влияет накопление полиолов, AGEs, усиление перекисного окисления липидов. Все это приводит к снижению продукции оксида азота (NO) и, как следствие, к вазоконстрикции. Происходит активизация свертывающей системы крови и тромбоцитов, в итоге развивается дисфункция эритроцитов, проявляющаяся снижением способности к присоединению и высвобождению кислорода, что ведет к развитию тканевой гипоксии [1, 3, 7]. Казалось бы, выхода нет, но сегодня на вооружении у врача имеются уникальные патогенетические препараты, оказывающие антиоксидантное и метаболическое воздействие, к ним относятся α-липоевая (тиоктовая) кислота и витамины группы В [1, 4].
После установления диагноза ДПН возникает вопрос, с чего именно следует начинать лечение? Для этого необходимо четко представлять, что лежит в основе патогенеза полинейропатии. Согласно современным представлениям, ключевая роль в патогенезе ДПН принадлежит глюкозотоксичности (хроническая гипергликемия) [1]. Исследование DCCT (Diabetes Control and Complication Trial) показало, что именно гипергликемия ответственна за развитие ДПН. В ходе исследования выявлен феномен метаболической памяти, который имеет выраженный долгосрочный характер; чем лучше контроль гликемии на ранних этапах СД, тем меньше вероятность развития поздних осложнений [1]. Вариабельность гликемии и оксидативный стресс приводят к активизации полиолового пути метаболизма, его результатом является накопление сорбитола и фруктозы, которые способствуют повышению внутриклеточной осмолярности, снижению выработки глутатиона, вследствие чего усиливается окислительный стресс, происходит нарастание тканевой гипоксии, образуются конечные продукты гликирования (AGEs – advanced glycosylationend products) [1, 3, 7]. Они являются этиологическими факторами процесса старения и ряда заболеваний: атеросклероза, болезни Альцгеймера и СД. Наиболее известный из AGEs – гликированный гемоглобин (HbA1c). Гликированный белок теряет свою физиологическую функцию. Структурные изменения стенки сосудов, вызванные АGEs, приводят к развитию микроангиопатии. Вовлечение в процесс vasa nervorum приводит к нарушению питания нервов и является дополнительным фактором возникновения полинейропатии. Также на функцию эндотелия негативно влияет накопление полиолов, AGEs, усиление перекисного окисления липидов. Все это приводит к снижению продукции оксида азота (NO) и, как следствие, к вазоконстрикции. Происходит активизация свертывающей системы крови и тромбоцитов, в итоге развивается дисфункция эритроцитов, проявляющаяся снижением способности к присоединению и высвобождению кислорода, что ведет к развитию тканевой гипоксии [1, 3, 7]. Казалось бы, выхода нет, но сегодня на вооружении у врача имеются уникальные патогенетические препараты, оказывающие антиоксидантное и метаболическое воздействие, к ним относятся α-липоевая (тиоктовая) кислота и витамины группы В [1, 4].
Альфа-липоевая кислота усиливает поступление глюкозы в пораженные нервные волокна и стимулирует их регенерацию. Она легко проходит не только через гематоэнцефалический барьер, но и через мембрану нервных клеток, после чего метаболизируется в дигидролипоевую кислоту, обладающую более сильным антиоксидантным действием, часть которой возвращается во внеклеточное пространство и может увеличивать через редуксидантный цикл внутриклеточное содержание глутатиона. Последний играет значительную роль в защите от митохондриальных функциональных нарушений и главным образом в защите нервных клеток от свободных радикалов, предотвращая, таким образом, развитие полиневропатии при СД. Внутриклеточный синтез глутатиона имеет большое значение по той причине, что внесенный в организм извне глутатион не способен проникнуть в нервные клетки. Прямой эффект α-липоевой кислоты проявляется в повышении содержания инозитола в нервном волокне, усилении активности фермента Na+/K+-АТФазы, захватывающего свободные радикалы. Под ее воздействием также улучшается кровоснабжение нерва посредством уменьшения сопротивления vasa nervorum. Альфа-липоевая кислота захватывает избыток супероксида, присутствующего в электронных цепях митохондрий, благодаря этому происходит расслабление гладкомышечных волокон в стенке артерий; одновременно с улучшением кровоснабжения нормализуется скорость проведения возбуждения по нервному волокну. Другие эффекты препарата проявляются в снижении апоптоза (запрограммированного отмирания клеток), понижении реактивного глиоза мозговой ткани через уменьшение липидной оксидации и повышение содержания глутатиона [1].
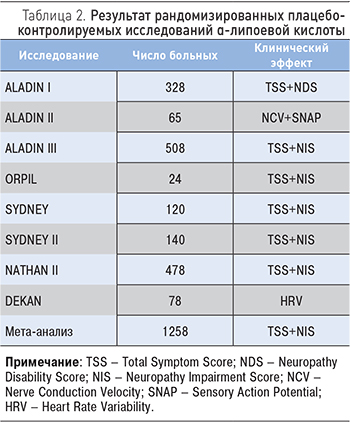
Эффектность применения α-липоевой кислоты показана в многочисленных двойных слепых многоцентровых рандомизированных исследованиях. Впервые влияние этого препарата на периферическую нейропатию оценили в рамках исследования ALADIN [1, 8]. По его результатам, на фоне проведенной терапии в значительной степени улучшились показатели температурной чувствительности и вибрационный порог. Одним из итогов также можно считать равноценную эффективность применения α-липоевой кислоты в дозировках 600 и 1200 мг соответственно. В исследовании SYDNEY [9, 10], которое проводилось в единственном центре, принимали участие 120 пациентов с симптоматической дистальной сенсомоторной нейропатией; на протяжении 14 дней они получали α-липоевую кислоту в дозе 600 мг внутривенно капельно или плацебо. Отмечалось уменьшение боли, жжения, парестезий, онемения. По сравнению с плацебо у пациентов, принимавших исследуемый препарат, наблюдалось значительное улучшение неврологических симптомов, за исключением негативных. В исследовании SYDNEY II [10] Ziegler и соавт. оценивали терапевтическую эффективность перорального приема α-липоевой кислоты у 181 пациента с СД в трех дозировках препарата: 600, 1200 и 1800 мг соответственно на протяжении 3 нед в сравнении с плацебо. На основании полученный результатов авторы считают ежедневную пероральную дозу в 600 мг оптимальной. Следующее исследование – ALADIN II [8], в котором оценивался эффект долгосрочной пероральной терапии α-липоевой кислоты на невропатические симптомы и электронейрофизиологические параметры у пациентов с СД 1 и 2 типов. При приеме препарата в дозе 600 или 1200 мг на протяжении 2 лет в сравнении с плацебо все контролируемые электронейрофизиологические параметры однозначно улучшались, за исключением моторной дистальной латентности большеберцового нерва. Целью 4-месячного исследования DEKAN было изучение влияния α-липоевой кислоты на кардиальную автономную нейропатию у 73 больных с СД. Результаты DEKAN однозначно подтвердили возможность применения препарата для улучшения течения кардиальной автономной нейропатии.
В настоящее время проведен мета-анализ исследований по применению α-липоевой кислоты, который доказал ее эффективность при лечении ДПН. Результаты мета-анализа представлены в табл. 2 [1, 11].
С учетом полученных данных, рекомендуемый курсовой прием α-липоевой кислоты: 600 мг внутривенно капельно № 10 с последующим переходом на пероральную форму в дозе 600 мг утром натощак за 30 мин до еды в течение 2 мес. Лечение необходимо повторять минимум 2 раза в год [1, 2, 11].
Диабетическая нейропатия является главным фактором риска развития таких грозных осложнений СД, как синдром диабетической стопы (приводящий к нетравматическим ампутациям), кардиальная автономная нейропатия (с угрозой остановки сердца, ортостатической гипотонией), бессимптомные гипогликемии, эректильная дисфункция и т.д. Очень важным является не только диагностика, но и патогенетическая терапия этих состояний с применением α-липоевой кислоты на ранних этапах.


