Актуальность проблемы лечения больных артериальной гипертензией (АГ), с одной стороны, связана с ее широкой распространенностью в России, превышающей 40% в популяции, а с другой, со значимостью АГ как важного фактора риска сердечно-сосудистых, цереброваскулярных заболеваний и смертности [1]. Основными целями лечения АГ является достижение целевых цифр артериального давления (АД) и снижение риска сердечно-сосудистых осложнений (ССО). К сожалению, эффективное лечение получают только 53,5% женщин и 41,4% мужчин, страдающих АГ, причем с возрастом эти показатели достоверно уменьшаются [2]. Согласно рекомендациям по диагностике и лечению АГ (2013), пациентам с АГ 2 степени, имеющим высокий и очень высокий риск ССО, исходно может быть назначена полнодозовая комбинированная терапия. При этом около 20% пациентов потребуется использование комбинации из 3-х антигипертензивных препаратов (АГП) и более [1, 2]. Рекомендуется применять рациональные схемы комбинированной антигипертензивной терапии, включающие препараты с взаимодополняющим действием, нивелирующие побочные эффекты друг друга.
К рекомендованным комбинациям 3-х АГП относятся [1]:
- ингибитор ангиотензинпревращающего фермента (иАПФ) + дигидропиридиновый антагонист кальция (АК) + β-адреноблокатор (БАБ);
- блокатор рецепторов ангиотензина II (БРА) + АК + БАБ;
- иАПФ + АК + диуретик;
- БРА + АК + диуретик;
- иАПФ + диуретик + БАБ;
- БРА + диуретик + БАБ;
- АК + диуретик + БАБ.
На сегодняшний день для большинства рациональных комбинаций имеются фиксированные комбинации АГА. Первые такие препараты появились еще в начале 60-х гг. XX в. Их преимуществами являются:
- простота назначения и титрования дозы;
- повышение приверженности пациентов лечению за счет уменьшения количества принимаемых препаратов;
- потенцирование антигипертензивного эффекта;
- обеспечение лучшего органопротективного действия и уменьшение риска ССО;
- увеличение количества пациентов, ответивших на терапию;
- уменьшение частоты побочных эффектов;
- уменьшение стоимости лечения.
Использование фиксированных комбинаций на старте лечения АГ позволяет быстрее достигать контроля АД [3]. Кроме этого, в связи с уменьшением потребности в коррекции терапии снижается количество посещений врача.
По данным мета-анализа 9 исследований степень приверженности лечению с использованием комбинаций с фиксированными дозами АГП на 26% выше, чем при приеме тех же лекарственных средств по отдельности [4]. Результаты исследований и наблюдений в реальной клинической практике показывают, что низкая приверженность пациента с АГ терапии приводит к увеличению риска развития инфаркта миокарда и инсульта.
Несмотря на явные преимущества комбинированной антигипертензивной терапии в отношении достижения целевого уровня АД, 53,7% больных АГ продолжают применять монотерапию, двухкомпонентную комбинированную терапию получают 35,1%, 3 АГП и более принимают только 11,3% больных [5]. Согласно результатам фармакоэпидемиологического исследования Пифагор IV, до 70% врачей предпочитают назначать комбинированную терапию, из них до 52,3% в виде комбинаций с фиксированными дозами [6]. Учитывая все вышесказанное, разработка и внедрение в практику новых комбинированных АГП такого типа для лечения пациентов с АГ остаются актуальными и востребованными. Одной из таких разработок является новый АГП Гипотэф (ОАО «Синтез», Россия).
СОСТАВ ГИПОТэФА
Гипотэф представляет собой низкодозовую комбинацию эналаприла 5 мг, индапамида 0,75 мг, метопролола тартрата 25 мг и винпоцетина 2,5 мг. Все компоненты Гипотэфа уже много лет успешно применяются в медицине.
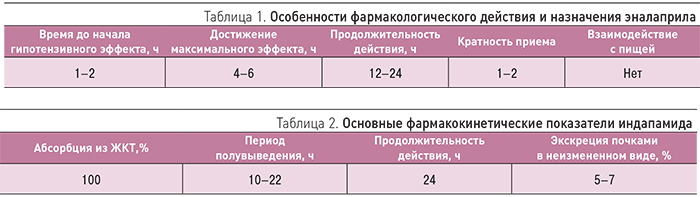
иАПФ эналаприл был синтезирован в 1980 г. Препарат блокирует превращение ангиотензина I в ангиотензин II (АТII), устраняя тем самым его неблагоприятные эффекты. Эналаприл является производным двух аминокислот – L-аланина и L-пролина; относится к «пролекарствам» и в печени превращается в активное вещество – эналаприлат. Его биодоступность составляет 40% и не изменяется при приеме пищи. Максимальная концентрация эналаприлата достигается через 2–4 ч после приема внутрь, период полувыведения составляет 11 ч. При поражении печени или почек увеличиваются время начала и длительность действия [7, 8]. Основные фармакологические свойства эналаприла представлены в табл. 1.
Механизмы действия эналаприла при АГ включают [9]:
- снижение активности ренин-ангиотензин-альдостероновой системы (РААС) с уменьшением образования ATII;
- уменьшение активности симпатоадреналовой системы через блокаду стимуляции АТ1-рецепторов, чувствительных к ATII;
- уменьшение высвобождения эндотелина из сосудистого эндотелия;
- увеличение образования брадикинина и простагландина;
- увеличение почечного кровотока, натрийуреза;
- снижение уровня альдостерона;
- уменьшение инсулинорезистентности и гиперинсулинемии.
Эналаприл имеет обширную доказательную базу при различных сердечно-сосудистых заболеваниях. В ряде исследований была доказана способность длительной терапии эналаприлом улучшать прогноз жизни больных АГ (TOMSH, STOP-Hypertension 2) [10, 11]. Препарат не только эффективно снижает АД (HANE, SLIP) [12, 13], но и обладает доказанным кардиопротективным (CATCH, PRESERVE) [14, 15] и нефропротективным действиями [16]. Поддерживающая доза препарата при АГ составляет 20 мг 1 раз/сут. Максимальная суточная доза – 40 мг/сут.

Второй компонет Гипотэфа – индапамид. Он относится к группе нетиазидных сульфонамидов и по фармакологическим свойствам близок к тиазидоподобным диуретикам. Индапамид снижает тонус гладкой мускулатуры артерий, уменьшает общее периферическое сосудистое сопротивление. Препарат обладает умеренным салуретическим и диуретическим эффектами за счет блокады реабсорбции ионов натрия, хлора, водорода и, в меньшей степени, ионов калия в проксимальных канальцах и кортикальном сегменте дистальных канальцев почек. В сравнении с другими тиазидными диуретиками индапамид обладает рядом преимуществ:
- снижает общее периферическое сосудистое сопротивление, селективно блокируя медленные кальциевые каналы;
- стимулирует синтез простагландина I2 и простагландина Е2, обладающих вазодилатирующими свойствами;
- обладает агонизмом в отношении калиевых каналов;
- не оказывает отрицательного влияния на липидный и углеводный обмены (в т.ч. у пациентов с сопутствующим сахарным диабетом).
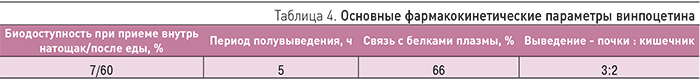
Биодоступность индапамида составляет 93%. Метаболизируется в печени. Период полувыведения в среднем составляет 14–18 ч. Выводится главным образом через почки – 60–80% (преимущественно – в виде метаболитов, около 5% – в неизмененном виде), через кишечник элиминируется 20–23%. У пациентов с почечной недостаточностью фармакокинетика препарата не меняется. В табл. 2 представлены основные фармакокинетические показатели индапамида.
Многочисленный опыт применения индапамида как в монотерапии, так и в составе комбинированного лечения [17–20] свидетельствует о его кардио-, церебро- и нефропротективных эффектах.
Индапамид широко используется в клинической практике, являясь эффективным и метаболически безопасным АГП. Согласно результатам исследования ПИФАГОР IV, получают диуретики 19% пациентов с АГ, при этом лидирующие позиции занимает индапамид [6]. Применяется в суточной дозе 2,5 мг 1 раз/сут утром. Повышать дозу не рекомендуется из-за увеличения риска побочных эффектов без усиления антигипертензивного действия.
Комбинация иАПФ и диуретика является рациональной и патогенетически обоснованной при лечении АГ. иАПФ, блокируя образование АII, устраняют патологическую вазоконстрикцию, подавляют клеточный рост и пролиферацию гладкомышечных клеток сосудов, ослабляют симпатическую активацию, уменьшают задержку натрия и воды. При этом антигипертензивный эффект всех диуретиков ограничен возникающими на фоне их применения реактивной гиперренинемией и вторичной гиперальдостеронемией, связанных с активацией РААС, выраженность которых значительно снижается при одновременном назначении иАПФ. Сочетанное применение иАПФ и диуретика позволяет повысить эффективность обоих препаратов. Дополнительное снижение АД при комбинированной терапии диуретиком и иАПФ также обусловлено тем, что последние потенцируют натрийуретический эффект мочегонных препаратов. Кроме этого, иАПФ предотвращают развитие гипокалиемии.
Комбинация иАПФ + диуретик позволяет достигать целевого уровня АД более чем у 80% больных АГ [21]. Высокая антигипертензивная эффективность данной комбинации сочетается с доказанным разноплановым органопротективным эффектом в виде нефропротекции, уменьшения выраженности гипертрофии левого желудочка, способности восстанавливать нарушенную эндотелиальную функцию [22–25].
Снижение доз АГП в рациональной комбинации приводит к уменьшению частоты возникновения побочных явлений [26, 27].

Значимая роль в патогенезе АГ отводится активации симпатоадреналовой системы. Включение в состав Гипотэфа метопролола является обоснованным и придает данной комбинации дополнительные свойства. Метопролола тартрат относится к жирорастворимым кардиоселективным БАБ без внутренней симпатомиметической активности. Оказывает влияние преимущественно на β1-адренорецепторы сердца, снижает стимулированное катехоламинами образование циклического аденозинмонофосфата (АМФ) из аденозинтрифосфата (АТФ), уменьшает внутриклеточный ток ионов кальция. Метопролол обладает отрицательным батмо-, дромо-, хроно- и инотропным действием (угнетает возбудимость и проводимость, урежает частоту сердечных сокращений, снижает сократимость миокарда). Антигипертензивное действие метопролола тартрата обусловлено:
- снижением сердечного выброса;
- угнетением центральной нервной системы;
- уменьшением образования ренина;
- угнетением активности РААС;
- восстановлением чувствительности барорецепторов дуги аорты (в ответ на снижение АД не происходит усиление их активности),
- уменьшением периферических симпатических влияний.
Метопролол обладает антигипертензивным, антиангинальным и антиаритмическим эффектами. В отличие от неселективных БАБ метопролола тартрат оказывает менее выраженное действие на гладкую мускулатуру бронхов и периферических артерий, высвобождение инсулина, углеводный и липидный обмен [28–30]. Основные фармакокинетические параметры метопролола тартрата представлены в табл. 3.
При почечной недостаточности период полувыведения метопролола увеличивается до 16–27 ч. Экскретируется почками в виде метаболитов. При недостаточности печени метопролол может кумулировать в организме.
На сегодняшний день имеется достаточное количество данных, касающихся эффективности метопролола тартрата при лечении АГ, различных форм ишемической болезни сердца, в т.ч. острого инфаркта миокарда и для вторичной профилактики после перенесенного инфаркта, нарушений ритма сердца [31–35]. При АГ начальная доза составляет 25–50 мг 2 раза/сут. При необходимости дозу возможно постепенно увеличить до 100–200 мг/сут.
Стойкое повышение АД также приводит к поражению сосудов головного мозга, в основном мелких мозговых артерий с развитием микроангиопатий, морфологически проявляющихся аpтеpиосклеpозом или липогиалинозом. Типичным для АГ является обширное поражение глубинного белого вещества больших полушарий, питаемого мелкими пенетpиpующими аpтеpиями, не обеспечивающими достаточного коллатерального кровообращения [36, 37]. Поэтому лечение больных АГ с гипертонической энцефалопатией требует назначения дополнительно к антигипертензивной терапии препаратов с вазоактивными, нейропротективными и метаболическими свойствами. Одним из таких соединений является винпоцетин, в отношении которого имеется достаточный опыт клинического применения (проведено свыше 100 экспериментальных и клинических испытаний с участием более 30 000 пациентов).
 Винпоцетин – это производное винкамина, алкалоида растений рода Барвинок (L. Vinca minor). В 1975 г. винпоцетин стал использоваться для лечения нарушений мозгового кровообращения. Он оказывает вазодилатирующее, антиоксидантное действие, улучшая мозговое кровообращение, активирует метаболические процессы в центральной нервной системе за счет следующих механизмов:
Винпоцетин – это производное винкамина, алкалоида растений рода Барвинок (L. Vinca minor). В 1975 г. винпоцетин стал использоваться для лечения нарушений мозгового кровообращения. Он оказывает вазодилатирующее, антиоксидантное действие, улучшая мозговое кровообращение, активирует метаболические процессы в центральной нервной системе за счет следующих механизмов:
- селективная блокады Са2+-зависимой фосфодиэстеразы; повышение уровней АМФ и циклического гуанозинмонофосфата, концентрации АТФ и соотношения АТФ/АМФ в тканях головного мозга;
- снижение функциональной активности клеточных трансмембранных натриевых и кальциевых каналов, рецепторов NMDA и AMPA;
- повышение количества дофамина и норадреналина с активацией аденилатциклазы;
- увеличение потребления глюкозы и кислорода тканями мозга, стимуляция транспорта глюкозы через гематоэнцефалический барьер; перевод процесса распада глюкозы на энергетически более экономный, аэробный путь;
- усиление обмена норадреналина и серотонина в головном мозге; стимуляция восходящей ветви норадренергической системы;
- увеличение деформируемости эритроцитов и торможение агрегации тромбоцитов, обусловленной повышением образования внутриклеточного цАМФ, который опосредует молекулярные эффекты действия простациклина на тромбоциты, уменьшая вязкость крови;
- увеличение церебрального кровотока; снижение резистентности сосудов головного мозга без существенного изменения показателей системного кровообращения;
- незначительное понижение системного АД за счет блокирования сосудистых норадренергических реакций [37–40].
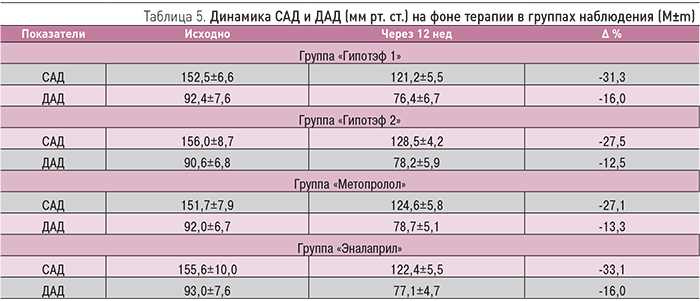
Основные фармакокинетические параметры винпоцетина представлены в табл. 4.
Винпоцетин быстро всасывается из желудочно-кишечного тракта (ЖКТ), главным образом его проксимальных отделов. Максимальная концентрация в плазме крови достигается через 1 ч. Метаболизируется в основном в печени. Некоторой фармакологической активностью обладает метаболит – аповинкаминовая кислота; метаболиты гидроксивинпоцетин, гидроксиаповинкаминовая кислота, дигидроксивинпоцетин-глицинат – неактивны. Начальная суточная доза винпоцетина составляет 15 мг. Средняя суточная доза – 15–30 мг (по 5–10 мг 3 раза/ сут). Максимальная суточная доза – 30 мг. Терапевтический эффект развивается приблизительно через неделю с начала приема препарата. Для достижения полного терапевтического эффекта требуется 2–3 мес.
Согласно результатам ряда исследований, нейропротективная терапия, проводимая в сочетании с правильно подобранной антигипертензивной терапией, способна оказать профилактическое воздействие на развитие гипертонической энцефалопатии или замедлить темп ее прогрессирования [41–43].
Таким образом, Гипотэф является комбинированным АГП, дозы вышеописанных действующих веществ в котором в 2–4 раза ниже средних терапевтических для каждого компонента. Препарат обладает не только антигипертензивным эффектом за счет комплексного воздействия на разные звенья патогенеза АГ, но и церебропротективными свойствами, что расширяет границы показаний для его применения.
ИССЛЕДОВАНИЯ ГИПОТэФА
В 2012 г. клиническая эффективность и безопасность Гипотэфа у пациентов с АГ 1–2 степени тяжести оценивалась в многоцентровом рандомизированном открытом исследовании. Проведение исследования было одобрено этическим комитетом МЗ РФ и локальными этическими комитетами исследовательских центров.
В исследование были включены 120 пациентов с АГ 1–2 степени (84 женщины и 36 мужчин), средний возраст которых составил 56,3±6,42 года. Все пациенты были рандомизироны в 3 группы по 40 человек: 1-я группа получала Гипотэф по 1 таблетке 1 раз/ сут; 2-я группа – метопролола тартрат 50 мг/сут; 3-я группа – эналаприл 20 мг/сут. Статистический анализ проводился в отношении 117 больных (3 пациента не явились на контрольные визиты). Продолжительность исследования составила 12 нед. Пациенты, ранее получавшие антигипертензивную терапию, включались в исследование после недели отмывочного периода.
На 3-й нед лечения при отсутствии достижения целевых цифр АД (<140/90 мм рт. ст.) пациентам 1-й группы дозу Гипотэфа увеличивали до 2-х табл./сут, а пациентам 2-й и 3-й групп дополнительно добавляли 2,5 мг индапамида. Через 6 нед лечения пациенты выводились из исследования при отсутствии адекватного антигипертензивного эффекта. В группе Гипотэфа на 3-й нед лечения увеличение дозы препарата до 2-х табл./ сут потребовалось 14 пациентам. В последующем 8 человек не завершили исследование: 5 больных отказались от участия; у 1 пациента было выявлено нежелательное явление (НЯ), не связанное с проводимой терапией; 1 пациент выбыл по причине неэффективности проводимой терапии 2 таблетки Гипотэфа в сут; у 1 больного отмечено НЯ, связанное с приемом 2 таблеток Гипотэфа. На рис. 1 представлена структура групп наблюдения. В группе метопролола на 3-м визите 9 пациентам потребовалось дополнительное назначение 2,5 мг индапамида, при последующем наблюдении 1 больной был выведен из исследования из-за неэффективности терапии, 1 отказался от участия, 1 не явился на визит, у 1 больного развилось НЯ, не связанное с терапией. В группе эналаприла 16 больным дополнительно потребовалось назначение индапамида 2,5 мг/сут, из них 3 пациента на 4-м визите выбыли из-за неэффективности терапии, 2 пациента не явились на визит, 1 отказался от участия, 2 пациента выбыли из-за развития НЯ.
В итоге в соответствии с протоколом завершили исследование 100 пациентов: их них в 1-й группе – 32, во 2-й – 36, в 3-й – 32 человека. Всем больным проводилось клинико-лабораторное обследование исходно, через 3, 6, 12 нед терапии: общий осмотр, измерение АД в положении сидя, антропометрические данные с расчетом индекса массы тела, показатели биохимического анализа крови, общих анализов крови и мочи, ЭКГ покоя в 12 отведениях. Исходно и через 12 нед лечения проводилось суточное мониторирование АД (СМАД).
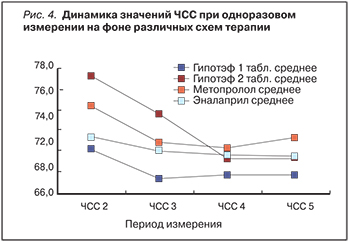
На начало исследования достоверных различий оцениваемых показателей у пациентов групп наблюдения выявлено не было. На фоне проводимой терапии у пациентов всех групп наблюдения регистрировалось постепенное снижение как систолического АД (САД), так и диастолического АД (ДАД; рис 2, 3). Достоверных различий между группами в динамике АД выявлено не было (табл. 5).
Как следует из табл. 5, через 12 нед терапии во всех группах наблюдения величина САД уменьшилась более чем на 25 мм рт. ст., ДАД – более чем на 12,0 мм рт. ст.
Частота сердечных сокращений снизилась у пациентов всех групп наблюдения, однако более выраженная динамика этого показателя была на фоне приема 2-х таблеток Гипотэфа в сут (рис. 4).
По результатам СМАД оценивались следующие показатели: среднесуточные, среднедневные, средненочные САД, ДАД; временной гипертонический индекс; степень ночного снижения АД, вариабельность АД.
Для оценки достоверности различий в изменении соответствующего показателя СМАД использовался метод линейной регрессии с включением величины динамики показателя в качестве зависимой переменной и принадлежности к одной из трех групп в качестве независимой переменной. Пациенты группы «Гипотэф 1» составили референсную группу, по отношению к которой рассчитывались коэффициенты регрессии, а также оценивалась достоверность их различий в группах «Метопролол» и «Эналаприл». Использовался критерий достоверности – 95%. Из 100 пациентов, закончивших исследование, у 84 (84,0%) среднее САД на момент окончания исследования было ниже 125 мм рт. ст., а у 85 (85,0%) – среднее ДАД было ниже 80 мм рт. ст. В группе «Гипотэф 1» частота достижения целевого уровня среднесуточного САД составила 61,5%, в группе «Гипотэф 2» – 71,4%, в группе «Метопролол» – 76,9%, в группе «Эналаприл» – 73,7%. Различия между группами были недостоверны. Частота достижения целевого уровня среднесуточного ДАД составила 69,2% у пациентов группы «Гипотэф 1», 78,6% у пациентов группы «Гипотэф 2», 82,1% у пациентов группы «Метопролол» и 63,2% у пациентов группы «Эналаприл». Сочетанное снижение среднесуточного САД и среднесуточного ДАД до целевых значений наблюдалось у 76 (65%) пациентов из 100. Сравнение значений изменения показателей в каждой паре измерений (начало исследования – окончание исследования) в четырех анализируемых группах показало, что отмеченные различия статистически недостоверны.
Во всех группах к завершению наблюдения произошла нормализация исходно повышенного временного гипертонического индекса. К 12-й нед терапии была отмечена тенденция к уменьшению показателя вариабельности САД у пациентов всех исследуемых групп в дневные и в ночные часы и вариабельности ДАД в ночные часы. Нормализация показателей вариабельности АД является важным критерием при лечении больных АГ, т.к. доказано, что повышенная вариабельность – независимый предиктор поражения органов-мишеней.
У большинства пациентов, включенных в исследование, наблюдали недостаточную степень ночного снижения САД и оптимальный уровень ночного снижения ДАД. Средняя по группам степень ночного снижения АД (СНС АД) исходно составила для САД/ДАД: 7,1±1,6/12,5±2,0 мм рт. ст. в группе «Гипотэф 1»; 9,3±2,4/13,4±2,8 мм рт. ст. – «Гипотэф 2»; 9,1±1,1/13,4±1,4 мм рт. ст. – «Метопролол»; 8,1±1,4/12,2±1,2 мм рт. ст. – «Эналаприл». На фоне проводимой терапии СНС достоверно не изменилась: ∆ варьировала в диапазоне от -1,9 до 1,6 мм рт. ст. Коэффициент N/D, характеризующий равномерность и стабильность 24-часового антигипертензивного эффекта применяемых препаратов, для всех сравниваемых режимов лечения укладывался в диапазон 0,9–1,1 для САД и для ДАД. Различия в значениях показателя в изучаемых группах были недостоверны.
Проводимая терапия хорошо переносилась больными. Анализ безопасности свидетельствует о том, в основной группе частота и тяжесть возникновения НЯ была такой же, как и в группах сравнения. Все НЯ в период проведения исследования были легкой и средней степени тяжести. Так, в группе «Гипотэф 1» частота НЯ, вызванных приемом препарата, составила 0,85%, в группе «Гипотэф 2» – 1,7% (р=0,998), в группе «Метопролол» – 0%, в группе «Эналаприл» – 3,4% (р=0,998). Различия в частоте НЯ в группе «Гипотэф 1» в сравнении с частотой НЯ в других группах статистически незначимы.
ВЫВОДЫ
Таким образом, результаты проведенного исследования свидетельствуют о высокой антигипертензивной активности препарата Гипотэф, сравнимой с таковой АГП сравнения – эналаприла 20 мг/сут и метопролола тартрата 50 мг/сут (± индапамид 2,5 мг/ сут). Гипотэф оказывал равномерный, длительный антигипертензивный эффект с достижением целевых цифр АД без использования максимальных доз препаратов. Нарастание антигипертензивного эффекта терапии Гипотэфом происходило постепенно, достигая максимума к 12-й нед лечения. Плавное снижение АД хорошо переносилось пациентами, не вызывая появление симптомов гипотонии даже при значительном снижении АД (максимально до -31,3/-16 мм рт. ст. за 12 нед лечения). Низкодозовая комбинация в препарате Гипотэф позволяет достичь целевых уровней АД и избежать возникновения тяжелых НЯ. За счет разностороннего влияния на органы-мишени длительный прием препарата должен оказывать органопротективный эффект, что требует дальнейшего изучения. Удобный прием препарата – 1 таблетка 1 раз/сут, а при недостаточном эффекте 2 табл./сут – позволит повысить приверженность пациента терапии.



