Хроническая обструктивная болезнь легких (ХОБЛ) – хроническое воспалительное заболевание легких, характеризующееся стойким, прогрессирующим ограничением скорости воздушного потока, связанным с повышенным воспалительным ответом легких на действие патогенных частиц и газов (GOLD, 2017) [1]. В настоящее время в традиционной классификации степени тяжести бронхообструкции у пациентов с ХОБЛ в качестве маркера используется объем формированного выдоха за 1-ю с (ОФВ1). Однако, как показано в некоторых исследованиях, он не имеет самостоятельного прогностического значения в отношении тяжести течения ХОБЛ [2, 3]. Поэтому в классификации GOLD (2014) в качестве показателей, определяющих гетерогенность течения ХОБЛ, наряду с ОФВ1 дополнительно использованы оценка выраженности одышки по опросникам mMRC или CAT и частота обострений заболевания в течение 12 мес [1]. Представленные подходы также не учитывают в полной мере всю совокупность индивидуальных особенностей клинико-функциональной характеристики пациента с ХОБЛ [3, 5]. Учеными была также предпринята попытка введения в клиническую практику понятия «фенотип» в качестве персонифицированного критерия для характеристики гетерогенности заболевания, степени тяжести и динамики его течения [6]. Но в этих классификационных подходах не учитывается роль микробиотических сообществ респираторного тракта, тогда как, по данным многочисленных исследований, бактериальные и вирусные инфекции вносят важный вклад в патогенез ХОБЛ [7, 8]. Бактериальная колонизация дыхательных путей влияет на характер и прогноз течения заболевания, а состав респираторной микробиоты – на терапевтический подход к ведению этих больных [9–12]. Однако работ, посвященных изучению роли вариабильности бактериальной орофарингеальной контаминации в зависимости от особенностей течения заболевания, по-прежнему мало. В связи с этим идентификация бактериального состава сообщества микроорганизмов дыхательных путей у больных ХОБЛ в зависимости от степени тяжести и фенотипа заболевания остается важной темой дальнейших научных исследований, новым путем к персонализированной медицине.
 Цель исследования: установить характер вариабильности орофарингиальной микробиоты у пациентов с различными клинико-функциональными особенностями течения ХОБЛ.
Цель исследования: установить характер вариабильности орофарингиальной микробиоты у пациентов с различными клинико-функциональными особенностями течения ХОБЛ.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование были включены 98 пациентов с ХОБЛ. Средний возраст составил 57 (50–63) лет. Все участники исследования имели подтвержденный согласно критериям GOLD диагноз ХОБЛ [1] и стаж курения более 10 лет. На протяжении 4-х нед, предшествовавших включению в исследование, у них не были зарегистрированы обострения ХОБЛ.
Исследование включало два визита пациентов. Во время первого визита всем больным проводилось объективное клиническое обследование со сбором анамнеза. Толерантность к физической нагрузке определялась при проведении 6-минутного шагового теста. Степень одышки оценивалась по шкале mMRS. Всем пациентам проводилось исследование функции внешнего дыхания с бронхолитической пробой (ФВД); общая бодиплетизмография, исследование диффузионной способности легких (DL CO). Исследование проводили на оборудовании MasterScreen Body (Erich Jaeger, Германия). Полученные данные сопоставляли с должными величинами, рассчитанными по формулам, рекомендованным Европейским респираторным и Американским торакальным обществами [13]. У всех больных во время первого визита взяты орофарингеальные мазки.
Во время второго визита всем больным проводилось объективное клиническое обследование с оценкой частоты обострений в течение последних 12 мес. Определялась толерантность к физической нагрузке, оценивалась степень одышки по шкале mMRS, проводилось исследование ФВД с бронхолитической пробой, выполнялась оценка динамики течения ХОБЛ за 12 мес наблюдения, учитывающая степень одышки, толерантность к физической нагрузке, постбронходилатационное значение ОФВ1 и количество обострений (GOLD, 2014). Динамика заболевания считалась отрицательной, если при повторном обследовании пациент был отнесен к страте ХОБЛ (А-В или С-D) с более тяжелым течением.
Пациенты стратифицированы по степени тяжести заболевания и фенотипам следующим образом:
- 1-й тип стратификации: на основании классификации ХОБЛ по степени тяжести 98 пациентов основной группы разделены на две страты (ОФВ1 ≥50% от должного) и (ОФВ1 <50% от должного). 67 пациентов с ХОБЛ вошли в страту с ОФВ1 ≥50% и 31 пациент – в страту с ОФВ1 <50%.
- 2-й тип стратификации: на основании интегральной оценки степени нарушения функции легких по данным спирометрии, выраженности одышки и частоте обострений 98 пациентов основной группы разделены на страты А-B и C-D. К страте А-В отнесены пациенты, которые имели ОФВ1 ≥50% от должного и менее 2-х обострений ХОБЛ в год. К страте С-D были отнесены пациенты, которые имели ОФВ1 <50% от должного и 2 обострения ХОБЛ и более в год. Количество пациентов в страте А-В (пациенты с ОФВ1 ≥50% и с количеством обострений в течение года менее 2-х) составило 47 человек, в страте C-D (пациенты с ОФВ1 <50% и с количеством обострений в течение года 2 и более) – 51.
- 3-й тип стратификации: на основании клинико-функциональных критериев, полученных в результате расширенного обследования при первом визите, во время которого методом случайной выборки сформирована группа из 64 пациентов, стратифицированных по трем фенотипам: «хронический бронхит», «эмфизема» и «смешанный». К фенотипу «хронический бронхит» отнесены пациенты, у которых ведущим клиническим симптомом являлся кашель с мокротой, при аускультации выслушивалось жесткое дыхание, хрипы, при проведении компьютерной томографии органов грудной клетки (КТ ОГК) преобладали признаки бронхита, при исследовании диффузионной способности легких показатели имели нормальные значения. К фенотипу «эмфизема» отнесены пациенты, у которых ведущим клиническим симптомом являлась одышка, кашель носил незначительный характер, при аускультации выслушивалось ослабленное везикулярное дыхание с единичными хрипами, при проведении КТ ОГК выявлялась эмфизема легких, при исследовании диффузионной способности легких имело место ее снижение. К «смешанному» фенотипу отнесены пациенты, у которых на основании данных, полученных в ходе расширенного обследования, не выявлялось преобладания клинических признаков бронхита или эмфиземы.
 Больные ХОБЛ были разделены по фенотипам следующим образом: 30 больных – с фенотипом «хронический бронхит», 14 – с фенотипом «эмфизема», 20 – со «смешанным» фенотипом.
Больные ХОБЛ были разделены по фенотипам следующим образом: 30 больных – с фенотипом «хронический бронхит», 14 – с фенотипом «эмфизема», 20 – со «смешанным» фенотипом.
Орофарингеальные образцы всех больных подвергнуты секвенированию по последовательностям 16SрРНК генов согласно протоколу 16S Metagenomic Sequencing Library Preparation, рекомендованному Illumina для секвенатора MiSeq (США). Фильтрация ридов по качеству и их таксономическая классификация по базе данных 16SрРНК генов Greengenesv.13.5 проведена с помощью байесовского классификатора и программного комплекса QIIME.
Качественные данные представлены в виде абсолютных или относительных (%) частот; количественные с учетом вида распределения данных: при распределении, отличном от нормального, – в виде медианы [Q25; Q75]; при нормальном распределении – в виде М±SD, где М – среднее арифметическое, SD – стандартное отклонение.
Статистический анализ выполнен на языке программирования R, версия 3.1.0. Для нахождения таксономических различий между группами образцов стратифицированных по различным критериям на уровне операционной таксономической единицы (OTU) использован метод, основанный на линейном регрессионном анализе и скорректированный под метагеномные данные, реализованный в пакете metagenomeSeq [14]. Для улавливания значимых трендов в изменении микробиоты на уровне родов и видов под влиянием частоты обострений и госпитализаций, выраженности одышки использована обобщенная линейная модель, позволяющая анализировать непрерывные регрессоры (generalised linear model, GLM), пакет glm2 с распределением, отличным от нормального. Модель применена в предположении Пуассоновского распределения величин [15].
 РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для оценки таксономического состава микробиоты орофарингеальной области у больных ХОБЛ основной группы в зависимости от степени тяжести заболевания проведен сравнительный анализ представленности бактериальных родов в страте с ОФВ1 ≥50% и в страте с ОФВ1 <50%. Полученные данные показали, что высокопредставленными родами микроорганизмов, составивших от 2 до 10% в бактериальной структуре орофарингеальных образцов, явились Streptococcus, Prevotella, Veillonella и Fusobacterium. С целью обнаружения низкопредставленных таксонов, составивших менее 2% в бактериальной структуре орофарингеальных образцов, использован пакет приложений metagenomeSeq. Установлено, что орофарингеальной микробиоте больных ХОБЛ, входивших в страту с ОФВ1 ≥50%, в сравнении с образцами пациентов, входящих в страту с ОФВ1 <50%, на фоне снижения представленности Prevotella melaninogenica свойственно более высокое содержание Brevibacterium aureum и представителей родов Scardovia, Lachnospiraceae, Veillonellaceae, Coprococcus, Gemellaceae, Haemophilus, Moryella, Dialister, Paludibacter, Leptotrichiaceae (табл. 1)
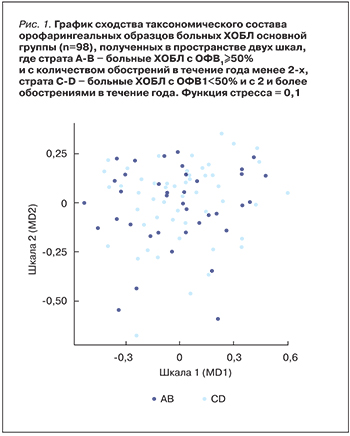
Проведена сравнительная оценка таксономического состава микробиоты орофарингеальной области у больных ХОБЛ основной группы с различной степенью тяжести заболевания с использованием другой стратификации на основании интегральной оценки степени нарушения функции легких по данным спирометрии, выраженности одышки и частоты обострений. С этой целью выполнен анализ таксономического состава образцов мазков ротоглотки с использованием метода многомерного шкалирования (MDS) по метрике Bray–Curtis, где каждая точка соответствует 1 образцу. Чем точки ближе расположены друг к другу, тем ближе бактериальные составы этих образцов (рис. 1). Как видно на рис. 1, при сравнении бактериального состава образцов, полученных от больных ХОБЛ с разной степенью тяжести заболевания, существенные различия не выявлены.
Наиболее чувствительной классификацией ХОБЛ, позволяющей прогнозировать тяжесть течения заболевания и характеризующей ее гетерогенность, в последнее время считают классификацию по фенотипам [3, 5, 16, 17] и классификации с включением шкал многокомпонентной оценки тяжести состояния больных (индекс BODE) [4]. При проведении сравнительного анализа бактериального состава орофарингеальных образцов у больных с различными фенотипами ХОБЛ («хронический бронхит», «эмфизема» и «смешанный») выявлено, что больные со «смешанным» фенотипом имели наиболее тяжелое, прогрессирующее течение заболевания в сравнении с другими фенотипами: ОФВ1 48 (45;49) % от должного, количество перенесенных обострений в течение года 5 (3,8; 5), индекс BODE 5 (4; 6) баллов. Данные представлены в виде медианы [Q25; Q75]. Сопутствующая патология была выявлена у 16 пациентов (80%) со «смешанным» фенотипом, 12 (70,6%) с данным фенотипом имели отрицательную динамику заболевания (р<0,05).
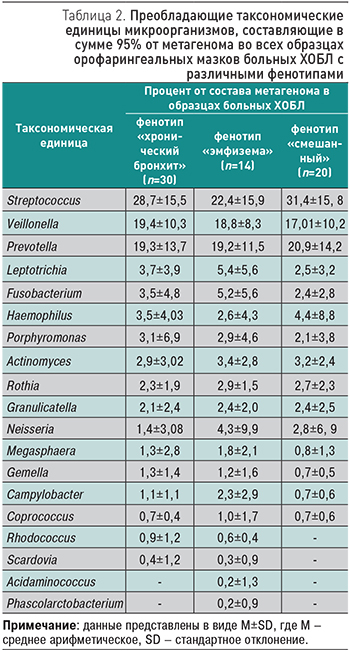
 По результатам сравнительного анализа бактериального состава орофарингеальной микробиоты больных с фенотипами «хронический бронхит», «эмфизема» и «смешанный» фенотип наиболее представленными родами микроорганизмов со значением 10% и более в структуре всего микробиома были роды Streptococcus, Veillonella и Prevotella. Наиболее представленными родами микроорганизмов со значением от 2 до 10% в структуре орофарингеального микробиома во всех стратах больных были роды Fusobacterium, Leptotrichia, Haemophilus, Porphyromonas, Actinomyces, Rothia. Также продемонстрировано, что у пациентов с фенотипами «эмфизема» и «смешанный» бактерии рода Neisseria составляли более 2% в структуре всего микробиома. Однако у пациентов с фенотипом «хронический бронхит» их процент был ниже 2%. У пациентов с фенотипами «эмфизема» в сравнении с двумя другими фенотипами выявлено содержание Campylobacter более 2% в структуре орофарингеального микробиома (табл. 2). Из представленных в табл. 2 данных видно, что орофарингеальное сообщество микроорганизмов у больных ХОБЛ вне зависимости от фенотипа заболевания сохраняло относительную стабильность бактериального состава.
По результатам сравнительного анализа бактериального состава орофарингеальной микробиоты больных с фенотипами «хронический бронхит», «эмфизема» и «смешанный» фенотип наиболее представленными родами микроорганизмов со значением 10% и более в структуре всего микробиома были роды Streptococcus, Veillonella и Prevotella. Наиболее представленными родами микроорганизмов со значением от 2 до 10% в структуре орофарингеального микробиома во всех стратах больных были роды Fusobacterium, Leptotrichia, Haemophilus, Porphyromonas, Actinomyces, Rothia. Также продемонстрировано, что у пациентов с фенотипами «эмфизема» и «смешанный» бактерии рода Neisseria составляли более 2% в структуре всего микробиома. Однако у пациентов с фенотипом «хронический бронхит» их процент был ниже 2%. У пациентов с фенотипами «эмфизема» в сравнении с двумя другими фенотипами выявлено содержание Campylobacter более 2% в структуре орофарингеального микробиома (табл. 2). Из представленных в табл. 2 данных видно, что орофарингеальное сообщество микроорганизмов у больных ХОБЛ вне зависимости от фенотипа заболевания сохраняло относительную стабильность бактериального состава.
Однако при детальном анализе данных в представленных выше таблицах, несмотря на отсутствие явной кластеризации образцов по фенотипам ХОБЛ, обращает на себя внимание меньшее таксономическое разнообразие орофарингеальной микробиоты у пациентов со «смешанным» фенотипом. Количество микроорганизмов, составляющих менее 2% орофарингеальной микробиоты у пациентов со «смешанным» фенотипом, представлено четырьмя основными родами: Megasphaera, Campylobacter, Coprococcus, Gemella, что в сумме составило 3,8% от всего микробиотического состава по образцам данного фенотипа (табл. 2), тогда как у пациентов, входящих в страты с фенотипами «хронический бронхит» и «эмфизема», количество микроорганизмов, составляющих менее 2% орофарингеальной микробиоты, представлено семью родами. Это составляет 6,7% от всего микробиотического состава по орофарингеальным образцам пациентов фенотипа «хронический бронхит» и 8,8% от всего микробиотического состава по орофарингеальным образцам пациентов фенотипа «эмфизема» (табл. 2).
Таким образом, орофарингеальная микробиота больных ХОБЛ вне зависимости от тяжести течения и клинико-фенотипических особенностей заболевания сохраняет относительную стабильность бактериального состава, демонстрируя при этом ряд существенных различий в соотношении ее представителей при определенных клинико-функциональных особенностях течения заболевания при использовании классификации ХОБЛ по фенотипам.
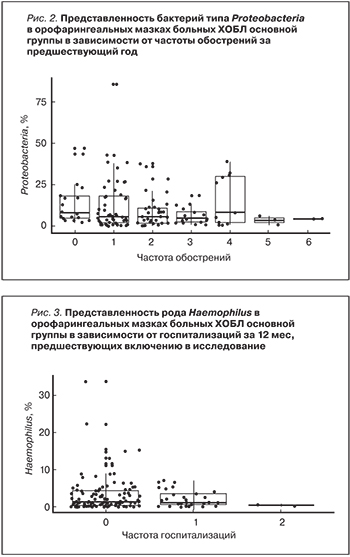
 Учитывая, что, по данным литературы, одними из важных факторов, обусловливающих летальность, тяжесть и прогрессирующий характер течения ХОБЛ являются частота обострений в течение года и выраженность одышки [8, 9], мы оценили вариабельность состава орофарингеальной микробиоты в зависимости от этих показателей. Для оценки модификации микробиоты орофарингеальной области под влиянием частоты обострений применен метод обобщенных линейных моделей. В результате проведенного анализа выявлено, что орофарингеальным мазкам пациентов с ХОБЛ с частыми обострениями в течение года свойственно уменьшение содержания бактерий рода Proteobacteria (КЗ = -0,07; р=0,002) (рис. 2).
Учитывая, что, по данным литературы, одними из важных факторов, обусловливающих летальность, тяжесть и прогрессирующий характер течения ХОБЛ являются частота обострений в течение года и выраженность одышки [8, 9], мы оценили вариабельность состава орофарингеальной микробиоты в зависимости от этих показателей. Для оценки модификации микробиоты орофарингеальной области под влиянием частоты обострений применен метод обобщенных линейных моделей. В результате проведенного анализа выявлено, что орофарингеальным мазкам пациентов с ХОБЛ с частыми обострениями в течение года свойственно уменьшение содержания бактерий рода Proteobacteria (КЗ = -0,07; р=0,002) (рис. 2).
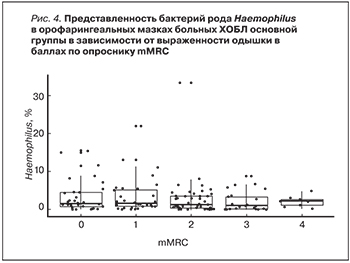
Установлена статистически значимая положительная взаимосвязь ассоциированных с обострениями госпитализаций и степенью обсемененности орофарингеальных мазков бактериями рода Actinomyces (КЗ=0,33; р=0,01). Также пациентам с высокой частотой госпитализаций было свойственно низкое содержание в орофарингеальной микробиоте бактерий рода Haemophilus (КЗ=-0,43; р=0,01) (рис. 3).
При проведении регрессионного анализа методом обобщенных линейных моделей установлена статистически значимая взаимосвязь между степенью выраженности одышки и составом орофарингеальной микробиоты. Так, пациентам с выраженной одышкой, оцененной по опроснику mMRC, свойственна меньшая обсемененность орофарингеальных образцов бактериями типа Proteobacteria (КЗ=- 0,09; р=0,001) и бактериями рода Haemophilus (КЗ= -0,15; р=0,01) (рис. 4).
Представленные данные свидетельствуют о том, что, хотя орофарингеальная микробиота у больных с различной тяжестью течения ХОБЛ сохраняет стабильность качественного состава микроорганизмов, составляющих 95% от всего метагенома, отмечается изменение ее качественного и количественного состава у пациентов с частыми обострениями и госпитализациями. Полученные сведения не противоречат результатам международных исследований. Так, Y.J. Huang и соавт. (2010) продемонстрировали связь высокой частоты обострений ХОБЛ и обсемененности бронхиального дерева Haemophilus influenzae, Moraxella catarrhalis (тип Proteobacteria), Streptococcus pneumoniae или Pseudomona saeruginosa (тип Proteobacteria) [18].
ЗАКЛЮЧЕНИЕ
Недавние исследования пациентов с ХОБЛ показали вариабильность орофарингеальной микробиоты. Так, Hana Yi и соавт. разделили полученные орофарингеальные микробные сообщества на типы с кластерами доминирования бактериальных родов. У пациентов с ХОБЛ выявлялось нарушение микрофлоры с преобладанием Moraxella, Haemophilus или Klebsiella [12]. Полученные в ходе этого исследования данные подтверждены в работе E.S. Charlson и соавт. Авторы продемонстрировали, что в орофарингеальной микробиоте пациентов с ХОБЛ преобладают Haemophilus, Moraxella и определенные группы родов Streptococcus [19]. Однако результаты этих исследований обеспечивают первое представление о метагеномных изменениях, связанных с вариабильностью орофарингеальной микробиоты у больных ХОБЛ, не демонстрируя различий бактериального состава орофарингеальной микробиоты у больных с разными клинико-функциональными особенностями течения ХОБЛ [20].
Результаты проведенного нами исследования показали относительную стабильность состава орофарингеальной микробиоты у больных с ХОБЛ вне обострения заболевания. В то же время выявлен ряд существенных отличий в соотношении ее различных представителей в зависимости от клинико-функциональных особенностей течения заболевания, включая частоту развития обострений, выраженность одышки и фенотип ХОБЛ. Полученные в ходе нашей работы данные, бесспорно, нуждаются в дальнейшем обсуждении и подключении новейших омиксных технологий.



