Избыточный вес (индекс массы тела [ИМТ] >25 кг/ м2) и ожирение (ИМТ >30 кг/м2) – чрезмерные жировые отложения, наносящие вред здоровью. По данным Всемирной организации здравоохранения (ВОЗ), более 1,9 млрд взрослых старше 18 лет имеют избыточный вес, из них свыше 600 млн страдают ожирением (диагноз E66 по МКБ-10) [1]. Инсулинорезистентный синдром (или метаболический синдром, МС) – одно из наиболее распространенных состояний, ассоциированных с ожирением, является предшественником диабета. МС (диагноз E88.81 по МКБ-10, диагноз 277.7 по МКБ-9) подразумевает увеличение массы висцерального жира, сопровождающееся рядом характерных нарушений углеводного, липидного, пуринового обмена, артериальной гипертензией (АГ) и снижением чувствительности периферических тканей к инсулину. Помимо центрального ожирения, жировой инфильтрации печени и скелетных мышц, МС сопровождается нарушениями гомеостаза магния, повышенным системным воспалением, признаками асептического воспаления гипоталамуса, нарушениями циркадного ритма и эпигенетического метилирования ДНК [2].
Предложено несколько вариантов диагностических критериев МС; наиболее широко используются критерии Международной федерации по диабету, критерии ВОЗ и критерии NCEP-III (National Cholesterol Education Program) [3, 4]. В соответствии с критериями ВОЗ (1999), МС диагностируется при наличии одного из следующих расстройств углеводного метаболизма: сахарный диабет (СД) 2 типа, глюкозотолерантность, повышение глюкозы натощак, инсулинорезистентность; любых двух из следующих признаков [4]: артериальное давление (АД) ≥140/90 мм рт. ст., дислипидемия: триглицериды (ТГ) ≥1,695 ммол/л, холестерин ≤0,9 ммоль/л для мужчин и ≤1,0 ммоль/л для женщин, центральное ожирение: отношение талия:бедро > 0,90 для мужчин и >0,85 для женщин или ИМТ>30 кг/м2, микроальбуминурия: альбумин в моче ≥20 мкг/мин или отношение альбумин:креатинин ≥30 мг/г.
В ряде цитируемых далее крупных эпидемиологических исследований используются критерии МС в соответствии с NCEP-III [5]: абдоминальное ожирение (окружность талии у мужчин >102 см, у женщин >88 см), повышенные уровни ТГ (≥150 мг/ дл), низкие уровни липопротеидов высокой плотности (ЛПВП) <40 50="" 130="" 85="" 110="" p="">
Результаты фундаментальных и клинических исследований показали, что МС ассоциирован с дефицитами различных микронутриентов: магния, цинка, витамина С, витамина А, которые играют важные роли в активации и функции витамина D. Дефициты этих микронутриентов, особенно сочетанные, стимулируют развитие таких компонентов МС, как нарушение толерантности к глюкозе, дислипидемия и ожирение [6, 7]. Магний является одним из важнейших биоэлементов, имеющих принципиальное значение для поддержания метаболических функций в организме. Данные экспериментальных, клинических и эпидемиологических исследований указывают на то, что достаточное потребление магния из пищи и препаратов магния способствует нормализации чувствительности тканей и клеток к инсулину [8], уменьшению выраженности проявления компонентов МС [9, 10]. В эксперименте кормление животных фруктозой провоцировало развитие различных компонентов МС, включая инсулинорезистентность и глюкозотолерантность. Обогащение диеты магнием приводило к улучшению чувствительности к инсулину, снижению гипергликемии, гиперлипидемии и перекисного окисления липидов [11].
С физиологической точки зрения, магний требуется для осуществления энергетического метаболизма – процессов расщепления белков, жиров и углеводов и превращения их в АТФ. Среди 720 известных в настоящее время магний-зависимых белков протеома человека более 310 участвуют в метаболизме АТФ. В частности, магний необходим для передачи сигнала от рецепторов инсулина и для эффективного расщепления глюкозы [12]. В настоящей работе представлены результаты систематического анализа молекулярных механизмов взаимосвязи между дефицитом магния, пиридоксина и МС.
ПАТОФИЗИОЛОГИЧЕСКИЕ КОМПОНЕНТЫ МЕТАБОЛИЧЕСКОГО СИНДРОМА И МАГНИЙ
Патофизиология МС достаточно сложна. На формирование инсулинорезистентности и МС оказывают влияние как экзогенные, так и эндогенные факторы. К экзогенным факторам относят: снижение физической активности, высокоуглеводный характер питания и потребление избыточного количества животных жиров, недостаток биологически активных веществ в пище (в частности, магния, витаминов группы В, витамина D). К эндогенным факторам относят гормональные нарушения (повышение кортизола, повышение тестостерона и андростендиона у женщин, снижение прогестерона, снижение соматотропного гормона, нарушения катехоламинового баланса), асептическое воспаление гипоталамуса и нарушения метаболизма висцеральной жировой ткани (абнормальные изменения интенсивности липолиза и липонеогенеза, изменение эндокринных функций самой жировой ткани, которая выделяет в кровоток лептин, адипонектин и фактор некроза опухоли-α) [1].
Магний является важным медиатором как углеводного, так и липидного метаболизма, поэтому его пониженный уровень в плазме крови связан с более яркой выраженностью компонентов МС. Например, наблюдения за группой из 117 пациентов с избыточным весом и ожирением показали, что чем ниже были уровни магния, тем большим числом компонентов МС характеризовалось состояние пациента [13]. Суточное потребление магния в группе пациентов с МС (n=200) было обратно пропорционально значениям метаболических биомаркеров резистентности к инсулину (уровни глюкозы натощак, уровни инсулина, индекс HOMA-IR). Риск повышенного значения индекса HOMA-IR (>3,6) был на 71% ниже (ОР 0,29, 95% ДИ 0,12–0,72, р<0,01) у участников с самым высоким потреблением магния (>300 мг/сут) [14].
По данным клинических исследований, более низкие уровни магния связаны с повышенными уровнями глюкозы натощак [15, 16]. В когорте 213 мужчин 30–60 лет оценка риска МС проводилась путем сложения имеющихся у пациента факторов риска МС – окружность талии >90 см, уровни ТГ >150 мг/ дл нормы, низкий уровень ЛПВП (>40 мг/дл), повышенный уровень глюкозы натощак (>110 мг/дл) и повышенное АД (>130/85 мм рт. ст.). Пациенты с повышенным уровнем глюкозы характеризовались достоверным снижением уровня магния в сыворотке (r=-0,24, р<0,001) [16]. В группе 137 участников 60–90 лет (за исключением принимающих лекарства от АГ и дислипидемии) общая распространенность МС составила 44%. Уровни глюкозы в плазме крови натощак показали обратную корреляцию с уровнями магния в сыворотке (r=-0,194, р=0,024). Пациенты с МС имели значительно более низкие сывороточные концентрации магния (2,09 мг/дл, т.е. 0,87 ммоль/л) по сравнению с остальными участниками (2,18 мг/дл, т.е. 0,90 ммоль/л, р=0,033) [17].
В популяционном исследовании 192 пациентов с МС и 384 – без МС были найдены весьма значительные различия в уровнях магния между этими двумя группами. МС диагностировался наличием по крайней мере двух из следующих признаков: гипергликемия (≥7,0 ммоль/л), АГ (≥160/90 мм рт. ст.), дислипидемия (ТГ ≥1,7 ммоль/л и/или ЛПВП холестерин <1,0 ммоль/л) и ожирение (ИМТ ≥30 кг/м2 и/или отношение окружности талии к окружности бедер ≥0,85 у женщин и ≥0,9 – у мужчин). Низкий уровень магния в сыворотке (<0,75 ммоль/л) был выявлен у 126 (65,6%) пациентов с МС и только у 19 (5%) пациентов контрольной группы (р<0,00001). Гипомагнеземия являлась независимым фактором риска МС, дислипидемии и АГ. Гипомагнеземия соответствовала повышению риска МС в 7 раз (ОР 6,8, 95% ДИ 4,2– 10,9), дислипидемии – в 3 раза (ОР 2,8, 95% ДИ 1,3–2,9) и АГ – в 2 раза (ОР 1,9, 95% ДИ 1,4–2,8) [18].
В крупномасштабном иранском исследовании (n=2504, возраст пациентов 18–74 лет) диетическое потребление магния было обратно пропорционально уровням глюкозы крови натощак (р=0,006), уровням ТГ (р=0,009) и окружности талии (р=0,006). Установлена достоверная ассоциация между Z-баллом МС и потреблением магния (р=0,001), которая сохранялась после поправок на возраст, пол, курение, физическую активность и ИМТ [19].
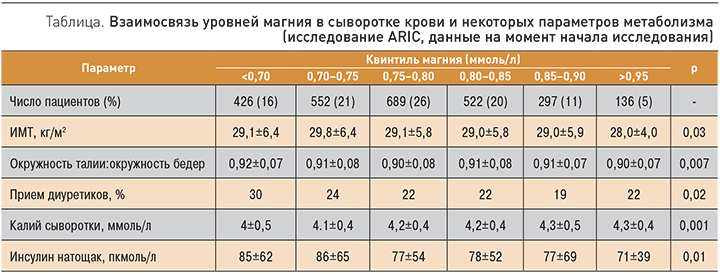
В крупномасштабном клиническом исследовании Atherosclerosis Risk in Communities Study (ARIC) 14 221 пациент в возрасте 45–64 лет прошел комплексное обследование, включавшее данные об СД 2 типа, АГ и уровнях магния. В течение 15 лет наблюдений более высокие сывороточные уровни магния были связаны с более низкими уровнями распространенности АГ и СД. При сравнении с квинтилем пациентов, имевших сывороточные уровни магния >0,95 ммоль/л (1-й квинтиль), риск постановки диагноза СД 2 типа возрастал в квинтилях пациентов с более низкими уровнями магния. Так, у пациентов из 2-го квинтиля – ОР 1,2 (95% ДИ 0,9–1,7), 3-м – ОР 1,11 (95% ДИ 0,8–1,6), 4-го – ОР 1,2 (95% ДИ 0,9–1,8) и 5-го – ОР 1,8 (95% ДИ 1,2– 2,6, р (тренд)=0,01) [20].
Данные, представленные в таблице, наглядно демонстрируют взаимосвязь некоторых критериев МС с уровнями магния в сыворотке. Следует отметить значимые корреляции между сниженными уровнями магния, калия и назначением диуретиков: у пациентов с выраженной гипомагнеземией наблюдалось наиболее частое назначение диуретиков по сравнению со всеми остальными подгруппами (р=0,02). Как известно, диуретики способствуют значительным нарушениями минерального баланса и потерям калия и магния. С другой стороны, достаточная обеспеченность калием и магнием нормализует осмотическое давление крови и снижает потребность в назначении диуретиков.
Помимо сниженных уровней магния в сыворотке крови, МС сопровождается и другими нарушениями минерального баланса. Например, содержание макро- и микроэлементов в волосах было исследовано в группе 343 пациентов без онкологии, нарушений обмена стероидов и с нормальной функцией щитовидной железы. По сравнению с контрольной группой в группе пациентов с МС наблюдались значительно более низкие уровни кальция, магния и меди, а уровни натрия и ртути были значительно выше. Содержание ртути в самой высокой четверти соответствовало повышенному риску МС по сравнению с самой низкой четвертью (ОР 7,4, 95% ДИ 1,73–31,1) [21]. Это исследование еще раз указывает на избыточное потребление натрия (поваренной соли и др.) как фактор риска и МС, и гипомагнеземии. Сравнение группы подростков 10–18 лет с МС (n=160) и без МС (n=160) показало, что более высокие уровни магния и селена в сыворотке соответствовали сниженному риску МС (р<0,001) [22]. Сравнение группы пациентов с МС (n=161) и контрольной группы (n=295) показало, что при МС концентрации натрия и калия в волосах были достоверно выше (р<0,01), а кальция (р=0,006), магния (р=0,047) и цинка (р=0,049) – достоверно ниже. У пациентов с МС также отмечено повышенное содержание в волосах токсичных мышьяка и свинца [23]. В крупномасштабном корейском исследовании (n=5136) 25% участников соответствовали диагностическим критериям МС (NCEP-ATP III). Суточное потребление магния и меди у пациентов было достоверно ниже, чем в контрольной группе [24].
МАГНИЙ, МЕТАБОЛИЧЕСКИЙ СИНДРОМ И ВОСПАЛЕНИЕ
Помимо рассматриваемых далее молекулярных механизмов патогенного воздействия дефицита магния на риск МС, следует отметить важный механизм патогенного действия гипомагнеземии – хронического воспаления как на поверхности эндотелия сосудов, так и в тканях, а также асептического воспаления гипоталамуса. Гипомагнеземия связана с многочисленными патологическими состояниями с выраженным провоспалительным компонентом (атеросклероз, АГ, остеопороз, СД и рак) [2].
В ходе наблюдений за 98 пациентами с МС участники были распределены по трем группам: тяжелая гипомагниемия (Mg2+ <0,5 ммоль/л, n=21), гипомагниемия (Mg2+ ≤0,75 ммоль/л, n=38) и нормальные сывороточные уровни магния (Mg2+ >0,75 ммоль/л, n=39). Хроническое воспаление оценивалось посредством измерения уровней С-реактивного белка (СРБ >1,0 мг/л) и фактора некроза опухолей-α (ФНО-α ≥3,5 пг/мл). Тяжелая гипомагниемия соответствовала значительному риску повышенных уровней СРБ – в 8 раз (ОР 8,1; ДИ 95% 3,6–19,4) и ФНО-α – в 4 раза (ОР 3,7; ДИ 95% 1,1–12,1). Нормомагнеземия была ассоциирована с 3-кратным снижением риска повышенных уровней СРБ (ОР 0,32, ДИ 95% 0,1–0,7) и с 3-кратным снижением риска повышенных уровней ФНО-α (ОР 0,28, ДИ 95% 0,1–0,6) [25]. В исследовании 3713 женщин в возрасте 50–79 лет без сердечно-сосудистых заболеваний, рака и СД оценка суточного потребления магния была обратно пропорциональна уровням СРБ (р=0,003), интерлейкина-6 (р<0,0001) и таких маркеров воспаления, как ФНО-α-R2 (р=0,0006) и VCAM-1 (р=0,06). Во всех исследованных этнических группах увеличение потребления магния на каждые 100 мг/сут приводило к снижению СРБ на 0,23±0,07 мг/л (р=0,002) и интерлейкина-6 на 0,14±0,05 пг/мл (p=0,004) [26].
В исследовании 4497 человек 18–30 лет без СД в начале исследования в течение 20 лет наблюдений было зарегистрировано 330 случаев СД. С поправкой на другие факторы риска риск диабета для участников с самым высоким потреблением магния (верхний квинтиль) был снижен почти в 2 раза (ОР 0,53, 95% ДИ 0,32–0,86; р<0,01). Повышение потребления магния соответствовало снижению уровней СРБ, интерлейкина-6 и фибриногена [27].
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ ВОЗДЕЙСТВИЯ ДЕФИЦИТА МАГНИЯ НА УГЛЕВОДНЫЙ И ЛИПИДНЫЙ МЕТАБОЛИЗМ
В нашей предыдущей работе были приведены результаты систематического анализа молекулярных механизмов воздействия дефицитов магния и пиридоксина на патофизиологию глюкозотолерантности и СД [28]. Анализ позволил выделить около 40 магний-зависимых белков, относящихся к метаболизму сахаров (глюконеогенез и гликолиз), сигнальному пути рецептора инсулина и метаболизму жиров. Дислипидемия – неотъемлемый компонент МС и ожирения. В эксперименте магний-дефицитная диета приводит к разнообразным нарушениям липидного метаболизма. У животных после 23 сут гипомагниевой диеты уровни общего холестерина и ТГ плазмы были увеличены, в то время как уровень холестерина ЛПВП снизился [29].
Современный метод биоинформационного анализа (анализ функциональных взаимосвязей [30]) позволил установить 30 магний-зависимых белков, нарушение активности которых будет приводить к аномалиям липидного метаболизма и способствовать развитию МС. Эти белки относятся собственно к метаболизму липидов, регуляции метаболизма липидов и к передаче катехоламинового сигнала. Данные, полученные в результате проведенного биоинформационного анализа, полностью соответствуют результатам экспериментальных и клинических исследований. Прежде всего отметим, что низкое содержание ионов магния в печени способствует формированию дисфункции печени и МС. Печень является центральным органом метаболизма жиров. Клетки линии HepG2, культивируемые в условиях низких уровней внеклеточного Mg2+, характеризовались повышенной выработкой кортизола в эндоплазматическом ретикулуме, что способствует усилению резистентности к инсулину и дальнейшим нарушениям метаболизма печени [31].
Ион магния – неотъемлемый компонент активных центров ферментов, относящихся к нескольким важным сигнальным каскадам и метаболическим путям, регулирующим синтез и распад жиров. В частности, на фоне гипомагнеземии происходит увеличение уровней ТГ плазмы (вследствие сниженной активности ACSM1, 2, 3, 4, 5, 6; ACSL1, 2, 3, 4, 5; LPIN2,3) и снижение уровней ЛПВП (снижение активности LCAT; PPARА, В, С, D; PRKAA1, 2), что действительно наблюдается при МС. Магний необходим для активности ферментов, известных как «КоА-лигазы длинноцепочечных жирных кислот» (длинноцепочечные-ацил-КоА синтетазы, англ. ACSL), которые играют ключевую роль в синтезе и деградации клеточных липидов с помощью Р-окисления. Ферменты типа ACSL локализованы в микросомах, внешних мембранах митохондрий, пероксисомальной мембране и катализируют первую реакцию в метаболизме жирных кислот – присоединение жирной кислоты к коферменту А. Магний является составной частью активного центра «жирная кислота – КоА-лигаза». Активность этой группы ферментов зависит от концентрации ионов Mg2+; при внутриклеточном дефиците магния ACSL-активность падает более чем в 3 раза [32].
Ионы магния необходимы для поддержания активности фермента лецитинхолестеринацилтрансферазы (ЛХАТ). Фермент ЛХАТ является центральным ферментом метаболизма липопротеинов плазмы. Достаточный уровень активности магний-зависимой ЛХАТ необходим для поддержания нормальных уровней ТГ и ЛПВП [33, 35–37]. Будучи синтезированной в печени, ЛХАТ секретируется в плазму, где связывается с липопротеидными частицами ЛПВП. Магний-зависимый фермент ЛХАТ преобразует свободный холестерин в эфиры холестерина, которые затем поглощаются ядром липопротеидной частицы. Дефекты в гене LCAT приводят к врожденной недостаточности ЛХАТ (код по ОMIM 245900), характеризующейся недостаточной этерификацией холестерина плазмы и формированием холестериновых отложений. Уровни активности ЛХАТ обратно пропорциональны уровням лептина и наличием ожирения [34].
Фермент дельта-6-десатураза является еще одним магний-зависимым ферментом, участвующим в метаболизме липидов. Десатуразы катализируют первый шаг в преобразовании незаменимых жирных кислот (омега-3 линолевой кислоты и омега-6 линолевой кислоты) в простагландины [35, 38]. Экспериментальный дефицит магния (безмагниевая диета, 23 сут) приводила к замедлению скорости превращения линолевой кислоты в арахидоновую кислоту в микросомах клеток печени, что соответствует снижению уровней и активности дельта-6-десатуразы [39].
КЛИНИКО-ЭПИДЕМИОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
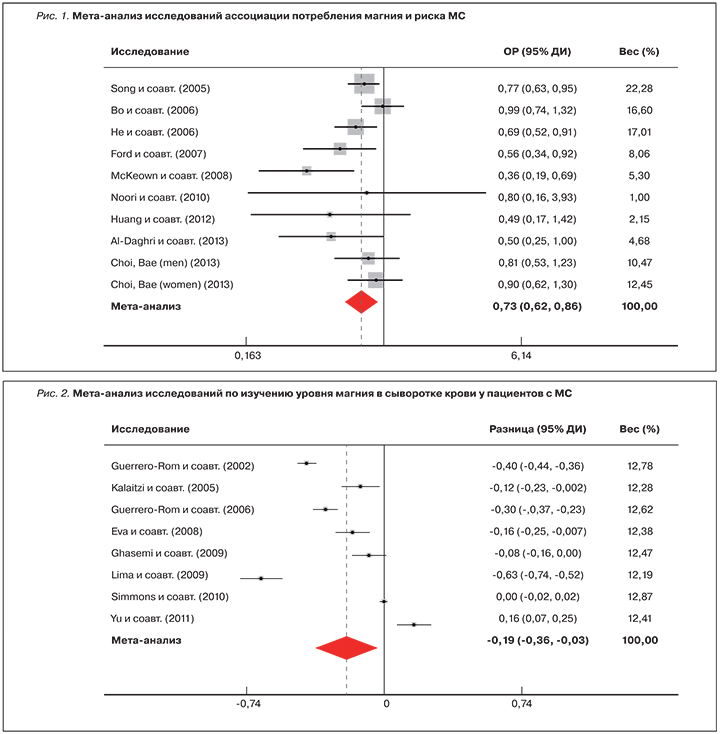
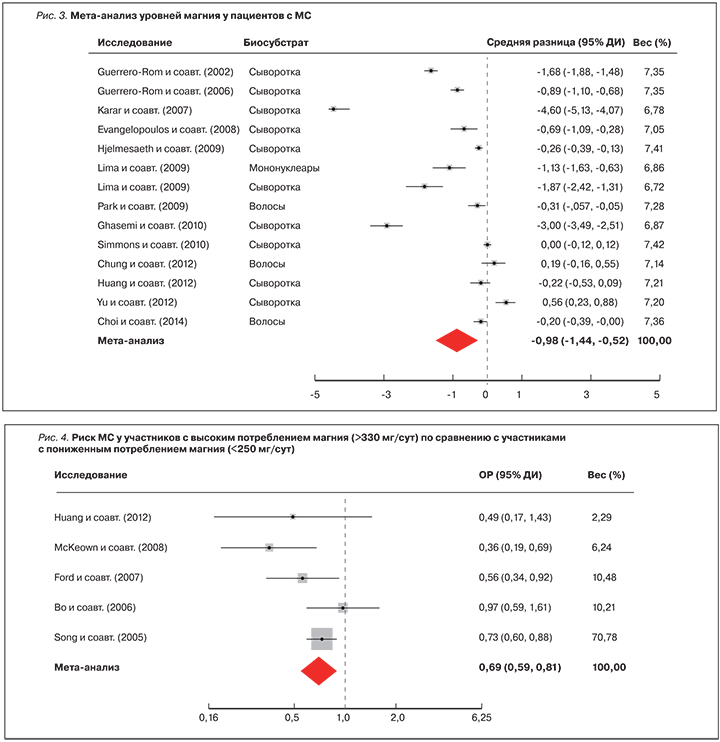
Результаты крупных эпидемиологических исследований указывают то, что диетарная обеспеченность магнием значительно влияет на проявление компонентов МС [40–42]. В проведенном в США крупномасштабном эпидемиологическом исследовании NHANES (National Health and Nutrition Examination Survey) была установлена дозозависимая корреляция между потреблением магния с пищей и риском развития МС. Данные о 7669 участниках (возраст ≥20 лет) включили информацию о компонентах МС (по критериям NCEP-III) и оценку диетарного потребления магния по суточному дневнику диеты. Наблюдалась отчетливая дозозависимая корреляция между квинтилями оценки диетарного магния и риском МС. При сравнении с самым нижним квинтилем потребления магния риск МС уменьшался при повышении потребления магния: 2-й квинтиль (ОР 0,84, 95% ДИ 0,58–1,23), 3-й квинтиль (ОР 0,76, 95% ДИ 0,54–1,07), 4-й квинтиль (ОР 0,62, 95% ДИ 0,40–0,98) и 5-й квинтиль (ОР 0,56, 95% ДИ 0,34–0,92, р=0,029). Таким образом, работа исследовательской группы NHANES предоставила серьезный эпидемиологический аргумент в доказательство того, что адекватное потребление магния (прежде всего, в форме богатой магнием диеты) важно для поддержания кардиометаболического здоровья [41]. Мета-анализ 9 исследований (n=31 876) ассоциации между диетическим потреблением магния и МС показал, что более высокий уровень потребления магния (в среднем более 300 мг/сут) связан со снижением риска развития МС на 27% (ОР 0,73, 95% ДИ 0,62–0,86, р<0,001) [42] (рис. 1). В 8 из 9 вошедших в мета-анализ исследованиях были измерены уровни магния в сыворотке (n=3487). Мета-анализ показал, что уровни магния в сыворотке были в среднем на 0,19 мг/дл ниже у пациентов по сравнению с участниками из группы без МС (95% ДИ -0,36...+0,03, р=0,023) [42] (рис. 2).
Анализ популяционной выборки с использованием дневников диеты (n=9148) показал, что более высокое потребление магния (>355 мг/сут) по сравнению с недостаточным потреблением магния (<197 30="" 0="" 70="" 95="" 0="" 57="" 0="" 86="" 41="" 310="" 320="" 1000="" 1200="" 0="" 59="" 95="" 0="" 45="" 0="" 76="" 43="" -="" 13="" n="5496)" -0="" 98="" 95="" -1="" 44="" -0="" 52="" 0="" 25="" 44="" 3="" p="">
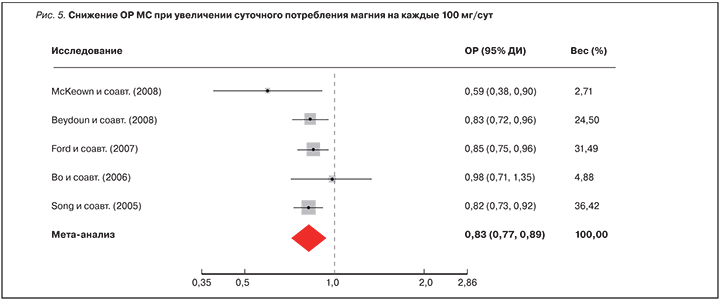
Мета-анализ 8 кросс-секционных исследований показал, что относительный риск МС снижается на 12% при увеличении суточного потребления магния на каждые 150 мг/сут (ОР 0,88, 95% ДИ 0,84–0,93) [45]. Мета-анализ 6 кросс-секционных исследований (n=24 473) показал, что более высокое потребление магния (>330 мг/сут) было ассоциировано с более низким риском развития МС (ОР 0,69, 95% ДИ 0,59–0,81, р<0,01) по сравнению с низким потреблением магния (<250 100="" 17="" 0="" 83="" 95="" 0="" 77="" 0="" 89="" 46="" 4="" 5="" p="">
О ПРИМЕНЕНИИ ПРЕПАРАТОВ МАГНИЯ ДЛЯ ПРОФИЛАКТИКИ И ТЕРАПИИ МЕТАБОЛИЧЕСКОГО СИНДРОМА
Прием препаратов магния способствует нормализации метаболизма жиров. В группе из 48 человек с легкой формой АГ пациенты были рандомизированы на прием 600 мг пидолата магния в течение 12 нед или в группу контроля. Помимо значимого снижения АД, в группе принимавших препарат органического магния наблюдались значимое снижение общего холестерина, липопротеина низкой плотности (ЛПНП), ТГ, сопровождавшиеся увеличением уровней ЛПВП [47].
Более высокое потребление магния связано с пониженным риском характерных для МС метаболических нарушений. Эффекты энтерального приема препаратов магния были изучены в группе 14 здоровых добровольцев с избыточным весом (ИМТ ≥25 кг/ м2), которые были рандомизированы для получения цитрата магния (500 мг/сут элементарного магния) или плацебо в течение 4 нед. Применение препарата органического магния способствовало значительному снижению уровней провоспалительного С-пептида, отражающего степень эндотелиального воспаления (-0,4 нг/ мл, p=0,004) и концентрации инсулина натощак (-2,2 мкЕд/мл, p=0,025) [48]. Прием препаратов магния приводит к улучшению липидного профиля сыворотки крови (в частности, через активацию фермента ЛХАТ), сопровождавшееся нормализацией уровней холестерина ЛПВП и аполипопротеина-AI [49]. Прием препаратов органического магния способствует снижению гипергликемии – одного из основных компонентов МС. Мета-анализ рандомизированных исследований органических препаратов магния суммарно включил 370 пациентов с СД 2 типа. Средняя продолжительность приема препаратов составила 12 нед, средняя дозировка – 360 мг/сут в расчете на элементный магний. Прием препаратов магния способствовал достоверному снижению уровня глюкозы натощак в среднем на 0,56 ммоль/л (95% ДИ 0,01–10, р=0,02) по сравнению с плацебо [50].
Пероральный прием препаратов органического магния (аспартата гидрохлоридаа) в течение 6 мес пациентами с избыточным весом улучшает чувствительность к инсулину, даже если у них исходно наблюдались нормальные уровни магния в плазме крови [51]. Напомним, что нормальные уровни магния в плазме крови могут наблюдаться у пациентов со сниженными уровнями магния в эритроцитах [52]. В рандомизированном слепом контролируемом исследовании 374 пациентов (мужчины 25–63 лет) 206 пациентов с МС были рандомизированы в группу, получавшую богатую магнием диету, а 168 пациентов находились на их обычной диете в течение 6 нед. После 6 нед соблюдения диеты, обогащенной магнием, наблюдалось значительное падение общего холестерина сыворотки (229±46 мг/дл, контроль 243±58 мг/дл), холестерина ЛПНП (147±76 мг/дл, контроль 157±78 мг/дл) и ТГ (144±41 мг/дл, контроль 157±60 мг/дл) [53].
Представляется важным также рассмотреть результаты исследования общеизвестной Фрамингемской когорты, в котором было установлено, что потребление синтетических безалкогольных напитков (в странах Северной Америки такие напитки известны под обобщенным названием «кола» и принадлежат к т.н. junk food, т.е. «мусорной еде») соответствовало увеличению риска развития кардиометаболических факторов риска и МС. Эти напитки содержат значительное количество сахара и изготавливаются из многочисленных синтетических компонентов (красители, улучшители вкуса и т.п.). Взаимосвязь частоты встречаемости МС и его компонентов с потреблением синтетических безалкогольных напитков была изучена в подвыборке Фрамингемской когорты (n=6039, средний возраст 53 года). МС диагностировался как наличие 3 признаков и более по критериям NCEP-III. На момент начала исследования у участников не было установлено МС. В течение 4 лет МС был диагностирован у 1150 участников. Лица, потреблявшие синтетические напитки 1 раз в день и более, имели более высокую распространенность МС (ОР 1,48, 95% ДИ 1,30–1,69), ожирения (ОР 1,31, 95% ДИ 1,02–1,68), нарушений гликемии натощак (ОР 1,25; 95% ДИ 1,05–1,48), повышения АД (ОР 1,18, 95% ДИ 0,96–1,44), гипертриглицеридемии (ОР 1,25, 95% ДИ 1,04–1,51) [54]. Следует отметить, что синтетические напитки, помимо значительных количеств рафинированного сахара, часто содержат вещества, являющиеся сильнейшими антагонистами магния (разнообразные производные анилиновых красителей и т.д.). Поэтому потребление таких напитков неизбежно будет способствовать возникновению гипомагнеземии, провоцируя и усугубляя МС.
ПИРИДОКСИН, ГЛЮКОЗОТОЛЕРАНТНОСТЬ И МЕТАБОЛИЧЕСКИЙ СИНДРОМ
Пиридоксин известен как универсальный переносчик магния, способствующий всасыванию магния в желудочно-кишечном тракте и транспорту магния внутрь клеток. Пиридоксин и его производные пиридоксаль и пиридоксамин необходимы для метаболизма углеводов, белков и жиров. Пиридоксин также принимает участие в поддержании натрий-калиевого баланса, уменьшает уровни гомоцистеина в крови и необходим для синтеза нейротрансмиттеров серотонина, допамина, норадреналина и адреналина. В ряде экспериментальных и клинических исследований была показана взаимосвязь между обеспеченностью витамином В6, СД и МС. Пиридоксин играет важную роль в регуляции синтеза и секреции инсулина [55]. Было отмечено, что содержание пиридоксина в печени (которая является депо витамина В6) у животных с моделью диабета было таким же высоким, как и в контроле [56]. Пиридоксальфосфат, поддерживая секрецию инсулина и снижая оксидативный стресс, способствовал защите клеток островков Лангерганса [57].
В клинических исследованиях подтвердилась взаимосвязь между риском СД 2 типа и снижением уровня пиридоксина [58]. В частности, наблюдения за группами женщин с гестационным диабетом в поздней беременности показали, что прием пиридоксина (100 мг/сут) даже в течение относительно короткого срока (2 нед) способствовал статистически значимому улучшению кривой толерантности к глюкозе [59, 60].
Гипергомоцистеинемия – один из факторов риска сосудистой патологии, МС и СД. Обычно повышенные уровни гомоцистеина связывают только с недостатком активных фолатов в пище. Однако повышенный гомоцистеин также является результатом дефицита других витаминов группы В (прежде всего, В6 и В12) и также возникает вследствие дефицита магния. Это обусловлено участием пиридоксина в цикле обмена фолатов. Избыток гомоцистеина является независимым фактором риска атеросклероза, АГ и МС. В крупномасштабных эпидемиологических исследованиях увеличение гомоцистеина плазмы на каждые 5 мкмоль/л было связано с увеличением систолического/диастолического АД на 0,7/0,5 мм рт. ст. у мужчин и на 1,2/0,7 мм рт. ст. у женщин. Эффекты избыточного гомоцистеина на АД вызваны, вероятно, вазоконстрикцией, нарушениями функции почек и увеличением задержки натрия, повышением жесткости стенок артерий вследствие атеросклеротических изменений. Известно, что антигомоцистеиновая терапия, включающая фолаты и фолат-синергисты пиридоксин (В6) и цианкобаламин (В12), способствует снижению АД [61]. Молекулярные механизмы, обуславливающие описанные выше эффекты пиридоксина, связаны не только с влиянием пиридоксина на фолатный обмен, но и на метаболизм аминокислот, углеводов и катехоламинов (которые регулируют расщепление липидов и липогенез в жировой ткани). В частности, ряд пиридоксин-зависимых ферментов вовлечены в процессы метаболизма аминокислот. К ним относятся аспартатаминотрансферазы (гены GOT1, GOT2), взаимно конвертирующие аспартат в глутамат и оксалоацетат; аланинаминотрансфераза (GPT), катализирующая взаимопревращения аланина, пирувата и глутамата и участвующая в глюконеогенезе; метаболизирующая аланин-глиоксилат аминотрансфераза (AGXT) и L-серин дегидратаза (SDS), катализирующая взаимопревращения серина и пирувата. Пиридоксин-зависимые гликогенфосфорилазы (гены PYGB, PYGM) участвуют в глюконеогенезе. Дефекты генов гликогенфосфорилаз являются причиной болезней накопления гликогена (коды 232700 и 232600 по ОMIM) [62]. Пиридоксин-зависимая декарбоксилаза ароматических L-аминокислот (ген DDC) участвует в биосинтезе катехоламинов, катализируя декарбоксилирование 3- и 4-диоксифенилаланина (ДОФА) в дофамин, а 5-гидрокситриптофана – в серотонин. Дефекты гена DDC приводят к врожденной недостаточности декарбоксилазы ароматических аминокислот (код 608643 по ОMIM), связанной с задержкой физического и психомоторного развития, вялостью, гипотермией и расстройствами желудочно-кишечного тракта [62].
Таким образом, представляется перспективным использования пиридоксина, фармакокинетического синергиста магния, в профилактике и терапии МС. Для данной цели могут быть использованы препараты на основе органических солей магния (лактат, пидолат, цитрат магния и др.). Препараты линии Магне В6 (Магне В6 в таблетках – 48 мг Mg2+ и 5 мг пиридоксина; Магне В6 в ампулах и Магне В6 Форте – 100 мг Mg2+ и 10 мг пиридоксина) характеризуются достаточной доказательной базой и применяются для компенсации недостаточной обеспеченности магнием, сопровождающей широкий круг заболеваний, в т.ч. СД, ожирение и МС.
О ВЗАИМОСВЯЗИ МЕТАБОЛИЧЕСКОГО СИНДРОМА У ДЕТЕЙ И ПОДРОСТКОВ С ДЕФИЦИТОМ МАГНИЯ
Малоподвижный образ жизни у детей и отнюдь «не детское» жирное и высококалорийное питание в последние годы привело к резкому взлету встречаемости ожирения и других компонентов МС у детей и подростков. При переходе в подростковый возраст избыточная масса тела, сформировавшаяся в детском возрасте, нормализуется лишь у части подростков (т.н. «израстание»). У многих же подростков детское ожирение трансформируется в ожирение взрослых, отягчающееся инсулинорезистентностью, гиперлипидемией и АГ – т.е. МС. Во всем мире численность детей с ожирением удваивается каждые 30 лет [63]. В России от избыточной массы тела страдает 8,5% детей, проживающих в городах, и 5,5% – в сельской местности [64]. Динамика роста встречаемости ожирения у детей также настораживает. Например, в Томске и в Томской области с 2000 г. по 2008 г. детское ожирение выросло в 1,8 раза. Была выявлена негативная динамика роста распространенности данной патологии среди мальчиков (3,7 на 100 тыс. детского населения в 2000 г. и 6,4 – в 2008 г.) и менее – у девочек (в 2000 г. – 6,3, а в 2008 г. – 6,6 на 100 тыс. детского населения) [65].
Хронический дефицит магния у детей встречается достаточно часто и ассоциирован с широким спектром детских патологий. Например, при изучении распространенности выраженной гипомагниемии (магний сыворотки <0,74 ммоль/л) в группе 910 новорожденных и детей гипомагниемия была установлена у 22% детей. При этом гипомагниемия была ассоциирована с диареей, преждевременными родами в анамнезе, судорогами, заболеваниями почек, метаболическим ацидозом, идиопатическим апноэ и тахикардией [66]. Дефицит магния усугубляется к подростковому возрасту. Так, при обследовании в Мексике 5060 детей в возрасте от 1 года до 11 лет низкий уровень магния в сыворотке крови был обнаружен всего у 12% детей в возрастном диапазоне от 1 года до 4 лет. В другом крупном исследовании (Мексика) в когорте 2447 подростков 12–19 лет при измерении уровней микронутриентов в сыворотке крови было показало, что дефицит магния уже был лидирующим и наблюдался у 40% девочек и 35% мальчиков. Дефицитные по магнию дети и подростки отличались более высоким ИМТ, уровнем стресса, у девочек чаще имелись расстройства менструальной функции [67].
Рассмотренные выше фундаментальные механизмы участия магния в процессах метаболизма углеводов на молекулярном уровне в полной мере объясняют наблюдаемые в клинической практике корреляции между дефицитом магния и избыточной массой тела/ожирением у детей. Например, наблюдения за группой из 25 детей 8–16 лет с ожирением и СД 2 типа показали, что уровни магния в сыворотке крови были ниже у детей с ожирением (160±65 мкмоль/л) и с СД (140±30 мкмоль/л) по сравнению с контрольной группой (330±28 мкмоль/л) [68]. В другом исследовании сывороточные уровни магния натощак у детей 4–14 лет были значительно ниже в группе с избыточной массой тела (2,12±0,33 мг/дл) по сравнению с контрольной (2,56±0,24 мг/дл, р<0,001). Уровни магния в сыворотке были обратно пропорциональны индексу массы тела, систолическому и диастолическому АД, окружности талии и уровню инсулина натощак [69].
Пероральный прием препаратов органического магния улучшает чувствительность к инсулину у пациентов с избыточным весом, даже если у них наблюдаются нормальные уровнями магния в плазме [51]. Использование для компенсации дефицита магния у детей только богатых магнием продуктов питания не всегда может являться эффективной и безопасной процедурой компенсации дефицита магния. Например, в крупномасштабном исследовании NHANES (National Health and Nutrition Examination Survey, 1999–2004 гг.) было показано, что, несмотря на частичную компенсацию дефицита, регулярный прием орехов (не менее 10 г/сут) по-разному влиял на показатели массы тела. Когорта участников (n=24 385) была разделена на подгруппы детей 2–11 лет, подростков 12–18 лет и взрослых (19 лет и старше). Во всех возрастных группах регулярное потребление орехов было ассоциировано с более высоким потреблением энергии, мононенасыщенных и полиненасыщенных жирных кислот, пищевых волокон, меди и магния и более низким потреблением углеводов, холестерина и натрия. Однако в подгруппе детей в возрасте 2–11 лет более высокое потребление орехов было ассоциировано с более высокой распространенностью избыточной массы тела и ожирения. В то же время в возрастной группе 12–18 лет потребление орехов было ассоциировано с меньшим риском избыточной массы тела и ожирения [70]. Таким образом, не каждый магний-содержащий продукт питания подходит для компенсации дефицита магния у детей 2–11 лет.
ЗАКЛЮЧЕНИЕ
МC как совокупность комплексных нарушений углеводного и жирового обмена обусловлен не только гиподинамией, но и тяжелыми нарушениями обмена магния. Магний регулирует микронутриентный баланс и участвует в метаболизме сахаров и жиров как кофактор многочисленных ферментов. Магний способствует снижению асептического воспаления гипоталамуса, характерного для МС [2].
В настоящей работе приведены результаты систематического анализа молекулярных механизмов воздействия дефицита магния и его синергиста пиридоксина на характерные для МС нарушения углеводного и жирового обмена. Показано, что достаточные уровни магния необходимы для поддержки более 30 белков и ферментов, которые вовлечены непосредственно в метаболизм липидов. Магний и его синергист пиридоксин также способствуют снижению системного воспаления, что оказывает дополнительное положительное влияние на состояние клеток поджелудочной железы и эндотелия сосудов.
Таким образом, магний является одним из важнейших нутрициальных факторов, определяющих эффективность метаболизма жиров и углеводов, нормальное физиологическое протекание которых является существенным компонентом профилактики МС. По данным клинико-эпидемиологических исследований, адекватная обеспеченность населения магния значительно снижает риск развития МС. Клинические испытания в рамках доказательной медицины показывают перспективность использования пероральных препаратов органического магния и его синергиста пиридоксина, органических солей магния (лактат, пидолат, цитрат магния, например, в составе препаратов Магне В6, Магне В6 Форте, Магне В6 в растворе для питья) в терапии и профилактике избыточной массы тела и МС и у взрослых, и у детей. При этом компенсация дефицита и восполнение депо магния лучше всего достигается при длительном назначении препаратов органического магния. Использование пидолата магния с пиридоксином в растворе (ампульная форма Магне В6 в растворе для питья) разрешено с 1 года; лактата и цитрата магния – с 6 лет. Цитрат магния (Магне В6 Форте) рекомендуется для восполнения дефицита магния детям с ацидозом (или со сдвигом в сторону ацидоза) и оксалатурией/мочекаменной болезнью. Рекомендуется запивать препарат цитрата магния достаточным количеством чистой питьевой воды (150–300 мл). Напомним, что недостаточное потребление воды детьми и подростками приводит к задержке эндотоксинов в организме и способствует развитию ожирения.



