ВВЕДЕНИЕ
Сердечно-сосудистые заболевания (ССЗ) занимают первое место среди причин смертности во всем мире. Ежегодно в Российской Федерации от ССЗ умирает более миллиона человек: более половины от ишемической болезни сердца (ИБС; 605,1 тыс. в 2016 г., Росстат) и 300–400 тыс. от атеросклеротического поражения сосудов головного мозга (инсульт), почечных и периферических артерий.
Установлена взаимосвязь нарушений липидного и углеводного обмена с гастроэнтерологическими заболеваниями (язвенной болезнью, хроническим гастродуоденитом, панкреатитом, гастроэзофагеальной рефлюксной болезнью, синдромом раздраженного кишечника) [1].
Патогенез атеросклероза изучается уже более ста лет, однако до сих пор единого мнения по этому вопросу не существует. Специалисты прошли путь от представлений об атерогенезе как следствие избыточного содержания в пище холестерина (ХС) до сложных теорий патогенеза атеросклероза. На сегодняшний день общепризнано, что одним из основных факторов риска развития ССЗ и атеросклероза является дислипидемия. При атерогенной дислипидемии происходят выраженные дисбиотические изменения кишечника, следствием которых становятся эндотоксемия, бактериальная транслокация и нарушение функций печени. Известно также, что печень играет важную роль в развитии атерогенной дислипидемии, одновременно являясь и органом-мишенью [2].
Основными модифицируемыми факторами риска ИБС и инсульта являются неправильное питание, физическая инертность, употребление табака и злоупотреблением алкоголем [3]. К факторами, влияющим на смертность, относятся повышенное артериальное давление (АД), повышение уровней глюкозы и липидов сыворотки крови, а также избыточная масса тела и ожирение, которые в большинстве случаев требуют уже медикаментозной коррекции. Существует прямая корреляция между высоким уровнем липидов сыворотки крови и риском ССЗ их осложнений, в том числе смертельных, что было доказано результатами большого числа рандомизированных исследований. В 1990–2000-х гг. проводились исследования (4S, CARE, LIPID, HPS, ASCOT-LLA), которые показали, что при снижении уровней общего ХС (ОХС) и ХС липопротеидов низкой плотности (ХС-ЛПНП) в крови на 25–30 и 30–35% соответственно риск повторных сердечно-сосудистых осложнений – острого инфаркта миокарда (ИМ), нестабильной стенокардии и смертельных исходов – уменьшается на 25–40%, а ишемических инсультов на 25–30% [4–8]. Метаанализы показали, что снижение уровня ХС-ЛПНП на каждые 1,0 ммоль/л ассоциируется с 20–25%-ным снижением сердечно-сосудистой смертности и риска нефатального ИМ [9]. Установлено, что уровень триглицеридов >1,7 ммоль/л является фактором повышенного сердечно-сосудистого риска, однако положительный эффект от его снижения <1,7 ммоль/л не подтвержден данными доказательной медицины. Известно, что повышение уровня триглицеридов является самостоятельным независимым фактором риска сердечно-сосудистой смертности, но менее значимым, чем гиперхолестеринемия [10]. При этом наиболее выраженное повышение сердечно-сосудистого риска имеет место при умеренной, а не тяжелой гипертриглицеридемии (>10 ммоль/л), которая является важным фактором риска развития панкреатита.
На основании результатов многочисленных исследований с высоким уровнем доказательности в 2012 г. Российским кардиологическим обществом (РКО) для пациентов каждой группы риска сформулированы целевые уровни ХС-ЛПНП как наиболее атерогенного фактора [11] (табл. 1).

Согласно Рекомендациям ЕОК/ЕОА по диагностике и лечению дислипидемий [12], снижение смертности от ССЗ за последние три десятилетия более чем на 50% было обусловлено изменениями факторов риска на популяционном уровне, в первую очередь снижением уровня ХС, АД и табакокурения. Роль питания в профилактике ССЗ хорошо известна: существуют достоверные доказательства того, что факторы питания влияют на атерогенез напрямую или посредством воздействия на традиционные факторы риска (дислипидемия, повышение АД или гипергликемия). Однако большинство полученных данных, касающихся взаимосвязи питания и развития ССЗ, основываются на результатах наблюдательных исследований и оценок влияния диеты на уровень липидов. Большая роль отводится пищевым волокнам, которые оказывают прямое гипохолестеринемическое действие.
К препаратам, нормализующим липидный обмен, относятся:
- ингибиторы гидроксиметилглутарил-коэнзим А-редуктазы (ГМГ-КоА-редуктазы) – статины;
- ингибитор абсорбции ХС в кишечнике (эзетимиб);
- секвестранты желчных кислот;
- производные фиброевой кислоты (фибраты);
- никотиновая кислота (ниацин);
- омега-3-ненасыщенные жирные кислоты.
Наиболее изученной и часто используемой группой препаратов для снижения риска развития сердечно-сосудистых осложнений и улучшения прогноза больных ССЗ являются статины. Их гиполипидемическое действие обусловлено конкурентной ингибицией ГМГ-КоА-редуктазы – ключевого фермента, превращающего 3-гидрокси-3-метилглютарил-КоА в мевалонат – предшественник стероидов, в том числе ХС, с увеличением числа печеночных рецепторов ЛПНП на поверхности клеток, что приводит к усилению захвата и катаболизма ХС-ЛПНП крови. Несомненная эффективность назначения статинов при различных формах ИБС после перенесенного острого ИМ и мозгового инсульта доказана в крупных рандомизированных клинических исследованиях: HPS, PROSPER, SPARCL, CARDS и др. [7, 13–15]. Статины рекомендованы в качестве дополнения к диете для снижения повышенного уровней ОХС, ХС-ЛПНП, аполипопротеина В и триглицеридов у взрослых, подростков и детей в возрасте ≥10 лет с первичной гиперхолестеринемией, включая семейную гиперхолестеринемию (гетерозиготный вариант) или комбинированную (смешанный вариант) гиперлипидемию (соответственно тип IIa и IIb по классификации Фредриксона), когда отсутствует положительный эффект в ответ на диету и другие немедикаментозные методы лечения.
Результаты ряда исследований 2006–2007 гг. (MSS, ОСКАР) показали, что в Москве в среднем статины получали 30% от числа всех нуждающихся в гиполипидемической терапии, и лишь 30% из принимающих статины пациентов достигали целевых значений ХС ЛПНП [16, 17]. Спустя 10 лет приверженность пациентов лечению этими препаратами остается недостаточной. Частота достижение целевого уровня ХС-ЛПНП среди больных, регулярно принимающих статины, не превышает 55,8% [18]. Поэтому ведется поиск новых гиполипидемических средств с иными механизмами действия. Примером таких препаратов, недавно появившихся на нашем рынке, являются ингибиторы фермента пропротеиновой конвертазы субтилизин-кексина типа 9 (PCSK9). Эволокумаб и алирокумаб селективно и с высокой степенью аффинности связываются с PCSK9 и ингибируют взаимодействие циркулирующей PCSK9 с рецепторами ЛПНП (Р-ЛПНП) на поверхности гепатоцитов, таким образом предотвращая PCSK9-опосредованный распад Р-ЛПНП. Как результат, повышение экспрессии Р-ЛПНП в печени приводит к снижению сывороточной концентрации ХС-ЛПНП. Эволокумаб является полностью человеческим моноклональным иммуноглобулином (Ig) класса G2. Однако широкое применение этих препаратов ограничено диапазоном их побочных действий и исключительно высокой стоимостью.
К гастроэнтерологу пациенты обращаются чаще всего по поводу запоров, заболеваний пищевода, желудка, печени и кишечника, и только в процессе обследования у них выявляются нарушения липидного обмена. Запор – одна из самых распространенных жалоб в пожилом возрасте: от 30 до 60% пациентов старше 60 лет, по их собственной оценке, страдают запорами [19, 20]. Тяжелые запоры увеличивают риск кардиоваскулярных событий у пожилых женщин в постменопаузе на 23% (отношение шансов 1,28; 95% ДИ 1,08–1,53), а умеренные в 1,13 раза [21].
В литературе последних лет, в том числе в опубликованных результатах наших собственных исследований, посвященных оценке эффективности использования псиллиума в качестве слабительного препарата (или нормализующего стул средства) как сопутствующий эффект той или иной степени выраженности, мы наблюдали гиполипидемическое действие (снижение ОХС в среднем на 9–14–17% от исходного) [22–25].
Учитывая вышеуказанные данные, было проведено многоцентровое проспективное рандомизированное исследование, целью которого являлось изучение гиполипидемического эффекта псиллиума при его длительном применении (от 3 до 6 мес) у пациентов с гиперлипидемией, метаболическим синдромом и запором в качестве монотерапии и составе комбинированной терапии.
МАТЕРИАЛ И МЕТОДЫ
Работа проводилась по единому протоколу в различных медицинских центрах 19 городов Российской Федерации.
В исследование включались мужчины (n=246) и женщины (n=475) старше 18 лет с гиперлипидемией (основной критерий включения) [12]. Наличие у больного сопутствующего метаболического синдрома или/и запора устанавливалось при опросе и осмотре.
Для диагноза «функциональный запор», согласно Римским критериям функциональных расстройств желудочно-кишечного тракта (Rome IV, 2016) [27], необходимо не менее двух критериев из нижеперечисленных, которые имеют место у больного в течение не менее 3 мес с началом возникновения жалоб за 6 мес до обращения к врачу:
- натуживание в течение по крайней мере 25% дефекации;
- шероховатый или твердый стул по крайней мере в 25% дефекаций;
- ощущение неполной эвакуации по крайней мере в 25% дефекаций;
- ощущение аноректальной обструкции/блокады по крайней мере для 25% дефекаций;
- необходимость мануальных приемов для облегчения по крайней мере в 25% дефекаций (например, пальцевая эвакуация, поддержка тазового дна);
- меньше 3 дефекаций в неделю;
- невозможность самостоятельного стула без использования слабительных средств;
- недостаточность критериев для синдрома раздраженного кишечника.
Для объективизации жалоб при описании характера стула в беседе с больным использовалась Бристольская шкала, 1 и 2 тип которой соответствуют повышенной твердости кала.
К критериям исключения относились онкологические заболевания, декомпенсированный сахарный диабет (СД), сердечная недостаточность III–IV функционального класса по NYHA, недееспособность больного.
С учетом критериев включения и исключения врачи осуществляли набор больных; на основании осмотра и лабораторных исследований заполняли карты объективного осмотра, проводили анкетирование пациентов.
Для выбора тактики лечения больных определяли группы риска развития ССЗ. К группе высокого риска относили пациентов с доказанным атеросклерозом любой локализации (перенесенные ИМ, транслюминальная баллонная ангиопластика, аортокоронарное шунтирование, инсульт, периферический атеросклероз), СД 1 и 2 типа с поражением органов-мишеней (микроальбуминурия) и хронической болезнью почек (скорость клубочковой фильтрации <60 мл/мин/1,73м2). Группу риска остальных больных оценивали с помощью шкалы SCORE (Systemic Coronary Risk Evaluation), которая применяется в странах с высоким уровнем смертности от ССЗ (куда относится и Россия) и включает оценку таких факторов, как возраст, пол, курение, уровни систолического АД, ОХС и ХС-ЛПНП.
Если пациенту с гиперлипидемией медикаментозное лечение не требовалось, то рекомендовали мероприятия по изменению образа жизни. Если требовалось снижение уровня ХС-ЛПНП менее чем на 1 ммоль/л, больному назначали монотерапию псиллиумом 15 г/сут. При необходимости снижения ХС-ЛПНП более чем на 1 ммоль/л больному предлагалась комбинированная терапия статинами в сочетании с псиллиумом (Мукофальк) 15 г/сут. Из числа статинов к применению допускался любой препарат, доступный в РФ, в минимальной рекомендованной дозе 10 мг в сутки. Комбинированную терапию получали также больные, принимавшие статины до включения в исследование.
Если к 12 нед (3 визит) лечения на фоне минимальной дозы статинов и псиллиума или монотерапии псиллиумом целевой уровень ХС ЛПНП не был достигнут, было рекомендовано увеличить дозу статинов (не отменяя псиллиум) вдвое (до 20 мг). Оценка эффективности и нежелательных явлений в этом случае осуществлялась на 24 нед терапии (4 визит).
В случае наличия запора больным рекомендовали запивать псиллиум вторым стаканом жидкости.
СТАТИСТИЧЕСКАЯ ОБРАБОТКА ДАННЫХ
Применялся метод описательной и непараметрической статистики — U-критерий Манна–Уитни, соотношение межгрупповой и внутригрупповой дисперсий определялось при помощи F-критерия Фишера. Полученные результаты оценивались как статистически достоверные при значениях р<0,05.
РЕЗУЛЬТАТЫ
Проведено обследование и лечение 721 больного в возрасте от 19 до 91 года, в том числе 475 женщин (средний возраст 58,9±9,1 года) и 246 мужчин (средний возраст 54,1±6,9 года). Средний возраст всех больных составил 57,4±7,9 года. Из исследования в связи с некорректным заполнением анкеты и отсутствием комплаенса были исключены 119 больных.
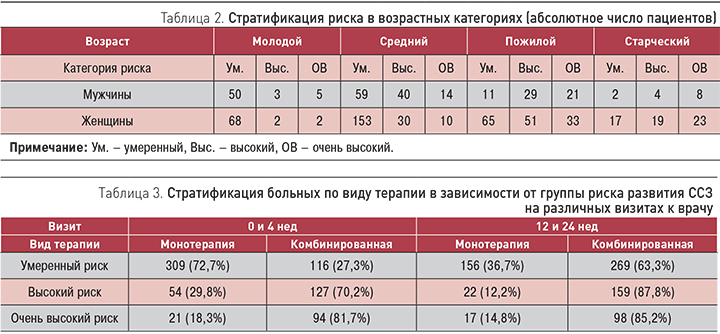
Учитывая большой возрастной диапазон больных, для объективности расчетов мы выделили (согласно рекомендациям ВОЗ, 2017) группы пациентов: молодые (18–44 лет), среднего возраста (45–59 лет), пожилые (60–74 года) и старческого возраста (≥75 лет). Среди больных было две долгожительницы в возрасте 91 года (Москва и Санкт-Петербург).
Как мы уже указывали ранее, для выбора тактики ведения больных определяли группы риска развития ССЗ с учетом возраста (табл. 2). Очень высокий риск отмечался у 8,62% молодых мужчин, у мужчин среднего возраста этот показатель составлял уже 12,39%. В группе мужчин пожилого и старческого возраста количество пациентов с очень высоким риском ССЗ выросло до 34,43 и 57,14% соответственно. Среди женщин этот показатель также увеличивался с возрастом: от 2,77 до 5,18; 22,15 и 38,98% в соответствующих группах. Обе долгожительницы относились к группе очень высокого риска (100%).
Среди наблюдавшихся больных преобладали пациенты с повышением уровней ОХС и ХС-ЛПНП: IIа, IIb и IV тип дислипидемии по Fredrickson D (1970). Выраженная гипертриглицеридемия (>12 ммоль/л) отмечена у одного больного (24 года).
После определения группы риска больным назначали лечение (табл. 3). Комбинацию статина и псиллиума исходно получали 334 пациента (46,3%). Следует отметить, что при включении в исследование (0 визит) больные, уже принимавшие статины, не достигли целевого уровня ХС-ЛПНП.
Оценивая гиполипидемический эффект от проводимой терапии, следует отметить, что уже к 12 нед лечения уровень ХС-ЛПНП достоверно снизился в среднем на 13,7%, а ОХС – на 12,6%. Изменения показателей триглицеридов и ХС-ЛПВП оказались недостоверными, и мы расцениваем их как тенденцию (табл. 4).
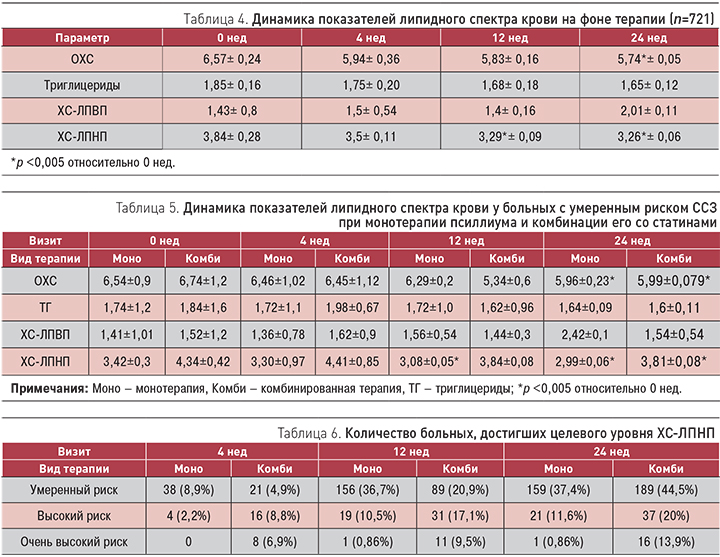
Рассмотрим динамику показателей липидного спектра в зависимости от группы сердечно-сосудистого риска. Пациенты с умеренным риском ССЗ получали либо только псиллиум в дозе 3 пакетика в сутки (309 больных), либо комбинированную терапию (статин + псиллиум; 116 больных). Динамика показателей липидного спектра в данной группе пациентов отражена в табл. 5. Если к 12 нед не был достигнут целевой уровень ХС-ЛПНП, то больным, получавшим один псиллиум, назначали комбинированную терапию. Однако у 156 пациентов с умеренным риском развития ССЗ показатели снизились до должного уровня. На основании этих результатов можно сделать вывод о том, что псиллиум оказался эффективным в качестве гиполипидемического средства у 36,7% пациентов с умеренным риском развития ССЗ (или у 21,6% от общего числа больных в нашем исследовании). Количество пациентов с различными степенями риска ССЗ, достигших целевого уровня ХС-ЛПНП, представлены в табл. 6.
К моменту завершения исследования снижение уровней ОХС и ХЛ-ЛПНП составляло в целом 8,58 и 12,5% соответственно. В группе комбинированной терапии снижение указанных показателей липидного спектра, несмотря на их более высокие исходные уровни, составило 10,49 и 13,7% соответственно.
Эффективность терапии у больных группы высокого риска оказалась следующей: на фоне монотерапии псиллиумом целевого уровня ХС ЛПНП достигли 11,6% пациентов, на комбинированной терапии (псиллиум + 20 мг статинов) – 20,01%, а в группе очень высокого риска 0,86 и 13,9% соответственно.
Так как наиболее частой причиной обращения пациентов к гастроэнтерологу является наличие запора или диареи, то в рамках представленного исследования проводилась оценка влияния псиллиума на изменение частоты и характера стула.
До начала лечения запор отмечали 49–51% женщин и 17–34% мужчин до 60 лет и 47–57% женщин и 64% мужчин старше 60 лет. Нормализацию стула на фоне приема псиллиума отметили 89,4% респондентов.
На фоне приема псиллиума стул стал более регулярным: с 4,2±1,1 до 6,9±2,32 раза в день. Консистенция стула по Бристольской шкале изменилась с1,7±1,06 до 4,2±1,98 балла.
Оценивая переносимость псиллиума, следует отметить, что такие побочные эффекты, как усиление изжоги, метеоризма и некоторые другие, требующие отмены препарата, в нашем исследовании не наблюдались. Около трети больных отмечали небольшое вздутие в первые недели приема псиллиума, не снижающее качество жизни и купировавшееся самостоятельно без изменения дозировки препарата.
ОБСУЖДЕНИЕ
В диетические рекомендации по нормализации нарушенного липидного обмена и рекомендации по питанию пациентов с запорами включено употребление достаточного количества пищевых волокон – 20–30 г/сут. Из медикаментозных средств на основе пищевых волокон обращает на себя внимание единственный лекарственный препарат, содержащий стандартизированную дозу высококачественных пищевых волокон сбалансированного состава — псиллиум, состоящий из оболочек семян Plantago ovata (подорожник овальный, подорожник индийский).
Пищевые волокна псиллиума состоят из трех фракций, каждая из которых обеспечивает лечебный эффект при различных видах нарушения функций кишечника:
- фракция A (30%), растворимая в щелочной среде, не ферментируется бактериями (выступает как наполнитель, создающий объем), нормализует моторику кишечника;
- гельформирующая фракция B (55%) представляет собой частично ферментируемую фракцию, которая связывает воду и желчные кислоты (способствует снижению уровня ХС); обеспечивает «смазывание» стула при запоре, при диарее – закрепляющее действие за счет связывания излишков воды и энтеротоксинов;
- фракция C (15%), вязкая и быстро ферментируемая кишечными бактериями, замедляет эвакуацию из желудка и оказывает пребиотическое действие (является субстратом роста нормальной микрофлоры кишечника и распадается до короткоцепочечных жирных кислот).
Группы липидоснижающих средств хорошо известны, однако их эффективность в достижении целевых показателей липидного спектра крови не превышает 70%. Это привлекает интерес исследователей к псиллиуму, чье гиполипидемическое действие было отмечено в большом числе рандомизированных клинических исследований. Нужно подчеркнуть, что ингибиторы ГМГ-КоА-редуктазы и секвестранты желчных кислот обладают синергизмом действия с псиллиумом и могут использоваться с ним одновременно. Гиполипидемическое действие псиллиума, продемонстрированное в нашем исследовании, обусловлено многогранностью его действий. Прежде всего это связывание желчных кислот в просвете тонкой кишки и препятствие их обратному всасыванию. Псиллиум стимулирует выработку желчных кислот из внутриклеточного холестерина посредством активации внутриклеточной 7-α гидроксилазы. В результате этого повышается активность Р-ЛПНП на поверхности гепатоцитов и увеличивается экстракция ХС-ЛПНП из крови, что приводит к снижению уровня ХС в плазме крови. Являясь пребиотиком, псиллиум повышает выработку короткоцепочечных жирных кислот, ингибирующих ГМГ-КоА-редуктазу, что снижает новый синтез ХС [27]. Эффективность псиллиума в профилактике атеросклероза и других сердечно-сосудистых заболеваний настолько высока, что с 1998 г. его применение рекомендовано американской Администрацией по надзору за продовольствием и лекарственными средствами (US FDA) и Американской ассоциацией кардиологов (American Heart Association) в качестве необходимого компонента диетической терапии у больных с легкой и умеренной гиперхолестеринемией. В 2003 г. эти рекомендации подтверждены Европейским медицинским агентством. Минздрав России Инструкцией П N014176-01-20.04.2017 одобрил новые показания к применению псиллиума при гиперхолестеринемии и дополнил раздел «фармакологические свойства: снижение холестерина на 7%» от 20 апреля 2017 г.
ЗАКЛЮЧЕНИЕ
Полученные результаты исследования позволили сделать следующие выводы:
- Эффективность монотерапии псиллиумом в качестве гиполипидемического средства выявлена у 36,7% пациентов с умеренным риском развития ССЗ (что составило 21,6% от общего числа пациентов с гиперлипидемией): к 12 нед достоверное снижение ОХС на 6,8%, ХС ЛПНП – на 10,62%. К завершению исследования снижение по этим показателям составило 8,58 и 12,5%. На фоне комбинированного лечения (со статинами), несмотря на более высокие исходные данные, снижение уровня ОХС составило 10,49%, а ХС-ЛПНП – 13,7%.
- В группах больных с высоким и очень высоким риском ССЗ доказано гиполипидемическое действие псиллиума и продемонстрирована возможность его одновременного назначения со статинами для синергизма действия.
- На фоне длительного лечения псиллиума стул нормализовался у большинства больных.
- Отмена препарата не потребовалась ни у одного пациента.



