Под острой декомпенсацией хронической сердечной недостаточности (ОДХСН) понимают период течения хронической сердечной недостаточности, при котором происходит быстрое нарастание симптомов сердечной недостаточности, что требует незамедлительной госпитализации с целью проведения интенсивной терапии. В структуре острой сердечной недостаточности (ОСН) от 48 до 75% всех вариантов занимает ОДХСН [1–6], которая ассоциируется с неблагоприятными исходами, такими как повторные госпитализации и смертность [7]. Повторные госпитализации у пациентов с ОДХСН составляют в течение года 48,1%, а по поводу сердечной недостаточности в течение года – 29,91% [1]. Высока и летальность у пациентов с ОДХСН как во время нахождения в стационаре, так и после выписки: по данным различных наблюдений, летальность в стационаре составляет от 3,2 до 7,4%, после выписки из стационара в течение 3 мес – 8,8%, в течение года – от 22,6 до 27,2% [1, 2, 4–5]. В основе патофизиологического каскада декомпенсации сердечной недостаточности лежат такие патологические реакции, как гемодинамическая перегрузка, венозный застой, воспаление, эндотелиальная дисфункция, оксидативный стресс, а также нарушение функции почек [8], что является важным прогностическим фактором у данной группы пациентов. Смертность пациентов, госпитализированных по поводу ОДХСН и имеющих снижение функции почек, в два–три раза выше в сравнении с пациентами, у которых функция почек во время лечения не менялась [9]. Острое повреждение почек (ОПП) у пациентов с ОДХСН развивается в 25–70% случаев и ассоциируется с более продолжительной госпитализацией и большой частотой повторных госпитализаций по поводу хронической сердечной недостаточности (ХСН), прогрессированием хронической болезни почек (ХБП), сердечно-сосудистой и общей смертностью [10–12]. Смертность больных с ОПП составляет 28–82%. К моменту выписки из стационара у 40% пациентов функция почек не восстанавливается [13, 14]. ОПП у пациентов с ОДХСН может рассматриваться в рамках кардиоренального синдрома I типа, т.е. острое ухудшение сердечной функции, ведущее к острому повреждению почек [15, 16]. К патофизиологическим механизмам, лежащим в основе кардиоренального синдрома I типа, относят как гемодинамические факторы (снижение почечного кровотока, ухудшение интраренальной ауторегуляции гломулярного кровотока [17], вазоконстрикцию интраренальных артерий, увеличение почечного венозного давления [18]), так и негемодинамические (активацию ренин-ангиотензин-альдостероновой системы, симпатической нервной системы, воспаления [19], оксидативный стресс, снижение продукции оксида азота [20]).
Раннее выявление ОПП позволяет начать лечение, предупредить развитие осложнений и снизить летальность. Однако до 50% функции почек может быть утрачено еще до повышения креатинина [21]. В связи с этим большое значение отводится поиску новых методов диагностики, в том числе и инструментальной, для более ранней постановки диагноза и возможности прогнозирования ОПП. Визуализирующие методы исследования почек (дуплексное сканирование почечных артерий) могут позволить с высокой точностью диагностировать острое повреждение почек на ранних этапах его развития.
 Целью настоящего исследования было изучение особенностей кардиоренального синдрома у пациентов с острой декомпенсацией хронической сердечной недостаточности со сниженной систолической функцией и возможности диагностики с помощью дуплексного сканирования почечных артерий.
Целью настоящего исследования было изучение особенностей кардиоренального синдрома у пациентов с острой декомпенсацией хронической сердечной недостаточности со сниженной систолической функцией и возможности диагностики с помощью дуплексного сканирования почечных артерий.
МАТЕРИАЛ И МЕТОДЫ
В исследование были включены 60 пациентов (100% мужчины) с острой декомпенсацией хронической сердечной недостаточности (BNP >500 пг/мл) и сниженной фракцией выброса левого желудочка (ФВ ЛЖ = 27,05 [23,25; 32,75]%, возраст 62,0±11,1 лет), госпитализированных в отдел «Заболевания миокарда и сердечной недостаточности» ФГБУ НМИЦ кардиологии Минздрава России. Развитие ХСН было обусловлено ИБС, АГ и ДКМП. Наиболее распространенной причиной развития сердечной недостаточности являлась ИБС (65%). Общая характеристика включенных в исследование пациентов приведена в табл. 1.
В наблюдение не включали пациентов с острым коронарным синдром, инсультом в последние 6 мес, обструкцией выносящего тракта левого желудочка, констриктивным перикардитом, рестриктивной кардиомиопатией, шоком различной этиологии, нарушениями функции почек тяжелой степени (СКФ <30 мл/мин/1,73 м2, уровень креатинина в крови ≥220 мкмоль/л), острым гломерулонефритом, острым пиелонефритом, инсулинзависимым сахарным диабетом.
Проводилось общеклиническое обследование; для оценки тяжести симптомов СН использовалась функциональная классификация ХСН Нью-Йоркской кардиологической ассоциации (NYHA) ESC (2012) [22] и ОССН – РКО – РНМОТ (2013) [23]. Всем пациентам была выполнена комплексная трансторакальная эхокардиография, которая выполнялась на ультразвуковых сканерах высокого и экспертного уровня Vivid E9, Vivid 7 Dimension (GE, Norway), Philips iE 33 (Philips Germany) кардиологическим датчиком с диапазоном частот от 3,5 до 5 МГц. Исследование проводилось по стандартной методике. Дуплексное сканирование почечных артерий проводилось в области дистальных отделов основного ствола почечной артерии на ультразвуковом сканере Voluson E8 Expert (GE Healthcare Austria GmbH & Co OG, Austria) конвексным датчиком с частотой 2–5 мГц и конвексным матричным датчиком с частотой 1–7 мГц в режимах цветового допплеровского картирования и импульсно-волновом. Для определения состояния почечной гемодинамики производилась оценка пиковой систолической (Vps, см/с), конечной диастолической (Ved, см/с) скоростей артериального кровотока, определяемых на вершине максимального систолического пика и в конце диастолы соответственно. Уровень индекса резистентности определялся как отношение разности пиковой систолической и конечной диастолической скоростей кровотока к пиковой систолической скорости кровотока: RI=(Vps-Ved)/Vps).
Кроме общеклинических исследований крови и мочи, проводили биохимический анализ крови на анализаторе ARCHITECT c 8000 Abbott (USA) с определением содержания креатинина, мочевины, мочевой кислоты, АЛТ, АСТ, билирубина, глюкозы, уровней калия, натрия и хлора. Биохимические анализы крови выполняли как при поступлении пациентов в стационар, так и на протяжении всей госпитализации, достижении компенсации ОДХСН.
Дуплексное сканирование почечных артерий проводилось дважды: при поступлении пациента в стационар и при достижении компенсации ОДХСН. Острое повреждение почек диагностировали и классифицировали согласно соответствующим рекомендациям KDIGO (Kidney Disease: Improving Global Outcomes Clinical Practice Guidelines fоr Acute Kidney Injury) 2012 г.: при повышении уровня креатинина сыворотки крови ≥26,5 мкмоль/л за 48 ч, или повышении уровня креатинина в сыворотке крови в ≥1,5 раза в сравнении с исходным уровнем (в течение предшествующих 7 сут), или объем мочи <0,5 мл/кг/ч за 6 ч [24]. У пациентов с развившимся ОПП при отсутствии сведений об исходной величине концентрации креатинина использовали «базальные» значения креатинина в крови, соответствующие величинам СКФ 75 мл/мин/м2.
Хроническую болезнь почек диагностировали и классифицировали согласно соответствующим рекомендациям KDIGO (Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease) 2012 г. [25]. Критерием ХБП считали скорость клубочковой фильтрации менее 60 мл/мин/1,73 м2 продолжительностью 3 мес и более с наличием повреждения почек или без признаков повреждения. Расчет СКФ у пациентов с ХБП проводился расчетным методом по формуле CKD-EPI.
Статистическую обработку материала проводили с использованием пакета прикладных программ IBM SPSS Statistic 17,0. Нулевая гипотеза о соответствии распределения нормальному закону проверялась с использованием теста Шапиро–Уилка. Для количественных переменных с нормальным распределением рассчитывалось среднее арифметическое значение (М) и стандартное отклонение среднего значения (SD). При отклонении параметров распределения от нормального данные представляли в виде медианы (Ме) с указанием 25 и 75 перцентилей. Корреляционный анализ выполнялся методом Спирмена. При проведении RОС-анализа были определены наиболее значимые диагностические маркеры. Качество модели в зависимости от AUC (площадь под ROC-кривой) определялось исходя из следующей градации: 0,9–1,0 – отличное; 0,8–0,9 – очень хорошее; 0,7–0,8 – хорошее; 0,6–0,7 – среднее; до 0,6 – неудовлетворительное. Оценку риска развития острого повреждения почек проводили методом логистической регрессии. Определяли отношение шансов (ОШ) и 95% ДИ. Значимыми считали различия при значении р <0,05 при условии, что значения 95% ДИ для ОШ не пересекали единицу.
РЕЗУЛЬТАТЫ
Согласно критериям KDIGO, у пациентов, госпитализированных по поводу ОДХСН, в 48,3% случаев была выявлена ОПП. Пациенты с ОПП имели I стадию острого повреждения почек. Чаще регистрировалось внебольничное (догоспитальное) ОПП (62,07% случаев).
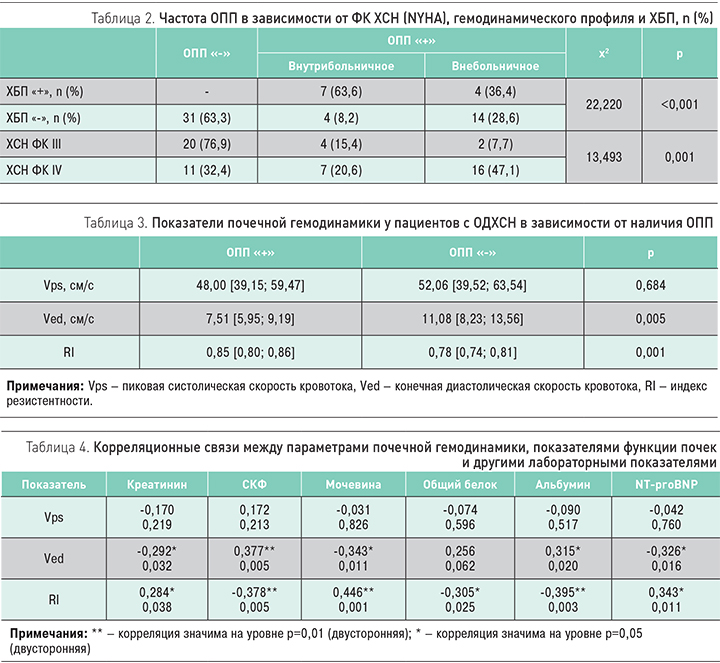
Наиболее тяжелые пациенты – с IV ФК (NYHA) – имели высокий риск развития ОПП (p=0,001). Кроме того, высокий риск развития внутрибольничного ОПП имели пациенты, чей анамнез был отягощен наличием ХБП (р <0,001) (табл. 2).
У пациентов с острой декомпенсацией ХСН ОПП de novo встречалось чаще, чем ОПП на ХБП (62,07 и 37,933% соответственно).
При исследовании параметров почечной гемодинамики с помощью дуплексного сканирования почечных артерий у пациентов с ОПП, по сравнению с пациентами без ОПП, было выявлено значимое снижение уровня конечной диастолической скорости кровотока (p=0,005) и повышенные значения индекса резистентности (p=0,001) (табл. 3).
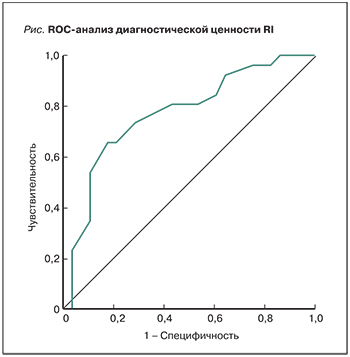 В диагностике ОПП большое значение имеет определение индекса резистентности. По данным ROC-анализа, проведенного с целью определения диагностической ценности индекса резистентности в диагностике ОПП, площадь под кривой составила RI=0,771 (рис.), что указывает на хорошее качество модели.
В диагностике ОПП большое значение имеет определение индекса резистентности. По данным ROC-анализа, проведенного с целью определения диагностической ценности индекса резистентности в диагностике ОПП, площадь под кривой составила RI=0,771 (рис.), что указывает на хорошее качество модели.
При отрезном значении RI 0,805 чувствительность и специфичность составили 73,1 и 71,4% соответственно.
Таким образом, при поступлении у пациентов с ОПП определялся повышенный уровень индекса резистентности, что является значимым признаком в диагностике ОПП.
При анализе взаимосвязи параметров почечной гемодинамики, полученных при проведении дуплексного сканирования почечных артерий, с биохимическими показателями крови, отражающими функцию почек, установлены статистически значимые корреляционные связи (табл. 4).
У пациентов с ОДХСН выявлена значимая прямая корреляция индекса резистентности с уровнями креатинина (r=0,284; p=0,038) и мочевины (r=0,446; p=0,001), а также конечной диастолической скорости кровотока с СКФ (r=0,377; p=0,005). Кроме того, установлена обратная корреляционная связь индекса резистентности с СКФ (r=-0,378; p=0,005), а также конечной диастолической скорости кровотока с уровнем креатинина (r=-0,292; p=0,032), мочевины (r=-0,343; p=0,011) и NT-proBNP (r=-0,326; p=0,016). При этом отмечены значимые корреляционные связи параметров почечной гемодинамики с содержанием альбумина и общего белка крови.
Также проведен корреляционный анализ связей между параметрами почечной гемодинамики и клинико-функциональными показателями, сопутствующей патологией и возрастом. Установлены статистически значимые связи. У пациентов с ОДХСН отмечены прямые корреляционные связи индекса резистентности с ФК ХСН (NYHA) (r=0,396; p=0,003), возрастом (r=0,375; p=0,005), наличием СД 2 типа (r=0,290; p=0,034), также выявлены обратные корреляционные связи индекса резистентности с массой тела (r=-0,394; p=0,003) и ИМТ (r=-0,417; p=0,002). Установлены прямые корреляционные связи между конечной диастолической скоростью кровотока и величиной диуреза (r=0,472; p <0,001), а также пиковой систолической скоростью кровотока и величиной диуреза (r=0,434; p=0,001). Конечная диастолическая скорость кровотока имела обратные корреляционные связи с ФК ХСН (NYHA) (r=-0,425; p=0,001) и ХБП (r=-0,282; p=0,039). Кроме того, отмечены значимые корреляционные связи конечной диастолической скорости кровотока с гемодинамическими показателями, весом, ИМТ и возрастом.
С помощью полученных нами отрезных значений при проведении ROC-анализа исследуемые непрерывные показатели были сведены к бинарным. Для построения 95% ДИ и оценки отношения шансов (ОШ) для исследуемого показателя применяли модель бинарной логистической регрессии. В однофакторном регрессионном анализе установлено, что при RI >0,805 риск развития ОПП увеличивается в 5,7 раз (95% ДИ: 1,856; 17,594).
ОБСУЖДЕНИЕ
В настоящее время существует повышенный интерес к проблеме поражения органов-мишеней у пациентов с ОДХСН [26–28]. При остром кардиоренальном синдроме I типа острое ухудшение сердечной функции приводит к острому почечному повреждению. В нашей работе проведено исследование частоты ОПП у пациентов, госпитализированных с ОДХСН. ОПП было определено в 48,33% случаев на основании критериев KDIGO. Высокий риск развития внутрибольничного ОПП отмечался у пациентов с наличием ХБП в анамнезе (p <0,001), что согласуется с данными проведенных исследований. Так, Yang с соавт. показали, что у пациентов, госпитализированных с ОДСН (n=103), частота развития ОПП составила 47,6% случаев [29]. В исследовании Zhou с соавт. у пациентов, госпитализированных с ОДСН (n=1005), частота развития ОПП составила 44,3% случаев. Риск развития ОПП был связан с наличием ХБП в анамнезе [26].
Кроме определения уровня креатинина и расчета СКФ, для определения ОПП в нашем исследовании применялся метод дуплексного сканирования почечных артерий для неинвазивной оценки почечной гемодинамики. У пациентов с ОПП отмечались снижение уровня конечной диастолической скорости (p=0,005) и повышение уровня индекса резистентности (p=0,001). Следует отметить, что в работе Л.О. Глазун резкое снижение диастолической скорости кровотока и повышение индекса резистентности отмечалось в стадии олигоанурии [30], в нашей работе аналогичные изменения были выявлены у пациентов с ОДХСН еще до олигоурической стадии. При этом индекс резистентости имел тесную корреляционную связь с рядом биохимических показателей, таких как альбумин и общий белок, что говорит о тесной патофизиологической связи тяжести декомпенсации и степени застойных явлений не только в почках, но и в печени. Кроме того, установлено, что при индексе резистентности более чем 0,805 риск развития ОПП увеличивается в 5,7 раз (95%ДИ: 1,856; 17,594), что делает метод дуплексного сканирования почечных артерий актуальным для выявления ОПП у пациентов с ОДХСН.
ЗАКЛЮЧЕНИЕ
Острое повреждение почек развивается у 48,3% пациентов, госпитализированных с острой декомпенсацией хронической сердечной недостаточности. В большинстве случаев пациенты с наличием хронической болезни почек в анамнезе имели высокий риск развития внутрибольничного ОПП. С целью ранней диагностики ОПП у пациентов с ОДХСН, кроме определения креатинина и СКФ, целесообразно выполнять дуплексное сканирование почечных артерий, при котором у данной категории пациентов выявляются сниженные уровни конечной диастолической скорости кровотока и повышенные уровни индекса резистентности.


