В настоящее время проблема сахарного диабета (СД) приняла масштабы неинфекционной пандемии: по данным официальной статистики, в России за 18 лет (2000–2018) число людей с этим диагнозом возросло на 2,5 млн и достигло 4 574 575 чел. [1]. Среди нарушений углеводного обмена наибольшее число случаев представлено СД типа 2 (СД 2), который протекает на фоне избыточного веса, инсулинорезистентности и компенсаторной гиперинсулинемии и в значительной мере связан с образом жизни (перееданием, низкой физической активностью, отсутствием желания менять что-либо в привычках и др.).
По данным международной диабетической ассоциации, 21,3 млн (16,2%) детей, рожденных в 2017 г., в период внутриутробного развития подвергались воздействию той или иной формы гипергликемии. В большинстве случаев (86,4%) это был гестационный СД (ГСД), значительно реже (6,2%) другие типы СД, диагностированные до наступления беременности, и еще в 7,4% случаев – СД типа 1 (СД 1) и СД 2, впервые выявленные во время беременности [2].
У беременных СД ассоциируется с высоким риском осложнений как со стороны матери, включая развитие тяжелой преэклампсии (ПЭ), эклампсии, материнской смертности, так и со стороны плода и новорожденного (задержки внутриутробного развития, диабетическая фетопатия, травмы ребенка во время родов и другие патологии) [3, 4]. Наличие СД у матери определяет высокий риск развития ожирения и СД 2 в более раннем возрасте у ее детей [5]. Вместе с тем нужно отметить, что своевременное выявление гипергликемии в период беременности, рациональное питание, умеренные физические нагрузки, мониторинг уровня гликемии в течение дня, при необходимости инсулинотерапия позволяют в настоящее время женщинам с СД иметь здорового ребенка, хотя еще несколько десятилетий назад, например, диагноз СД 1 являлся абсолютным противопоказанием к беременности.
Целью настоящего исследования стал анализ перинатальных исходов и состояния новорожденных у женщин с различными типами СД в реальной клинической практике.
МАТЕРИАЛЫ И МЕТОДЫ
Анализ перинатальных исходов проведен на основании исследования историй болезни 434 пациенток в возрасте от 19 до 43 лет (средний возраст 31,03±4,85 лет),находившихся под наблюдением эндокринолога Центра эндокринных заболеваний беременных женщин специализированного родильного дома Городской клинической больницы № 29 им. Н.Э. Баумана и родоразрешенных в этом родильном доме в период 2016–2017 гг. 334 пациентки страдали различными нарушениями углеводного обмена: 137 (41,0%) – ГСД (1 группа), 115 (34,4%) – СД 1 (2 группа), 82 (24,6%) – СД 2 (3 группа). 100 женщин (4 группа) не имели нарушений углеводного обмена (нормогликемия).
Всем пациенткам было рекомендовано соблюдение диеты, соответствующей метаболическим потребностям матери и плода и направленной на предотвращение гипергликемии после еды и голодного кетоза натощак. Это касалось как режима (частые и небольшие приемы пищи), так и характера питания: преимущественное употребление нерафинированных углеводов (35–40%), жиров (35–40%), белков (20–25%). Суточная калорийность пищи при этом зависела от индекса массы тела (ИМТ) до беременности. Из питания предлагалось исключить продукты с высоким содержанием легкоусвояемых углеводов, включить большое количество нерафинированных углеводов с достаточным содержанием клетчатки, умеренно ограничить жиры для профилактики чрезмерной прибавки в весе [6]. Кроме того, пациенткам были рекомендованы дозированные аэробные физические нагрузки – ходьба как минимум в течение 150 мин в неделю, плавание в бассейне.
Среди беременных с ГСД и СД 2 были пациентки как на диетотерапии, так и на инсулинотерапии. Так, в 1 группе 22,6% женщин получали инсулин и 78,4% были на диетотерапии, в 3 группе большинство (92,8%) находилось на инсулинотерапии и 7,2% пациенток – на диетотерапии.
Во 2 группе (пациентки с СД 1), что закономерно; все 115 женщин получали инсулин.
Степень компенсации углеводного обмена оценивали по уровню гликированного гемоглобина (HbA1с), который определяли в I и III триместрах беременности. Кроме того, у всех пациенток рассчитывали ИМТ по формуле Кетле (отношение массы тела в килограммах к росту в метрах, возведенному в квадрат) до наступления беременности, оценивали наличие или отсутствие одного из осложнений беременности – ПЭ, определяли гестационный возраст, способ родоразрешения.
У новорожденных, по данным, указанным в истории родов, проводили клиническую оценку состояния с помощью стандартизированной шкалы Апгар на первой и пятой минутах жизни, фиксировали массу тела при рождении (М), уровень гликемии, наличие признаков диабетической фетопатии (ДФ), которая представляет собой клинико-лабораторный симптомокомплекс, развивающийся у детей, рожденных от матерей с СД, и не сопровождающийся пороками развития. Диагноз ДФ устанавливали неонатологи при осмотре новорожденного, фиксируя макросомию (М более 4000 г) и фенотипические признаки ДФ – лунообразное лицо, короткую шею, избыточную подкожно-жировую клетчатку, отечный синдром, петехии и кровоизлияния на коже, гипертрихоз [7]. В первые часы жизни определяли уровень гликемии: при уровне сахара крови менее 2,6 ммоль/л диагностировали неонатальную гипогликемию. При неустойчивой гемодинамике, физикальных признаках кардиопатии на 2–3-е сутки жизни новорожденного проводили эхокардиографию.
Полученные результаты были обработаны с использованием пакета прикладной статистики SPSS 24.0 for Mac (SPSS inc., США). Данные в тексте представлены в виде средней арифметической и ее среднеквадратичного отклонения (M±SD). Различия частоты встречаемости анализируемого признака (Pn) считали достоверными при уровне значимости p <0,05.
РЕЗУЛЬТАТЫ
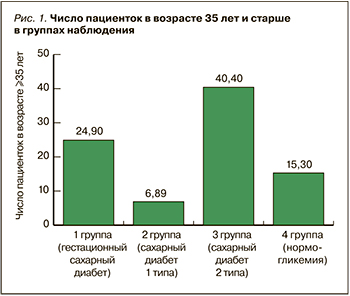 Анализ некоторых клинико-демографических параметров в группах наблюдения показал, что женщины с ГСД и СД 2 были старше по сравнению с пациентками с СД 1 и нормогликемией. Нарушение жирового обмена чаще имело место среди беременных с ГСД и СД 2: так, ИМТ до беременности в этих группах оказался достоверно выше, чем у пациенток с СД 1 и нормогликемией (табл. 1). Кроме того, оказалось, что «возрастные» беременные – женщины в возрасте 35 лет и старше – достоверно чаще были среди пациенток с ГСД и СД 2 (рис. 1).
Анализ некоторых клинико-демографических параметров в группах наблюдения показал, что женщины с ГСД и СД 2 были старше по сравнению с пациентками с СД 1 и нормогликемией. Нарушение жирового обмена чаще имело место среди беременных с ГСД и СД 2: так, ИМТ до беременности в этих группах оказался достоверно выше, чем у пациенток с СД 1 и нормогликемией (табл. 1). Кроме того, оказалось, что «возрастные» беременные – женщины в возрасте 35 лет и старше – достоверно чаще были среди пациенток с ГСД и СД 2 (рис. 1).
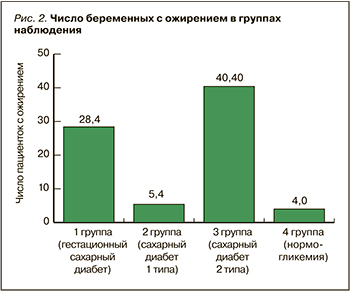
Поскольку ИМТ в группах наблюдения имел широкий диапазон значений, мы выделили пациенток с ИМТ ≥30 кг/м2; оказалось, что ожирение различной степени тяжести имело место более чем у 40% беременных с СД 2; в 1,5 раза реже его диагностировали у женщин с ГСД и в небольшом проценте случаев – у пациенток с СД 1 и нормогликемией (рис. 2).
 Нужно отметить, что в I триместре беременности у пациенток с СД 1 и СД 2 в среднем уровень гликированного гемоглобина был выше целевых значений (>6%) [8]. Это было обусловлено тем, что среди них были женщины, у которых состояние углеводного обмена соответствовало декомпенсации (HbA1с 7,5–12,4%): в 1 группе – 23,5%, 3 группе – 8,5%. В результате коррекции сахароснижающей терапии и диеты практически у всех беременных с СД к III триместру уровень HbA1с достиг значений, свидетельствующих о компенсации диабета, что, по-видимому, позволило пролонгировать беременность во всех группах наблюдения практически до физиологического срока. Такое грозное осложнение, как ПЭ, осложняла течение беременности во всех группах наблюдения, но достоверно чаще ее диагностировали у женщин с ГСД и СД 1, в то время как у беременных с СД 2 и нормогликемией она встречалась реже и с одинаковой частотой. Следует подчеркнуть, что почти 80% женщин с СД 1 были родоразрешены путем кесарева сечения, у пациенток с СД 2 его проводили в 2 раза реже, но и в том, и в другом случае частота кесарева сечения была достоверно выше, чем у беременных с ГСД и нормогликемией.
Нужно отметить, что в I триместре беременности у пациенток с СД 1 и СД 2 в среднем уровень гликированного гемоглобина был выше целевых значений (>6%) [8]. Это было обусловлено тем, что среди них были женщины, у которых состояние углеводного обмена соответствовало декомпенсации (HbA1с 7,5–12,4%): в 1 группе – 23,5%, 3 группе – 8,5%. В результате коррекции сахароснижающей терапии и диеты практически у всех беременных с СД к III триместру уровень HbA1с достиг значений, свидетельствующих о компенсации диабета, что, по-видимому, позволило пролонгировать беременность во всех группах наблюдения практически до физиологического срока. Такое грозное осложнение, как ПЭ, осложняла течение беременности во всех группах наблюдения, но достоверно чаще ее диагностировали у женщин с ГСД и СД 1, в то время как у беременных с СД 2 и нормогликемией она встречалась реже и с одинаковой частотой. Следует подчеркнуть, что почти 80% женщин с СД 1 были родоразрешены путем кесарева сечения, у пациенток с СД 2 его проводили в 2 раза реже, но и в том, и в другом случае частота кесарева сечения была достоверно выше, чем у беременных с ГСД и нормогликемией.
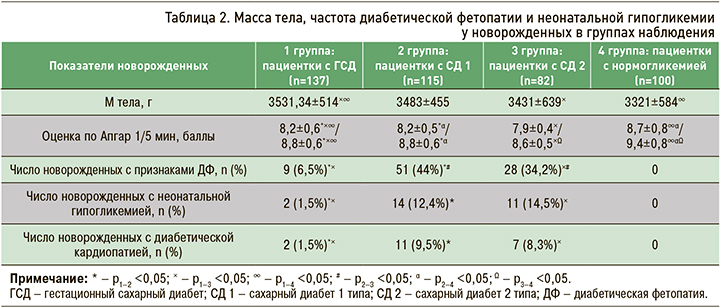
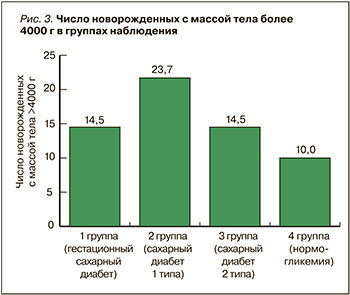 Обращает на себя внимание, что у беременных с ГСД имела место чрезмерная общая прибавка в весе за период гестации, а патологическая прибавка массы тела отмечалась только в этой группе и у женщин с СД 2, что, несомненно, отразилось на состоянии новорожденного. Так, оказалось, что средний вес новорожденных у всех женщин с СД 1, нарушением углеводного обмена (независимо от их формы) был достоверно повышен по сравнению с контрольной группой, но существенно не различался у женщин с ГСД, СД 1 и СД 2 (табл. 2). Вместе с тем доля детей с макросомией была наибольшей среди женщин с СД 1 (рис. 3).
Обращает на себя внимание, что у беременных с ГСД имела место чрезмерная общая прибавка в весе за период гестации, а патологическая прибавка массы тела отмечалась только в этой группе и у женщин с СД 2, что, несомненно, отразилось на состоянии новорожденного. Так, оказалось, что средний вес новорожденных у всех женщин с СД 1, нарушением углеводного обмена (независимо от их формы) был достоверно повышен по сравнению с контрольной группой, но существенно не различался у женщин с ГСД, СД 1 и СД 2 (табл. 2). Вместе с тем доля детей с макросомией была наибольшей среди женщин с СД 1 (рис. 3).
Состояние новорожденных по шкале Апгар у женщин с нормогликемией закономерно оказалось лучше, чем в других группах, где по этому параметру существенной разницы не наблюдалось. Признаки ДФ были выявлены только у новорожденных от матерей с СД, при этом максимальное количество младенцев с ДФ было в группах с СД 1 и СД 2. В этих же группах достоверно чаще диагностировали диабетическую кардиопатию и неонатальную гипогликемию (см. табл. 2).
Необходимо подчеркнуть, что, хотя и значительно реже, но новорожденные с признаками ДФ, диабетической кардиопатией и гипогликемией встречались и у пациенток с ГСД.
ОБСУЖДЕНИЕ
Среди факторов риска развития ГСД и СД 2 большую роль отводят ожирению, частота которого во всем мире неуклонно возрастает среди всех слоев населения, включая среди женщин репродуктивного возраста. В России число беременных с ожирением достаточно велико и колеблется от 15 до 38%, среди них преобладают женщины в возрасте 21–25 лет (32%) и 26–30 лет (26–30%) [8]. Это подтверждают и результаты проведенного нами исследования, показавшие, что у беременных с ГСД средняя величина ИМТ соответствовала категории «избыточная масса тела», а у беременных с СД 2 – категории «ожирение», причем в этих группах оказалось достоверно больше женщин с ИМТ ≥30 кг/м2.
Сама физиологическая беременность способствует повышению ИМТ не только за счет плаценты и роста плода, но и из-за увеличения жировой массы, обусловленной физиологической инсулинорезистентностью, которая развивается вследствие синтеза плацентой стероидных гормонов (плацентарного лактогена, эстрогенов, прогестерона), повышения образования кортизола корой надпочечников при одновременном изменении метаболизма и тканевого эффекта инсулина. Последствием инсулинорезистентности и недостаточной секреции инсулина становится повышение концентрации в плазме крови глюкозы, свободных жирных кислот, некоторых аминокислот и кетонов [9]. Инсулинорезистентность усугубляется также увеличением калорийности принимаемой матерью пищи, снижением физической активности и прибавкой в весе. Эти особенности углеводного метаболизма при беременности могут провоцировать развитие ГСД у женщин с генетической предрасположенностью к СД. Патогенетическая общность ГСД и СД 2 подтверждается тем, что в отдаленном периоде после родов (5–12 лет) 20% женщин с ГСД в анамнезе заболевают СД 2 [10]. Один из неблагоприятных факторов гестационного периода у беременных с СД – патологическая прибавка в весе, которая, по нашим данным, имела место только у женщин с ГСД и СД 2; на наш взгляд, это также подчеркивает общность патогенетических механизмов данных метаболических нарушений. Течение беременности во всех группах наблюдения осложнялось ПЭ, частота которой была наибольшей и сопоставимой у женщин с ГСД и СД 1. При этом родоразрешение путем кесарева сечения достоверно чаще имело место у женщин с СД 1 и СД 2: это может указывать как на более тяжелое течение у них ПЭ, патогенетическим методом лечения которой служит досрочное родоразрешение [11], так и на частые гипогликемические состояния на поздних сроках беременности из-за снижения активности гормонов плаценты, что определяет сроки родоразрешения. Кроме того, свою роль играет сложившаяся практика оперативного родоразрешения не только пациенток с тяжелой экстрагенитальной патологией, но и в ряде случаев с физиологической беременностью. По данным исследователей [12], в большинстве стран мира частота кесарева сечения при СД 1 и СД 2 составляет более 50%, что сопоставимо с нашими данными по СД 2, но оперативное родоразрешение у женщин с СД 1 имело место в полтора раза чаще. Вместе с тем известно, что кесарево сечение нарушает эволюционно отработанный процесс родов: приводит к отсутствию физиологического родового стресса для плода, увеличению частоты респираторного дистресс-синдрома, транзиторному тахипноэ у новорожденных, нарушению колонизации кишечника, функциональной незрелости органов и систем. Кроме того, эта операция является наиболее важным фактором риска послеродовых осложнений – венозных тромбоэмболий, кровотечения и другого, в связи с чем была принята резолюция ВОЗ с рекомендацией ограничить долю кесаревых сечений при физиологических родах – не более 15% [13].
По данным нашего исследования, оказалось, что гестационный срок родоразрешения у женщин с ГСД был достоверно выше по сравнению с пациентками всех остальных групп, у которых этот показатель существенно не различался, но приближался к физиологическому. На наш взгляд, этот положительный факт обусловлен эффективностью динамического мониторинга клинического состояния пациенток в специализированном эндокринологическом отделении для беременных женщин и достаточной компенсацией углеводного обмена, что подтверждено данными уровня HbA1с как в I, так и III триместрах беременности. В качестве сравнения можно привести результаты исследования, проведенного в 2015 г. в Великобритании, включившего 3085 женщин с СД 1 и СД 2, у которых оценивались перинатальные исходы. Оказалось, что гестационный возраст у беременных с СД 1 и СД 2 был значительно ниже, по сравнению с полученными нами данными, составив 36,4±2 и 37,1±2 нед соответственно. Возможно, что такие результаты обусловлены недостаточной компенсацией углеводного обмена в обеих группах наблюдения: у женщин с СД 1 уровень HbA1с составил 7,6% (6,8–8,7) в I триместре и 6,7% (6,1–7,8) в III триместре беременности, у пациенток с СД 2 – 6,8% (6,2–8,0) и 5,9% (5,5–6,5) соответственно. Число новорожденных с макросомией от матерей с СД 1 составило 46,4%, от матерей с СД 2 – 23,9% [14].
В нашем исследовании, несмотря на хорошие показатели HbA1с, примерно у 14% новорожденных от матерей с СД 1 и СД 2 и в двух случаях с ГСД имела место неонатальная гипогликемия.
В то же время известно, что даже при оптимальной коррекции СД у беременной часть детей рождается с симптомами неонатальной гипогликемии и ДФ [8, 15]. При этом отмечается четкая взаимо-связь между развитием гипоксически-ишемического поражения ЦНС у новорожденных и низкими показателями гликемии в раннем неонатальном периоде [16]. Это делает актуальными мероприятия по контролю уровня гликемии матери, своевременное выявление и коррекция которой способствует снижению осложнений беременности, частоты макросомии и гипогликемий новорожденного, что было также отмечено в нашем исследовании.
Одним из специфических и наиболее тяжелых заболеваний плода и новорожденного при СД матери является симптомокомплекс ДФ, осложняющий от 40,0 до 60,0% беременностей. Полученные нами данные оказались сопоставимы с этими показателями: частота рождения детей с ДФ у женщин с СД 1 была 44,0%, с СД 2 – 34,2%.
В группе женщин с ГСД число новорожденных с ДФ было незначительным (6,5%), хотя, по некоторым данным, ДФ у новорожденных от матерей с ГСД встречается чаще и протекает по более тяжелому варианту [17].
ЗАКЛЮЧЕНИЕ
Таким образом, в реальной клинической практике 25% женщин с ГСД и 40% с СД 2 находятся в категории «возрастных» беременных, что вероятно определяет большую частоту среди них пациенток с ожирением, патологической прибавкой в весе за период гестации и ПЭ. Вместе с тем динамическое наблюдение, адекватная инсулинотерапия, соблюдение диетического режима, контроль гликемии способствовали компенсации СД, что привело к пролонгированию беременности до сроков, близких к физиологическому, но 77% беременных с СД 1 и 43% с СД 2 были родоразрешены путем кесарева сечения. Основными негативными последствиями для новорожденного, преимущественно от матерей с СД 1 и СД 2 и реже с ГСД, явились макросомия плода, ДФ, неонатальная гипогликемия, диабетическая кардиопатия, которые часто имели место у этих пациенток, несмотря на достаточную компенсацию диабета.


