Ожирение в современном мире является распространенным заболеванием, значительно увеличивающим риск смерти от сердечно-сосудистых катастроф и усугубляющим течение коморбидных состояний.
Эффективным методом лечения тяжелого (морбидного) ожирения служат методы бариатрической хирургии; по данным регистра Международной федерации хирургии ожирения и метаболических нарушений (IFSO), за 2018 г. в мире было выполнено почти 400 тыс. таких операций [1]. Наиболее распространенные на сегодняшний день варианты бариатрических вмешательств – рукавная гастропластика (РГ) и гастрошунтирование (ГШ) [2, 3]. Значимое снижение массы тела в послеоперационном периоде происходит, как правило, до 12–18 мес (фаза плато) [4]. Однако, несмотря на сравнительно высокую эффективность этих операций по сравнению с традиционными методами лечения ожирения, после их проведения наблюдаются случаи как неэффективного снижения, так и повторного набора массы тела [5–7].
По данным литературы, повторный набор массы тела встречается у 15–40% пациентов после бариатрических вмешательств в зависимости от срока послеоперационного наблюдения и типа выполняемой операции [6, 8]. Во многих работах за клинически значимый повторный набор веса принимают 10–25% от потерянной массы тела [8, 9]. Небольшое увеличение массы тела после достижения минимального веса является физиологическим и не требует врачебного вмешательства. Набор более 15% от потерянной массы тела связан с ухудшением течения ассоциированных состояний (артериальной гипертензии, сахарного диабета, синдрома обструктивного апноэ сна и др.), что требует возобновления или усиления соответствующей терапии. Таким образом, повторный набор массы тела требует лечения; при этом у части пациентов допустимо использование медикаментозных средств, другим же требуется проведение повторной бариатрической операции.
Существующие литературные данные по прогнозу послеоперационной динамики массы тела немногочисленны. Важной клинической задачей выступает предотвращение повторного набора массы тела. Помимо вклада технических особенностей оперативного вмешательства и пищевого поведения пациентов, обсуждаются клинические факторы, способные повлиять на послеоперационную динамику массы тела.
Цель исследования – изучить влияние клинических характеристик пациентов с ожирением на динамику и развитие повторного набора массы тела после выполнения бариатрических вмешательств.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн: наблюдательное одноцентровое открытое проспективное клиническое исследование с участием пациентов с ожирением II и III степени, перенесших РГ или ГШ.
Критерии включения:
- пациенты с ожирением не менее II степени (индекс массы тела ≥35 кг/м2) после РГ или ГШ;
- возраст от 18 до 75 лет;
- подписанное информированное согласие на участие в исследовании.
Критерии невключения:
- наличие декомпенсированной хронической патологии;
- любые серьезные или неконтролируемые физические или психические заболевания;
- пациенты, которым ГШ выполнялось в качестве второго этапа после РГ.
Критерии исключения – отказ пациента участвовать в исследовании.
Исследование проводилось на базе кафедры факультетской хирургии и кафедры факультетской терапии Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова. Набор пациентов и формирование групп осуществляли с мая 2014 г. по июнь 2016 г. Время послеоперационного наблюдения в среднем составило 3,57 лет.
Перед выполнением бариатрического вмешательства у всех пациентов оценивали массу тела, рост, окружность талии (ОТ) и бедер (ОБ), рассчитывался индекс «талия–бедра» (ОТ/ОБ). Индекс массы тела (ИМТ, кг/м2) определялся по формуле масса тела (кг)/рост2 (м).
После бариатрического вмешательства всем пациентам были даны рекомендации относительно режима питания, диеты, физической активности и приема минерально-витаминных добавок. Всем пациентам было предложено участие в Программе поддержания массы тела, включающей регулярные контакты с эндокринологом-диетологом не менее 2 раз в месяц (в том числе телефонные контакты и контакты с помощью мессенджеров) и ведение пищевого дневника. Пациенты, пропустившие более 2 контактов подряд с лечащим врачом, а также отказавшиеся от участия в Программе поддержания массы тела, составили группу сравнения и наблюдались 1 раз в 3 мес.
Для оценки динамики массы тела в послеоперационном периоде использовались следующие параметры, рекомендованные Международной федерацией хирургии ожирения (IFSO) в 2015 г.:
- ИМТ, кг/м2;
- процент потери избыточного ИМТ (Percent excess BMI loss), %.
Бариатрическая операция считалась эффективной, если было достигнуто снижение более 50% от избыточной массы тела или избыточного ИМТ [10]. Помимо этого, для каждого пациента ретроспективно оценивалось наступление точки надир (минимальной послеоперационной массы тела) и время ее достижения.
Через 3 года после оперативного вмешательства оценивался повторный набор массы тела (ПНМТ, %), который рассчитывается по формуле ПНМТ (%) = 100 × (масса тела текущая – масса тела в точке надир) / (масса тела исходно – масса тела в точке надир). Физиологическим считали ПНМТ до 10%, клинически значимым >15%, поскольку, в соответствии с литературными данными, именно при этом значении ПНМТ происходит ухудшение течения ассоциированных с ожирением состояний и возникает необходимость в интенсификации терапии.
Этическая экспертиза: проведение исследования было одобрено локальным научным этическим комитетом Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова (протокол заседания локального этического комитета от 21.04.2014 № 161). Каждый пациент получал подробную информацию о проводимом исследовании и давал письменное информированное согласие на участие.
Методы статистического анализа данных: статистическая обработка результатов исследования выполнялась с использованием программной системы STATISTICA for Windows (версия 10). При проведении статистической обработки данных применялись методы описательной, а также параметрической статистики. При анализе использовались методы параметрической статистики; данные представлены в виде среднего значения и стандартного отклонения. Достоверность различий средних значений определялась с помощью критерия Стьюдента, значимыми считались различия групп при р <0,05.
РЕЗУЛЬТАТЫ
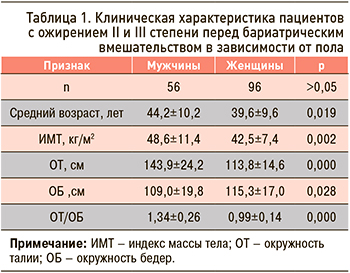 В исследование вошли 152 пациента (96 женщин, 56 мужчин) с ожирением II и III степени, перенесших различные виды бариатрических вмешательств (РГ – 96, ГШ – 56). Средний возраст пациентов составил 41,2±10,0 лет, при этом средний возраст у мужчин на момент бариатрического вмешательства был значимо выше, чем у женщин: 44,2±10,2 года и 39,6±9,6 лет соответственно (р=0,019). Средний ИМТ исходно составил 44,6±9,4 кг/м2, у мужчин этот показатель был значимо выше, чем у женщин: 48,6±11,4 и 42,5±7,4 кг/ м2 соответственно (р=0,002). Значимой разницы в возрасте и исходном ИМТ между группами РГ и ГШ выявлено не было. Помимо этого, были выявлены различия в индексе «талия–бедра» (табл. 1).
В исследование вошли 152 пациента (96 женщин, 56 мужчин) с ожирением II и III степени, перенесших различные виды бариатрических вмешательств (РГ – 96, ГШ – 56). Средний возраст пациентов составил 41,2±10,0 лет, при этом средний возраст у мужчин на момент бариатрического вмешательства был значимо выше, чем у женщин: 44,2±10,2 года и 39,6±9,6 лет соответственно (р=0,019). Средний ИМТ исходно составил 44,6±9,4 кг/м2, у мужчин этот показатель был значимо выше, чем у женщин: 48,6±11,4 и 42,5±7,4 кг/ м2 соответственно (р=0,002). Значимой разницы в возрасте и исходном ИМТ между группами РГ и ГШ выявлено не было. Помимо этого, были выявлены различия в индексе «талия–бедра» (табл. 1).
В течение первого года после бариатрического вмешательства большая часть пациентов достигла минимальной послеоперационной массы тела: время достижения точки надир составило в среднем 11,5±6,7 мес, значимых различий между мужчинами и женщинами выявлено не было. Пациенты в группе РГ достигли минимальной послеоперационной массы тела значимо раньше, чем пациенты в группе ГШ: в первом случае точка надир соответствовала 10,6±6,9 мес, во втором – 13,8±5,7 мес (р=0,000).
Эффективность обоих видов бариатрического вмешательства была сопоставима: через 1 год после операции в группе РГ 78,8% пациентов (n=82) достигли потери избыточного ИМТ (%EBMIL) более 50%, а в группе ГШ – 80,4% (n=49; p >0,05). Значимой разницы в эффективности операций между мужчинами и женщинами выявлено не было.
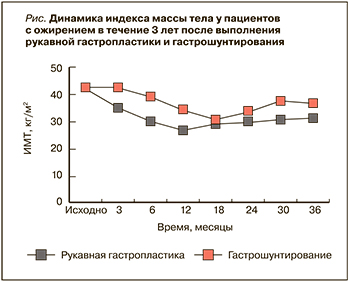 Динамика ИМТ у пациентов с ожирением в течение 3 лет после выполнения РГ и ГШ приведена на рисунке. Через 3 года после оперативного вмешательства контакт с лечащим врачом сохранили 122 пациента (в том числе 80 женщин), из них в группе РГ – 86, в группе ГШ – 36 человек. В группе Программы поддержания массы тела (≥2 контактов с лечащим врачом в месяц) к концу третьего года наблюдения находился 41, а в группе сравнения (контакт с лечащим врачом 1 раз в 3 месяца) – 81 пациент.
Динамика ИМТ у пациентов с ожирением в течение 3 лет после выполнения РГ и ГШ приведена на рисунке. Через 3 года после оперативного вмешательства контакт с лечащим врачом сохранили 122 пациента (в том числе 80 женщин), из них в группе РГ – 86, в группе ГШ – 36 человек. В группе Программы поддержания массы тела (≥2 контактов с лечащим врачом в месяц) к концу третьего года наблюдения находился 41, а в группе сравнения (контакт с лечащим врачом 1 раз в 3 месяца) – 81 пациент.
В зависимости от величины ПНМТ пациенты были разделены на группы:
- группа 1 – ПНМТ >25%;
- группа 2 – ПНМТ 15–24,9%;
- группа 3 – ПНМТ 0–14,9%.
Анализировалась связь между величиной ПНМТ и клиническими характеристиками пациентов (табл. 2). Было установлено, что пол пациентов, исходный ИМТ, время достижения минимальной послеоперационной массы тела не были ассоциированы с величиной ПНМТ в течение трех лет после выполнения бариатрических вмешательств. Возраст пациентов в группе 3 (ПНМТ <15%) был больше, чем у пациентов в группе 1 (ПНМТ >25%), однако различия не были значимы (р=0,058). Среди пациентов, наблюдавшихся в рамках Программы поддержания массы тела, у 38 (92%) наблюдался ПНМТ <15% через 3 года после выполнения бариатрической операции. Таким образом, факт частых контактов с лечащим врачом оказался ассоциирован с удержанием достигнутой массы тела.

ОБСУЖДЕНИЕ
Согласно литературным данным, пациенты с ожирением после бариатрических вмешательств наблюдаются нерегулярно, что отражается на эффективности лечения. Пациенты, чаще контактирующие с лечащим врачом по поводу ожирения, успешнее снижают массу тела, а повторный набор массы тела у них выражен в меньшей степени [11, 12]. В приведенном исследовании пациенты из группы Программы поддержания массы тела наблюдались в среднем 21,3±5,2 раз в год (примерно 1 раз в 2 нед). Таким образом, контроль пищевого дневника и коррекция рациона происходили у них значимо чаще, чем в группе сравнения. Помимо этого, нельзя исключать и психологический (дисциплинирующий) аспект регулярных контактов со специалистом.
Возраст пациента, по данным некоторых исследований, ассоциирован с выраженностью повторного набора массы тела. Часть исследователей полагает, что возраст не оказывает значимого влияния на исход бариатрической операции. С другой стороны, в исследовании Shantavasinkul P.C. et al. (n=1426; 15,8% мужчин), посвященном наблюдению пациентов после ГШ, возраст наблюдаемых с повторным набором массы тела был значимо меньше, чем у пациентов без него: 42,3±9,8 против 45,7±10,8 лет (р=0,001). Согласно выводам этого исследования, более молодой возраст на момент бариатрической операции сам по себе выступает предиктором повторного набора массы тела [6]. В представленной работе также была выявлена тенденция к клинически значимому повторному набору массы тела у пациентов младшего возраста, однако различия были статистически не значимы (р=0,058). Вероятно, это связано с недостаточным объемом выборки.
ОТ и ОБ, а также их соотношение позволяют сделать вывод о выраженности висцерального ожирения. Висцеральное ожирение является маркером инсулинорезистентности и значительно повышает риск развития сахарного диабета 2 типа и нарушения толерантности к глюкозе [13]. Расчетные индексы, основанные на ОТ, используются при анализе послеоперационной динамики МТ и ассоциированы с течением нарушений углеводного обмена [14]. В представленной работе не было выявлено связи между ОТ, ОТ/ОБ и ПНМТ.
В некоторых долгосрочных наблюдениях выявлена связь между максимальной потерей массой тела, временем ее достижения и ПНМТ [9]. В приведенном исследовании такой связи выявлено не было. Это может быть связано с недостаточной длительностью наблюдения (3 года послеоперационного периода).
Планируется дальнейшее наблюдение для исследования возможности превенции повторного набора массы тела у пациентов с ожирением после бариатрических вмешательств.
ЗАКЛЮЧЕНИЕ
1. ПНМТ <15% к третьему году после выполнения бариатрической операции был ассоциирован с частым контактом с лечащим врачом (21,3±5,2 контактов в год).
2. Клинически значимый ПНМТ (>15%) к третьему году после бариатрической операции не был ассоциирован с исходным ИМТ, соотношением ОТ и ОБ.



