1) ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова» Минздрава России;
2) ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И. И. Мечникова» Минздрава России
Аннотация. Цель исследования – валидация шкалы «цитокинового шторма» (ШЦШ) на когорте больных с COVID-19-ассоциированной пневмонией для подтверждения ее диагностической значимости и информативности.
Материал и методы. В исследование были включены 48 пациентов с COVID-19-ассоциированной пневмонией, поступивших для лечения в стационар, и 73 человека, находившихся в отделении реанимации и интенсивной терапии (ОРИТ). Были измерены уровни интерлейкина 6 (ИЛ-6), интерлейкина 8 (ИЛ-8), интерлейкина 18 (ИЛ-18), интерлейкина 10 (ИЛ-10) и прокальцитонина (ПКТ) с помощью иммуноферментного анализа, произведен расчет ШЦШ. Для каждого биомаркера рассчитывались баллы в диапазоне от 1 до 3: при пограничной концентрации исследуемого показателя начислялся 1 балл, при средней – 2, при высокой – 3 (нормальные значения соответствовали 0 баллов). Значение ШЦШ более 6 баллов было ассоциировано с высоким риском неблагоприятного исхода COVID-19.
Результаты. При оценке информативности показателей ШЦШ в отношении прогноза летального исхода было установлено, что она имела высокую чувствительность (78,79%; 95% ДИ: 0,61–0,91) и специфичность (81,12%; 95% ДИ: 71,24–88,80). Также ШЦШ положительно и статистически значимо коррелировала со шкалой NEWS2 (0,58; 95% ДИ: 0,35–0,75), степенью поражения легких по данным компьютерной томографии (0,46; 95% ДИ 0,20–0,67) и процентом поражения легочной ткани (0,38; 95% ДИ: 0,01–0,61).
Заключение. Разработанная ШЦШ имеет достаточно высокую прогностическую информативность в отношении риска неблагоприятного прогноза течения COVID-19. Комбинированные прогностистические возможности цитокинов ИЛ-6, ИЛ-18, ИЛ-10 и ПКТ, интегрированные в единый показатель, позволяют с большей вероятностью выявить пациентов группы высокого риска летального исхода при COVID-19-ассоциированной пневмонии.
COVID-19
интерлейкин 6
интерлейкин 18
интерлейкин 10
прокальцитонин
шкала «цитокинового шторма»
Коронавирусная инфекция 2019 года (COVID- 19), вызванная новым коронавирусом тяжелого острого респираторного синдрома (SARS-CoV-2), охватывает широкий спектр клинических проявлений – от бессимптомного носительства до критического состояния с большой вероятностью летального исхода [1–3]. Тяжесть COVID-19 обусловлена повышенным уровнем медиаторов воспаления, таких как интерлейкин 6 (ИЛ-6), интерлейкин 8 (ИЛ-8), интерлейкин 18 (ИЛ-18), интерлейкин 10 (ИЛ-10), интерлейкин 1β (ИЛ-1β), фактор некроза опухоли-альфа (ФНО- α), интерферон γ (ИФН γ), моноцитарный хемоаттрактантный белок-1 (МХБ-1) [4–6]. Высокая смертность, связанная с COVID-19, обусловлена гипервоспалительными реакциями и неконтролируемым иммунным ответом, развивающимися в рамках «цитокинового шторма» (ЦШ).
Гетерогенность течения болезни представляет собой серьезную проблему в плане прогнозирования и лечения пациентов с COVID-19. Это послужило основанием для разработки и адаптации целого ряда оценочных индексов течения новой коронавирусной инфекции: индекса тяжести пневмонии, шкал оценки тяжести пневмонии CURB-65 и CRB-65, A-DROP и SMART-COP и тяжести состояния пациента NEWS2, qSOFA, а также новых шкал оценки тяжести COVID-19, основанных на демографических данных, наличии сопутствующих заболеваний, результатах инструментальных исследований, уровнях сатурации и лабораторных показателях активности воспалительного процесса [7].
В ранее опубликованной статье мы предложили использование шкалы цитокинового шторма (ШЦШ) и представили данные течения первой волны COVID-19 в Санкт-Петербурге с 25.05. по 25.07.2020 [8]. Нами было проведено обследование 226 пациентов с COVID-19, 36 (16%) из которых имели неблагоприятный прогноз. Исследуемая когорта включала 138 (61%) мужчин и 88 (39%) женщин, средний возраст которых составил 56,82±13,9 (от 23 до 87 лет). Наряду с этим были собраны демографические и клинические характеристики, радиологические данные, основные лабораторные показатели, а также результаты оценки тяжести состояния пациента NEWS2 и SOFA. Поскольку уровни ИЛ-6, ИЛ-10, ИЛ-18 и прокальцитонина (ПКТ) были связаны с тяжестью заболевания и коррелировали с клиническими шкалами NEWS2 и SOFA, они были интегрированы в 12-балльную шкалу, названную ШЦШ. Согласно ROC-анализу, площадь под кривой для ШЦШ составила 0,90 (95% доверительный интервал (ДИ): 0,84–0,95) с чувствительностью 83,33 (95% ДИ: 62,62–95,26) и специфичностью 84,82 (95% ДИ: 76,81–90,90), что превышало аналитические характеристики каждого из цитокинов в отдельности, а также другие исследуемые лабораторные маркеры. Показатели ШЦШ были значительно выше у пациентов старше 65 лет по сравнению с молодыми пациентами, при этом была установлена ассоциация между высоким количеством баллов и наличием сопутствующих заболеваний. Целью настоящего исследования стала валидация ШЦШ на когорте больных с COVID-19-ассоциированной пневмонией для подтверждения ее диагностической значимости и информативности.
МАТЕРИАЛ И МЕТОДЫ
В исследование было включено 48 пациентов с COVID-19-ассоциированной пневмонией, поступивших для лечения в стационар, и 73 человека, находившихся в отделении реанимации и интенсивной терапии (ОРИТ). При обследовании этой группы больных учитывались клинические проявления заболевания, лабораторные и рентгенологические показатели, а также значения шкалы оценки тяжести COVID-19 NEWS2, включающей частоту дыхательных движений в минуту, показатели сатурации, температуру тела, систолическое артериальное давление, частоту сердечных сокращений и изменение уровня сознания.
Образцы венозной крови собирали утром натощак через сутки после поступления пациентов в стационар с последующим исследованием уровней ИЛ-6, ИЛ-18, ИЛ-10 и ПКТ с помощью иммуноферментного анализа (коммерческие наборы производства «Вектор-Бест», Россия). Наряду с этим, всем пациентам проводился расчет ШЦШ, включающих ИЛ-6, ИЛ-18, ИЛ-10 и ПКТ. Для каждого биомаркера рассчитывались баллы в диапазоне от 1 до 3: при пограничной концентрации исследуемого показателя начислялся 1 балл, при средней – 2, при высокой – 3 (нормальные значения соответствовали 0 баллов). При сумме баллов более 6 прогнозировался высокий риск неблагоприятного исхода заболевания. Уровни ИЛ-6, ИЛ-18, ИЛ-10 и ПКТ, а также соответствующие им баллы приведены в таблице 1.
Для статистического анализа использовалось программное обеспечение Graphpad Prism 8.2. Непрерывные и категориальные переменные были представлены как медиана (IQR) и n (%) соответственно. U-критерий Манна–Уитни, критерий χ² или точный критерий Фишера применялись для сравнения непрерывных и категориальных переменных. Прогностическая ценность цитокинов и ШЦШ была оценена путем измерения площади под ROC кривой (AUROC).
РЕЗУЛЬТАТЫ
В период «второй волны» эпидемии коронавирусной инфекции в Санкт-Петербурге с ноября 2020 г. по январь 2021 г. было проведено обследование 121 пациента с COVID-19-ассоциированной пневмонией (диагноз был подтвержден путем выявления нуклеиновой кислоты SARS-CoV-2 методом полимеразной цепной реакции с использованием мазков из ротоглотки и носоглотки). Среди пациентов, проходивших стационарное лечение по поводу COVID-19-ассоциированной пневмонии, нами была выделена когорта из 27 мужчин и 21 женщины (48 человек) в возрасте от 38 до 88 лет, составивших первую группу. Во вторую группу вошли 73 пациента (43 мужчины и 30 женщин в возрасте от 37 до 86 лет) с тяжелым и критичным течением COVID-19-ассоциированной пневмонии, находящихся в ОРИТ. Демографические характеристики обследованных и процент летальных исходов отражены в таблице 2.
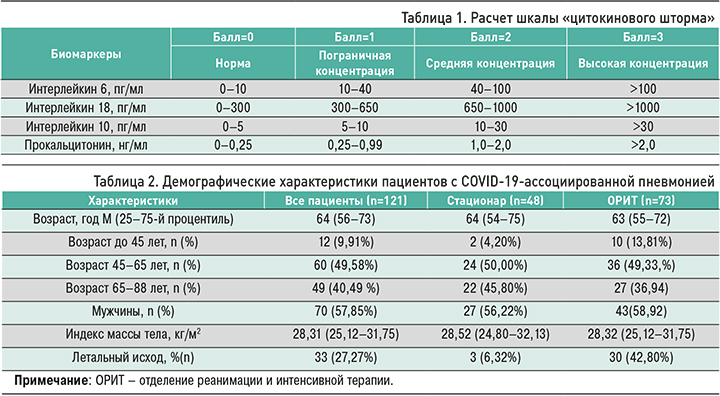
У пациентов, находящихся в ОРИТ, концентрации всех компонентов ШЦШ – ИЛ-6, ИЛ-18, ИЛ-10 и ПКТ – были достоверно выше, чем у больных первой группы (рис. 1). Медиана для ИЛ-6 в первой группе пациентов составила 12,11 нг/ мл, а у больных в ОРИТ – 32,00 пг/мл (p <0,0001; 95% ДИ: 8,88–47,35). Медиана уровня ИЛ-18 в двух группах составила 454,2 и 674,1 пг/мл соответственно (p <0,0001; 95% ДИ 118,80–349,40), а ИЛ-10 – 10,12 и 16,92 пг/мл (p=0,0053; 95% ДИ 1,68–9,99).
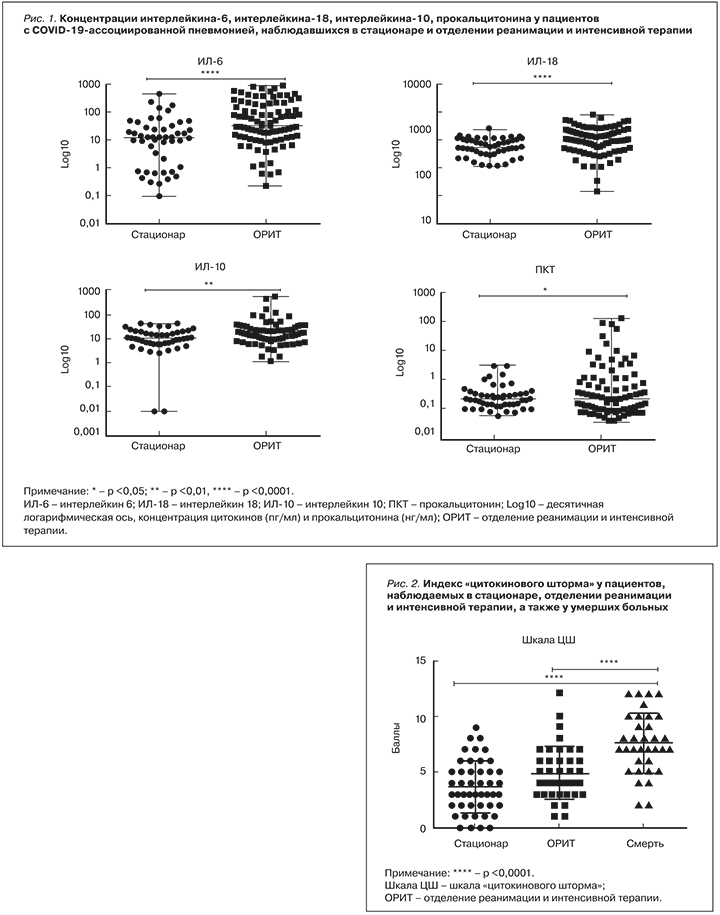
Показатели ШЦШ (от 0 до 12 баллов) во второй группе обследованных и у больных с летальными исходами были достоверно выше, чем у пациентов первой группы. Пациенты, набравшие 6 баллов и более, имели высокий риск неблагоприятного исхода заболевания (рис. 2).
 Согласно ROC-анализу, площадь под кривой для ШЦШ оказалась больше, чем для каждого из четырех маркеров в отдельности (AUC 0,85; 95% ДИ: 0,77–0,92; p <0,001). Для сравнения прогностической ценности ШЦШ и других провоспалительных и общелабораторных биомаркеров были построены ROC-кривые уровней Д-димера, лейкоцитов, ферритина и лактатдегидрогеназы (рис. 3). Площадь под кривой была наибольшей для лактатдегидрогеназы и составила 0,80 (95% ДИ: 0,70–0,90). При диагностике критического COVID-19 площадь под кривой для лейкоцитов составила 0,64 (95% ДИ: 0,51–0,77), для Д-димера – 0,77 (95% ДИ: 0,65–0,89). Для ферритина этот показатель был равен 0,78 (95% ДИ: 0,68–0,87). При оценке информативности показателей ШЦШ в отношении прогноза летального исхода (табл. 3) было установлено, что она имела достаточно высокую чувствительность (78,79 %; 95% ДИ%: 0,61–0,91) и специфичность (81,12%; 95% ДИ: 71,24–88,80).
Согласно ROC-анализу, площадь под кривой для ШЦШ оказалась больше, чем для каждого из четырех маркеров в отдельности (AUC 0,85; 95% ДИ: 0,77–0,92; p <0,001). Для сравнения прогностической ценности ШЦШ и других провоспалительных и общелабораторных биомаркеров были построены ROC-кривые уровней Д-димера, лейкоцитов, ферритина и лактатдегидрогеназы (рис. 3). Площадь под кривой была наибольшей для лактатдегидрогеназы и составила 0,80 (95% ДИ: 0,70–0,90). При диагностике критического COVID-19 площадь под кривой для лейкоцитов составила 0,64 (95% ДИ: 0,51–0,77), для Д-димера – 0,77 (95% ДИ: 0,65–0,89). Для ферритина этот показатель был равен 0,78 (95% ДИ: 0,68–0,87). При оценке информативности показателей ШЦШ в отношении прогноза летального исхода (табл. 3) было установлено, что она имела достаточно высокую чувствительность (78,79 %; 95% ДИ%: 0,61–0,91) и специфичность (81,12%; 95% ДИ: 71,24–88,80).
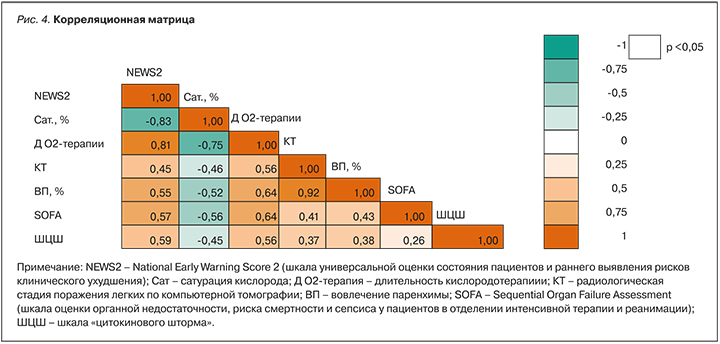
Был выполнен корреляционный анализ методом Спирмена, и построена корреляционная матрица между ШЦШ и такими показателями, как длительность кислородотерапии и сатурация, степень поражения легких в соответствии с результатами компьютерной томографии (КТ) грудной клетки, а также интегративной шкалой NEWS2 у пациентов первой группы. ШЦШ положительно и статистически значимо коррелировала со шкалой NEWS2 (0,58; 95% ДИ: 0,35–0,75), степенью поражения легких по КТ (0,46; 95% ДИ 0,20–0,67) и процентом поражения легочной ткани (0,38; 95% ДИ 0,01–0,61) (рис. 4).

ОБСУЖДЕНИЕ
Вирусная пневмония при COVID-19 сопровождается выраженными клиническими и лабораторными проявлениями синдрома ЦШ. SARS-CoV-2 не только активирует противовирусный иммунный ответ, но также может вызывать неконтролируемые системные воспалительные реакции, характеризующиеся высвобождением провоспалительных цитокинов у пациентов с тяжелой формой COVID-19; это приводит к лимфопении, дисфункции лимфоцитов, аномалиям гранулоцитов и моноцитов. Провоспалительные цитокины ИЛ-1β, ИЛ-2, ИЛ-6, ИЛ-8, ИЛ-17, ИЛ-18, ФНО-α, хемокины (ХБМ-1) и воспалительный белок макрофагов 1-альфа, а также противовоспалительный цитокин ИЛ-10 значительно повышены у пациентов с тяжелой формой COVID-19 и умерших пациентов по сравнению с более легкими формами SARS-CoV-2 инфекции [9]. Повреждение легких является одним из последствий ЦШ, который может перерасти в острое повреждение легких или острый респираторный дистресс-синдром (ОРДС), который выступает основной причиной смерти от COVID-19. Хотя точный механизм развития ОРДС у пациентов с COVID-19 до конца не изучен, чрезмерное производство провоспалительных цитокинов считается одним из его основных звеньев его патогенеза.
Метаанализ публикаций, посвященных ИЛ-6 у пациентов с COVID-19, продемонстрировал в 2,9 раза более высокие его уровни у пациентов с тяжелым течением относительно больных с неосложненным течением заболеванием [13]. В нашей исходной когорте концентрация ИЛ-6 у стационарных больных составила 12,11 нг/мл, у пациентов ОРИТ – 32,00 пг/мл; у умерших пациентов уровень этого биомаркера был в 10,6 раз выше, чем у выживших. Концентрация ИЛ-18 в сыворотке была 2 раза выше у пациентов с летальным исходом относительно больных с благоприятным исходом (p <0,001). При этом уровень ИЛ-18 в сыворотке выше порогового значения 535,9 пг/ мл был ассоциирован с поступлением в ОРИТ. Уникальной особенностью ЦШ при COVID-19 является повышение уровня ИЛ-10 у пациентов с тяжелыми/критическим течением заболевания [6, 14, 15]. В ряде исследований подчеркивается, что повышенные значения ПКТ ассоциированы с 5-кратным повышением риска тяжелого COVID- 19 [16–18]. Комбинация маркеров ПКТ и ИЛ-10 значительно способствовала диагностике и прогнозированию критического течения фебрильной нейтропении и сепсиса [19]. В нашем исследовании уровни ИЛ-10 более 17,4 пг/мл и концентрация ПКТ выше 0,56 нг/мл были связаны с 5-кратным и 3-кратным повышением риска летального исхода соответственно. Таким образом, измерение провоспалительных цитокинов может иметь прикладное значение при ведении пациентов с COVID-19, включая оценку риска, мониторинг тяжести и определение прогноза заболевания.
Помимо ранее проведенной разработки клинических шкал для оценки риска развития тяжелого течения COVID-19 (шкалы оценки тяжести пневмонии CURB-65 и CRB-65, A-DROP и SMART-COP, шкала оценки тяжести состояния пациента NEWS2, критерии синдрома системного воспалительного ответа), в 2020 г. были выполнены исследования по поиску новых подходов к прогнозированию исходов COVID-19 [20]. Новые шкалы и индексы были основаны на демографических данных, наличии сопутствующих заболеваний, результатах КТ грудной клетки и других инструментальных исследованиях, а также уровнях сатурации и лабораторных показателях. Однако большинство клинико-лабораторных шкал для оценки степени тяжести COVID-19 не включает такие важные прогностические факторы, как цитокины, вследствие недоступности их для широкого использования в реальной клинической практике. С учетом иммунологических исследований, проведенных в период первой волны COVID-19, нами была разработана ШЦШ, которая представляет собой сумму баллов, рассчитанных в соответствии с диапазонами концентраций ИЛ-6, ИЛ-10, ИЛ-18 и ПКТ от 0 до 12 баллов [8]. Пациенты, набравшие 6 баллов и более, имеют высокий риск неблагоприятного исхода заболевания. У когорты больных COVID-19 первой волны площадь под кривой AUC для ШЦШ составила 0,90 (95% ДИ 0,84–0,95; p <0,001) с чувствительностью 83,21% и специфичностью 84%.
Для подтверждения информативности и клинической значимости ШЦШ нами была собрана валидационная когорта из 48 стационарных больных и 83 пациентов, находящихся в ОРИТ. У пациентов с риском летального исхода в данной валидационной когорте площадь под кривой составила 0,85 (95% ДИ: 0,77–0,92; p <0,001) с чувствительностью 78,79% и специфичностью 81,12%. Если пациент имеет сумму >6 баллов по ШЦШ, это ассоциировано с почти 7-кратным повышением риска летального исхода при COVID-19 и высокой прогностической ценностью положительного (0,62 {0,45–0,76}) и отрицательного результата (0,88 {0,82–0,96}). Также ШЦШ положительно и статистически значимо коррелирует со шкалой NEWS2, степенью поражения легких по КТ, процентом поражения легочной ткани.
ЗАКЛЮЧЕНИЕ
Таким образом, можно полагать, что разработанная нами ШЦШ имеет достаточно высокую прогностическую информативность в отношении риска неблагоприятного прогноза течения COVID-19. Комбинированные прогностистические возможности ИЛ-6, ИЛ-18, ИЛ-10 и ПКТ, интегрированные в единый показатель, позволяют с большей вероятностью выявить пациентов группы высокого риска летального исхода при COVID-19-ассоциированной пневмонии.
- Hu B., Guo H., Zhou P. et al. Characteristics of SARS-CoV-2 and COVID-19. Nat Rev Microbiol. 2021; 19(3): 141–54. doi: 10.1038/s41579-020-00459-7.
- Guan W., Ni Z., Hu Y. et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020; 382(18): 1708–20. doi: 10.1056/NEJMoa2002032.
- Zhou F., Yu T., Du R. et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: A retrospective cohort study. Lancet. 2020; 395(10229): 1054–62. doi: 10.1016/S0140-6736(20)30566-3.
- Tay M.Z., Poh C.M., Renia L. et al. The trinity of COVID-19: Immunity, inflammation and intervention. Nat Rev Immunol. 2020; 20(6): 363–74. doi: 10.1038/s41577-020-0311-8.
- Li C., Zhao C., Bao J. et al. Laboratory diagnosis of coronavirus disease-2019 (COVID-19). Clin Chim Acta. 2020; 510: 35–46. doi: 10.1016/j.cca.2020.06.045.
- Han H., Ma Q., Li C. et al. Profiling serum cytokines in COVID-19 patients reveals IL-6 and IL-10 are disease severity predictors. Emerg Microbes Infect. 2020; 9(1): 1123–30. doi: 10.1080/22221751.2020.1770129.
- Fan G., Tu C., Zhou F. et al. Comparison of severity scores for COVID-19 patients with pneumonia: A retrospective study. Eur Respir J. 2020; 56(3): 2002113. doi: 10.1183/13993003.02113-2020.
- Ткаченко О.Ю., Первакова М.Ю., Лапин С.В. с соавт. Прогностическая роль исследования цитокинов при COVID-19-ассоциированной пневмонии. Вестник Северо-Западного государственного университета им. И.И. Мечникова. 2021; 1: 59–69.
- Satıs H., Ozger H.S., Aysert Yıldız P. et al. Prognostic value of interleukin-18 and its association with other inflammatory markers and disease severity in COVID-19. Cytokine. 2021; 137: 155302. doi: 10.1016/j.cyto.2020.155302.
- Crayne C.B., Albeituni S., Nichols K.E. et al. The immunology of macrophage activation syndrome. Front Immunol. 2019; 10: 119. doi: 10.3389/fimmu.2019.00119.
- Qin C., Zhou L., Hu Z. et al. Dysregulation of immune response in patients with coronavirus 2019 (COVID-19) in Wuhan, China. Clin Infect Dis. 2020; 71(15): 762–68. doi: 10.1093/cid/ciaa248.
- Jamilloux Y., Henry T., Belot A. et al. Should we stimulate or suppress immune responses in COVID-19? Cytokine and anti-cytokine interventions. Autoimmun Rev. 2020; 19(7): 102567. doi: 10.1016/j.autrev.2020.102567.
- Coomes E.A., Haghbayan H. Interleukin6 in COVID-19: A systematic review and meta-analysis. Rev Med Virol. 2020; 30(6): 1–9. doi: 10.1002/rmv.2141.
- Lauw F.N., Pajkrt D., Hack C.E. et al. Proinflammatory effects of IL-10 during human endotoxemia. J Immunol. 2000; 165(5): 2783–89. doi: 10.4049/jimmunol.165.5.278.
- Lu L., Zhang H., Dauphars D.J. et al. A potential role of interleukin 10 in COVID-19 pathogenesis. Trends Immunol. 2021; 42(1): 3–5. doi: 10.1016/j.it.2020.10.012.
- Lippi G., Plebani M. Procalcitonin in patients with severe coronavirus disease 2019 (COVID-19): A meta-analysis. Clin Chim Acta. 2020; 505: 190–91. doi: 10.1016/j.cca.2020.03.004.
- Song J., Park D.W, Moon S. et al. Diagnostic and prognostic value of interleukin-6, pentraxin 3, and procalcitonin levels among sepsis and septic shock patients: a prospective controlled study according to the Sepsis-3 definitions. BMC Infect Dis. 2019; 19(1): 968. doi: 10.1186/s12879-019-4618-7.
- Hu R., Han C., Pei S. et al. Procalcitonin levels in COVID-19 patients. Int J Antimicrob Agents. 2020; 56(2): 106051. doi: 10.1016/j.ijantimicag.2020.106051.
- Vanska M., Koivula I., Jantunen E. et al. IL-10 combined with procalcitonin improves early prediction of complications of febrile neutropenia in hematological patients. Cytokine. 2012; 60(3): 787–92. doi: 10.1016/j.cyto.2012.07.023.
- Liang W., Liang H., Ou L. et al. Development and validation of a clinical risk score to predict the occurrence of critical illness in hospitalized patients with COVID-19. JAMA Intern Med. 2020; 180(8): 1081–89. doi: 10.1001/jamainternmed.2020.2033.
Ольга Юрьевна Ткаченко, к.м.н., врач клинической лабораторной диагностики клинико-диагностической лаборатории Научно-медицинского центра по молекулярной медицине ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России. Адрес: 197022, г. Санкт-Петербург, ул. Льва Толстого, д. 6/8. Тел.: 8 (812) 994-53-24, 8 (812) 338-71-94. E-mail:
tkachenie@mail.ru. ORCID: 0000-0002-1479-6551. еLibrary SPIN: 6593-8770
Маргарита Юрьевна Первакова, к.м.н., врач клинической лабораторной диагностики клинико-диагностической лаборатории Научно-медицинского центра по молекулярной медицине ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России. Адрес: 197022, г. Санкт-Петербург, ул. Льва Толстого, д. 6/8. Тел.: 8 (812) 994-53-24, 8 (812) 338-71-94. E-mail:
margaritalerner@gmail.com. ORCID: 0000-0001-9630-257X. еLibrary SPIN: 8820-5850
Сергей Владимирович Лапин, к.м.н., зав. лабораторией диагностики аутоиммунных заболеваний Научно-медицинского центра по молекулярной медицине ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России. Адрес: 197022, г. Санкт-Петербург, ул. Льва Толстого, д. 6/8. Тел.: 8 (812) 994-53-24, 8 (812) 338-71-94. E-mail:
svlapin@mail.ru. ORCID: 0000-0002-4998-3699. еLibrary SPIN: 9852-7501
Александра Васильевна Мазинг, к.м.н., ведущий научный сотрудник лаборатории молекулярной диагностики Научно-медицинского центра по молекулярной медицине ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России. Адрес: 197022,
г. Санкт-Петербург, ул. Льва Толстого, д. 6/8. Тел.: 8 (812) 994-53-24, 8 (812) 338-71-94. E-mail:
alex_mazing@mail.ru. ORCID: 0000-0002-3055-6507. еLibrary SPIN: 4458-4633
Анна Николаевна Мошникова, врач клинической лабораторной диагностики клинико-диагностической лаборатории Научно-медицинского центра по молекулярной медицине ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России. Адрес: 197022, г. Санкт-Петербург, ул. Льва Толстого, д. 6/8. Тел.: 8 (812) 994-53-24, 8 (812) 338-71-94. E-mail:
moshnikova-anna@mail.ru. ORCID: /0000-0002-4604-0660. еLibrary SPIN: 7252-3525
Дарья Александровна Кузнецова, к.м.н., врач клинической лабораторной диагностики клинико-диагностической лаборатории Научно-медицинского центра по молекулярной медицине ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России. Адрес: 197022, г. Санкт-Петербург, ул. Льва Толстого, д. 6/8. Тел.: 8 (812) 994-53-24, 8 (812) 338-71-94. E-mail:
lariwar@mail.ru. ORCID: 0000-0001-5318-354X. еLibrary SPIN: 6110-6168
Ирина Валентиновна Холопова, врач клинической лабораторной диагностики клинико-диагностической лаборатории Научно-медицинского центра по молекулярной медицине ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России. Адрес: 197022, г. Санкт-Петербург, ул. Льва Толстого, д. 6/8. Тел.: 8 (812) 994-53-24, 8 (812) 338-71-94. E-mail:
irinakholopova@yandex.ru. ORCID: 0000-0001-9520-453X. еLibrary SPIN: 8964-4523
Елена Аркадьевна Суркова, к.б.н., старший научный сотрудник лаборатории диагностики аутоиммунных заболеваний Научно-медицинского центра по молекулярной медицине ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова» Минздрава России. Адрес: 197022, г. Санкт-Петербург, ул. Льва Толстого, д. 6/8. Тел.: 8 (812) 994-53-24, 8 (812) 338-71-94. E-mail:
easurkova@mail.ru. ORCID: 0000-0001-5191-0221. еLibrary SPIN: 6518-8128
Татьяна Владимировна Блинова, к.б.н., старший научный сотрудник лаборатории диагностики аутоиммунных заболеваний Научно-медицинского центра по молекулярной медицине ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России. Адрес: 197022, г. Санкт-Петербург, ул. Льва Толстого, д. 6/8. Тел.: 8 (812) 994-53-24, 8 (812) 338-71-94. E-mail:
tvblinova@list.ru. ORCID: 0000-0003-4896-3319. еLibrary SPIN: 1637-4357
Юрий Сергеевич Полушин, д.м.н., профессор, академик РАН, проректор по науке, зав. кафедрой анестезиологии и реаниматологии, руководитель научно-клинического центра анестезиологии и реаниматологии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России. Адрес: 197022, г. Санкт-Петербург, ул. Льва Толстого, д. 6/8. Тел.: 8 (812) 338-71-66. E-mail:
polushinyus@1spbgmu.ru
Алексей Андреевич Афанасьев, к.м.н., ассистент кафедры анестезиологии и реаниматологии, зав. отделением реанимации и интенсивной терапии Научно-клинического центра анестезиологии и реаниматологии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России. Адрес: 197022, г. Санкт-Петербург, ул. Льва Толстого, д. 6/8. E-mail:
alex-txf@mail.ru. ORCID0000-0003-0277-3456; еLibrary SPIN: 4389-6271
Елена Геннадьевна Гаврилова, к.м.н., доцент кафедры анестезиологии и реаниматологии, зав. ОРИТ №2 ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад.И.П. Павлова» Минздрава России. Адрес: 197022, г. Санкт-Петербург, ул. Льва Толстого, д. 6/8. E-mail:
egavrilova70@mail.ru. Тел.: 8 (911) 224-01-81. ORCID: 0000-0002-9126-3206
Ирина Владимировна Шлык, д.м.н., профессор кафедры анестезиологии и реаниматологии, зам. главного врача Клиники по анестезиологии и реаниматологии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России. Адрес: 197022, г. Санкт-Петербург, ул. Льва Толстого, д. 6/8. Тел.: 8 (911) 837-19-75. E-mail:
irina_shlyk@mail.ru. ORCID: 0000-0003-0977-8081. еLibrary SPIN: 1715-1770
Елизавета Андреевна Корнилова, ординатор кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И. И. Мечникова» Минздрава России. Адрес: 191015, г. Санкт-Петербург, ул. Кирочная, д. 41. Тел.: 8 (981) 761-74-18. E-mail:
liza_kornilova@bk.ru. ORCID: 0000-0003-0805-6124
Дарья Александровна Иванникова, ординатор кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И. И. Мечникова» Минздрава России. Адрес: 191015, г. Санкт-Петербург, ул. Кирочная, д. 41. Тел.: 8 (930) 128-38-82. E-mail:
d.ivannikova@yandex.ru. ORCID: 0000-0002-3321-7586
Евгений Александрович Трофимов, д.м.н., доцент кафедры терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э.Э. Эйхвальда ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И. И. Мечникова» Минздрава России. Адрес: 191015, г. Санкт-Петербург, ул. Кирочная, д. 41. Тел.: 8 (921) 978-86-26. E-mail:
Evgeniy.trofimov@szgmu.ru. ORCID: 0000-0003-3236-4485
Вадим Иванович Мазуров, д.м.н. профессор, академик РАН, зав. кафедрой терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им. Э. Э. Эйхвальда ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И. И. Мечникова» Минздрава России, заслуженный деятель науки РФ. Адрес: 191015, г. Санкт-Петербург, ул. Кирочная, д. 41. Тел.: 8 (921) 951-71-88. E-mail:
maz.nwgmu@yandex.ru. ORCID: 0000-0001-8367-3144


 Согласно ROC-анализу, площадь под кривой для ШЦШ оказалась больше, чем для каждого из четырех маркеров в отдельности (AUC 0,85; 95% ДИ: 0,77–0,92; p <0,001). Для сравнения прогностической ценности ШЦШ и других провоспалительных и общелабораторных биомаркеров были построены ROC-кривые уровней Д-димера, лейкоцитов, ферритина и лактатдегидрогеназы (рис. 3). Площадь под кривой была наибольшей для лактатдегидрогеназы и составила 0,80 (95% ДИ: 0,70–0,90). При диагностике критического COVID-19 площадь под кривой для лейкоцитов составила 0,64 (95% ДИ: 0,51–0,77), для Д-димера – 0,77 (95% ДИ: 0,65–0,89). Для ферритина этот показатель был равен 0,78 (95% ДИ: 0,68–0,87). При оценке информативности показателей ШЦШ в отношении прогноза летального исхода (табл. 3) было установлено, что она имела достаточно высокую чувствительность (78,79 %; 95% ДИ%: 0,61–0,91) и специфичность (81,12%; 95% ДИ: 71,24–88,80).
Согласно ROC-анализу, площадь под кривой для ШЦШ оказалась больше, чем для каждого из четырех маркеров в отдельности (AUC 0,85; 95% ДИ: 0,77–0,92; p <0,001). Для сравнения прогностической ценности ШЦШ и других провоспалительных и общелабораторных биомаркеров были построены ROC-кривые уровней Д-димера, лейкоцитов, ферритина и лактатдегидрогеназы (рис. 3). Площадь под кривой была наибольшей для лактатдегидрогеназы и составила 0,80 (95% ДИ: 0,70–0,90). При диагностике критического COVID-19 площадь под кривой для лейкоцитов составила 0,64 (95% ДИ: 0,51–0,77), для Д-димера – 0,77 (95% ДИ: 0,65–0,89). Для ферритина этот показатель был равен 0,78 (95% ДИ: 0,68–0,87). При оценке информативности показателей ШЦШ в отношении прогноза летального исхода (табл. 3) было установлено, что она имела достаточно высокую чувствительность (78,79 %; 95% ДИ%: 0,61–0,91) и специфичность (81,12%; 95% ДИ: 71,24–88,80).




