1) ФГБНУ «Якутский научный центр комплексных медицинских проблем», г. Якутск;
2) ФГАОУ ВО «Северо-Восточный университет им. М.К. Аммосова», г. Якутск
Аннотация. Многочисленные исследования показывают, что BDNF может играть важную роль в энергетическом гомеостазе, в регуляции потребления пищи и в периферической регуляции метаболизма.
Цель исследования – поиск взаимосвязи между однонуклеотидным полиморфизмом с.189G>A p.(Val66Met) гена BDNF и уровнями циркулирующего в крови лептина у якутов.
Материал и методы. Выборку исследования составили 281 человек (186 женщин и 95 мужчин), средний возраст участников 19,8±1,5 лет. Выборка была стратифицирована по полу и подразделена в зависимости от индекса массы тела (ИМТ) на три группы: дефицит веса (n=37), нормальный вес (n=215) и избыточная масса тела/ожирение (n=29).
Результаты. В популяции якутов частота мажорного аллеля p.(Val66) составила 84,9%, минорного аллеля p.(Met66) – 15,1%. В связи с низкой частотой распространения гомозигот p.[Met66]; [Met66] и гетерозигот p.[Val66]; [Met66], при проведении анализа данные два генотипа были объединены в одну группу p.[Val66]; [Met66] + p.[Met66]; [Met66]. В результате была выявлена ассоциация генотипов p.[Val66]; [Met66] + p.[Met66]; [Met66] с пониженным уровнем лептина в сыворотке крови у женщин с нормальным весом (p=0,01). У мужчин с нормальным весом была выявлена тенденция к понижению уровня лептина у носителей генотипов p.[Val66]; [Met66] + p.[Met66]; [Met66] (3,83±0,85 нг/мл) по сравнению с гомозиготами p.[Val66]; [Val66] (5,58±0,93 нг/мл; p=0,09).
Заключение. Наши результаты свидетельствуют о том, что у лиц с аллелем p.(Met66), возможно, нарушен сигнальный путь лептина через BDNF в вентромедиальном гипоталамическом ядре. Согласно этому предположению, носители аллеля p.(Met66) с рождения могут иметь сниженный аппетит, что приводит к уменьшению количества потребляемой пищи и усилению использования жиров в энергетическом обмене. Это, в свою очередь, снижает накопление нормального количества жировой ткани, необходимой для выработки лептина, и служит фактором риска развития расстройств пищевого поведения, связанных с нервной анорексией и булимией.
BDNF
с.189G>A p.(Val66Met)
лептин
якуты
индекс массы тела
ВВЕДЕНИЕ
Ген BDNF кодирует белок нейротрофический фактор мозга (BDNF) [1, 2], который принадлежит к суперсемейству нейротрофинов [3] и экспрессируется в центральной нервной системе (ЦНС) [4]. К основным функциям BDNF относятся поддержание выживания существующих нейронов, дифференцировка и стимулирование роста новых нейронов и синапсов [5, 6]. Многочисленные исследования показывают, что BDNF может играть важную роль в энергетическом гомеостазе, в регуляции потребления пищи [7, 8] и в периферической регуляции метаболизма [9].
Одним из наиболее функционально значимых полиморфизмов гена BDNF является однонуклеотидный полиморфизм с.189G>A, также известный как G189A или rs6265, который приводит к замене аминокислоты валина (Val) на метионин (Met) в 66 кодоне; эта замена нарушает внутриклеточную сортировку белка BDNF и его наличие в синаптической щели [10]. Данный полиморфизм ассоциирован с течением и развитием различных неврологических и психических расстройств, в том числе его связывают с расстройствами пищевого поведения, такими как нервная анорексия и нервная булимия [11]. В исследовании Gratocos M. et al. [12] было выявлено, что у лиц с генотипами p.[Val66]; [Met66] и p.[Met66]; [Met66] риск развития расстройств пищевого поведения увеличивается до 33%. Однако точная роль полиморфизма с.189G>A p.(Val66Met) в формировании предрасположенности к расстройствам пищевого поведения изучена недостаточно. Так, в нескольких исследованиях были установлены ассоциации генотипов p.[Val66]; [Met66] и p.[Met66]; [Met66] с вероятностью развития данных заболеваний [11–14], но в других исследованиях таких ассоциаций обнаружено не было [15–19].
Лептин – это пептидный гормон, вырабатываемый адипоцитами [20, 21]. Наиболее известное действие лептина – модулирование потребления пищи [22–24], регулирование массы тела и энергетического гомеостаза [25–27]. В нескольких исследованиях, проведенных на мышах, была продемонстрирована взаимосвязь лептина и BDNF. В исследовании Wang P. et al. [28] на мышах с дефицитом лептина ob/ob было показано, что при делеции гена BDNF притупляется влияние лептина на иннервацию жировой ткани. Оказалось, что при лечении лептином у мышей ob/ob повышаются общие уровни мРНК BDNF [29]. В исследовании Monteleone P. et al. [30] было продемонстрировано, что BDNF и лептин могут дополнительно участвовать в модуляции процессов вознаграждения и мотивирования на поощрение употребления высококалорийной пищи, богатой углеводами или жирами. В связи с этим целью данного исследования стал поиск ассоциации полиморфизма с.189G>A p.(Val66Met) гена BDNF с уровнем лептина в случайной выборке якутов молодого возраста с учетом индекса массы тела (ИМТ).
МАТЕРИАЛ И МЕТОДЫ
В исследование были включены 281 человек (186 женщин и 95 мужчин), средний возраст которых составил 19,8±1,5 лет. Все участники – этнические якуты, которые были здоровы во время исследования и прошли анкетирование с указанием пола, национальности и возраста. Выборку составили лица, не предъявлявшие жалобы на состояние здоровья и не состоящие на диспансерном учете по хроническим заболеваниям. Все обследуемые дали письменное информированное согласие на участие в исследовании и обработку персональных данных. Данная работа была одобрена локальным этическим комитетом по биомедицинской этике при Якутском научном центре комплексных медицинских проблем (г. Якутск, протокол № 16 от 13 декабря 2014 г.).
Венозная кровь для исследования забиралась утром после 12-часового голодания у всех участников. Антропометрические показатели (масса тела в килограммах, рост в сантиметрах) измерялись у всех участников по стандартизованным методам. ИМТ рассчитывали делением массы тела на квадрат роста. Общая выборка была разделена на три группы согласно классификации Всемирной организации здравоохранения (ВОЗ): с дефицитом веса (≤18,4 кг/м2; n=37), с нормальным весом (18,5–24,99 кг/м2; n=215), с избыточной массой тела/ожирением (≥25 кг/м2; n=29). Для определения уровня циркулирующего в крови лептина использовали иммуноферментный набор Leptin ELIS Akit (Diagnostics Biochem Canada Inc., Канада). Концентрацию лептина в образцах измеряли при длине волны 450 нм в микротитровальном планшет-ридере VICTORX5 Multimode Plate Reader (Perkin Elmer Inc., США).
Геномную ДНК выделяли из цельной крови методом фенол-хлороформной экстракции. Генотипирование выполнялось методом ПЦР-ПДРФ-анализа. Оригинальные олигонуклеотидные праймеры были подобраны с использованием программы FastPCR (http://primerdigital.com/). Последовательность использованных праймеров для с.189G>A p.(Val66Met) гена BDNF: F: 5’-AGAAGAGGAGGCTCCAAAGG-3’, R: 5’-CCATTCACGCTCTCCAGAGT-3’.
Детекция проводилось с помощью стандартной ПЦР на T100 Thermal Cycler (Bio-Rad Laboratories, Inc., США). Условия ПЦР для с.189G>A p.(Val66Met) гена BDNF были следующими: начальный этап денатурации – 95 °C (5 мин), денатурация – 95 °C (45 с), отжиг – 55 °C (45 с), элонгация – 72 °C (7 мин), всего 30 циклов. Анализ полиморфизма длин рестрикционных фрагментов выполнялся с использованием эндонуклеазы FaeI («СибЭнзим», Россия) в соответствии с рекомендациями производителя. Разделение продуктов гидролиза проводили в горизонтальных электрофорезных камерах в 4% агарозном геле. Визуализация электрофореграмм осуществлялась с помощью систем гель-видеодокументации фирмы Bio-Rad (США). После инкубации с FaeI аллель Val остается интактным (197 п.н.), тогда как аллель Met расщепляется (122 и 75 п.н.).
Результаты исследования анализировались с помощью компьютерной программы для статистической обработки данных SPSS Statistica 18.0 (SPSS: An IBM Company, США). Значения р ≤0,05 считали статистически значимыми. Все результаты выражали как стандартное отклонение (±) стандартная ошибка. Анализ равновесия Харди–Вайнберга оценивали посредством критерия χ2. Сравнительный анализ уровней лептина в зависимости от генотипов с.189G>A p.(Val66Met) для групп с дефицитом веса и избыточной массой тела/ожирением (n <30) был произведен с применением критерия Манна–Уитни (U-критерий), для лиц с нормальным весом сравнительный анализ был сделан с использованием критерия Стьюдента (t-критерия; n >60).
РЕЗУЛЬТАТЫ
Средние уровни лептина в популяции якутов, а также корреляция лептина с ИМТ и с полом ранее были определены и опубликованы [31, 32]. В настоящей работе были определены частоты аллелей и генотипов полиморфизма с.189G>A p.(Val66Met) гена BDNF в популяции якутов. Частота мажорного аллеля p.(Val66) составила 84,9%, минорного аллеля p.(Met66) – 15,1%. Распределение частот генотипов по исследуемому полиморфизму в выборке якутов (n=281) соответствовало равновесию Харди–Вайнберга (χ2 = 0,09). Наиболее распространенным был генотип p.[Val66]; [Val66] (58%), редким ‒ p.[Met66]; [Met66] (16%), гетерозиготный вариант p.[Val66]; [Met66] составил 26%.
В связи с низкой частотой гомозигот p.[Met66]; [Met66] и гетерозигот p.[Val66]; [Met66] для анализа уровней лептина в зависимости от ИМТ и от генотипов полиморфизма с.189G>A гена BDNF данные два генотипа были объединены в одну группу: p.[Val66]; [Met66] + p.[Met66]; [Met66]. В таблице представлены уровни лептина у якутов с нормальным весом, дефицитом веса, избытком веса/ожирением в зависимости от генотипов полиморфизма с.189G>A p.(Val66Met) гена BDNF.
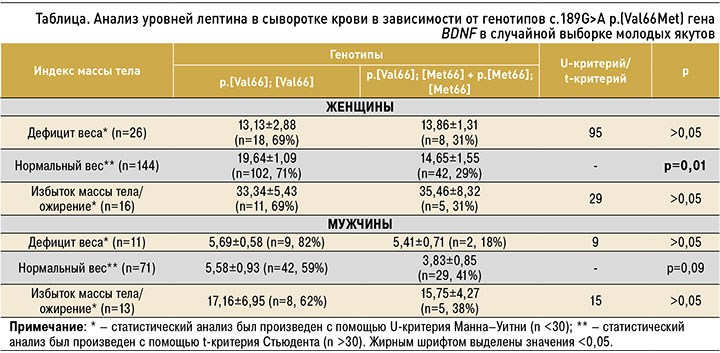
Сравнительный анализ не выявил значимых различий в уровнях лептина между двумя генотипами p.[Val66]; [Met66] + p.[Met66]; [Met66] и p.[Val66]; [Val66] у женщин и мужчин с дефицитом веса и с избытком веса/ожирением. Значимые ассоциации были обнаружены у женщин с нормальным весом, где уровень лептина был достоверно выше у лиц с генотипом p.[Val66]; [Val66] (19,64±1,09 нг/мл), по сравнению с генотипами p.[Val66]; [Met66] + p.[Met66]; [Met66] (14,65±1,55 нг/мл; p=0,01). У мужчин с нормальной массой тела была установлена похожая тенденция к повышению уровня лептина у гомозигот p.[Val66]; [Val66] (5,58±0,93 нг/ мл), по сравнению с p.[Val66]; [Met66] + p.[Met66]; [Met66] (3,83±0,85 нг/мл), которая, вероятно, из-за небольшой численности последних не достигла статистической значимости (p=0,09).
ОБСУЖДЕНИЕ
В настоящем исследовании мы определили частоты аллелей и генотипов полиморфизма с.189G>A p.(Val66Met) гена BDNF в популяции якутов. Ранее в этой же в выборке индивидов (281 человек – 186 женщин и 95 мужчин, средний возраст 19,8±1,5 лет) был измерен уровень циркулирующего в крови лептина, который имел прямую корреляционную зависимость от ИМТ (как у мужчин, так и у женщин) и демонстрировал выраженный половой диморфизм [31, 32]. У женщин средние уровни лептина (18,95±0,9 нг/мл) были в 2 раза выше, чем у мужчин (6,57±0,88 нг/мл) [31]. Также было выявлено, что у лиц с избыточным весом/ожирением уровни лептина намного выше, чем у лиц с нормальным весом и дефицитом веса [32]. Таким образом, полученные результаты об уровнях лептина в популяции якутов соответствовали ранее опубликованным общемировым данным [33–39].
С учетом полового диморфизма и зависимости уровней лептина от количества жировой ткани общая выборка была стратифицирована по полу и подразделена в зависимости от ИМТ на три группы: с дефицитом веса (n=37), нормальным весом (n=215) и избыточной массой тела/ожирением (n=29). В результате было обнаружено, что среди женщин, имеющих нормальный вес, уровень лептина был достоверно выше у лиц с генотипом p.[Val66]; [Val66] (19,64±1,09 нг/мл) по сравнению с p.[Val66]; [Met66] + p.[Met66]; [Met66] (14,65±1,55 нг/мл; p=0,01; см. табл.). У мужчин с нормальным весом была обнаружена тенденция к повышению уровня лептина у гомозигот p.[Val66]; [Val66] (5,58±0,93 нг/мл) по сравнению с p.[Val66]; [Met66] + p.[Met66]; [Met66] (3,83±0,85 нг/мл; p=0,09). В целом наши результаты свидетельствуют о том, что разные аллельные варианты полиморфизма с.189G>A p.(Val66Met) гена BDNF, вероятно, могут влиять на уровни циркулирующего в крови лептина, поскольку и лептин, и BDNF вовлечены в общий механизм регулирования энергетического гомеостаза.
Регулирование энергетического гомеостаза, аппетита и массы тела довольно сложно контролируется ЦНС. В настоящий момент известно, что контроль приема пищи у людей регулируется не только гомеостатическими механизмами, но также когнитивными и аффективными процессами (вознаграждением, эмоциями/памятью, вниманием) [40]. Так, в исследовании Monteleone P. et al. [30] было показано, что BDNF и лептин могут дополнительно участвовать в модуляции процессов вознаграждения и мотивирования на поощрение употребления высококалорийной пищи, богатой углеводами или жирами. В свою очередь, гомеостатический контроль приема пищи осуществляется в гипоталамусе и включает несколько нейронных систем. Лептин выступает одним из ключевых гормонов, который может воздействовать на эти нейронные системы, подавляя или пробуждая аппетит. В настоящее время хорошо изучены пути передачи лептинового сигнала через дугообразное ядро гипоталамуса, но недавние исследования показывают, что рецепторы лептина, экспрессирующиеся в вентромедиальном гипоталамическом ядре, также могут влиять на энергетический гомеостаз [22, 41]. Возможно, передача сигналов лептина играет решающую роль в передаче симпатического тонуса от вентромедиального гипоталамического ядра к периферическим тканям [42].
Вентромедиальное гипоталамическое ядро – важная область мозга, которое может оказывать воздействие на мотивацию к приему пищи и соответственно связано с массой тела [43, 44]. Было установлено, что вентромедиальное гипоталамическое ядро содержит высокую плотность нейронов, которые экспрессируют BDNF [45]. В нескольких работах было обнаружено, что лептин может стимулировать свою синаптическую нейропластичность через BDNF [46, 47] и, возможно, имеется дополнительный сигнальный путь лептина через BDNF в вентромедиальном гипоталамическом ядре. Носители аллеля p.(Met66) с рождения, по-видимому, имеют пониженную экспрессию BDNF в вентромедиальном гипоталамическом ядре, и в связи с этим у них нарушается данный дополнительный лептиновый сигнальный путь. По аналогии с результатами исследований об экспрессии BDNF, о его сигнальных путях в вентромедиальном гипоталамическом ядре, которые были проведены на различных линиях мышей (ob/ob, BDNFlacZ, BDNFklox/klox) [41, 45–47], мы выдвинули предположение о возможном механизме регулирования насыщения и формирования чувства голода лептином через BDNF в гипоталамусе (рис.).

Возможно, эти нарушения приводят к пониженному аппетиту (вероятнее всего, нарушаются процессы вознаграждения и мотивирования на поощрения употребления высококалорийной пищи), что приводит к недостаточному накоплению жировой ткани и, следовательно, к низким уровням лептина в крови. Это, в свою очередь, становится фактором риска развития дальнейших расстройств пищевого поведения, в крайних случаях, приводящих к нервной анорексии и булимии.
ЗАКЛЮЧЕНИЕ
1. В популяции якутов (n=281) частота мажорного аллеля p.(Val66) составила 84,9%, а минорного аллеля p.(Met66) – 15,1%. Наиболее распространенным был генотип p.[Val66]; [Val66] (58%), редким ‒ p.[Met66]; [Met66] (16%), гетерозиготный вариант p.[Val66]; [Met66] встречался в 26% случаев.
2. В популяции якутов выявлена ассоциация генотипов p.[Val66]; [Met66] + p.[Met66]; [Met66] с пониженным уровнем лептина в сыворотке крови у женщин с нормальным весом (p=0,01). У мужчин с данными генотипами обнаружена тенденция к понижению уровня лептина (p=0,09).
3. Результаты нашего исследования свидетельствуют о том, что полиморфизм с.189G>A p.(Val66Met) гена BDNF, возможно, связан с нарушением лептинового сигнала в вентромедиальном гипоталамическом ядре, а его аллельный вариант p.(Met66) может выступать фактором риска развития расстройств пищевого поведения.
- Jones M.E., Schoemaker M.J., Wright L.B. et al. Smoking and risk of breast cancer in the generations study cohort. Breast Cancer Res. 2017; 19(1): 118. doi: 10.1186/s13058-017-0908-4.
- Maisonpierre P.C., Le Beau M.M., Espinosa R. et al. Human and rat brain-derived neurotrophic factor and neurotrophin-3: Gene structures, distributions, and chromosomal localizations. Genomics. 1991; 10(3): 558–68. doi: 10.1016/0888-7543(91)90436-I.
- Matsuo K., Walss-Bass C., Nery F.G. et al. Neuronal correlates of brain-derived neurotrophic factor Val66Met polymorphism and morphometric abnormalities in bipolar disorder. Neuropsychopharmacology. 2009; 34(8): 1904–13. doi: 10.1038/npp.2009.23.
- Leibrock J., Lottspeich F., Hohn A. et al. Molecular cloning, and expression of brain-derived neurotrophic factor. Nature. 1989; 341(6238): 149–52. doi: 10.1038/341149a0.
- Acheson A., Conover J.C., Fandl J.P. et al. A BDNF autocrine loop in adult sensory neurons prevents cell death. Nature .1995; 374(6521): 450–53. doi: 10.1038/374450a0.
- Huang L., Wang Z., Li C. Modulation of circulating leptin levels by its soluble receptor. J Biol Chem. 2001; 276(9): 6343–49. doi: 10.1074/jbc.M009795200.
- Lommatzsch M., Zingler D., Schuhbaeck K. et al. The impact of age, weight, and gender on BDNF levels in human platelets and plasma. Neurobiol Aging. 2005; 26(1): 115–23. doi: 10.1016/j.neurobiolaging.2004.03.002.
- Han H.R., Ryu H.-J., Cha H.S. et al. Genetic variations in the leptin and leptin receptor genes are associated with type 2 diabetes mellitus and metabolic traits in the Korean female population. Clin Genet. 2008; 74(2): 105–15. doi: 10.1111/j.1399-0004.2008.01033.x.
- Pedersen B.K., Pedersen M., Krabbe K.S. et al. Role of exercise-induced brain-derived neurotrophic factor production in the regulation of energy homeostasis in mammals. Exp Physiol. 2009; 94(12): 1153–60. doi: 10.1113/expphysiol.2009.048561.
- Egan M.F., Kojima M., Callicott J.H. et al. The BDNF val66met polymorphism affects activity-dependent secretion of BDNF and human memory and hippocampal function. Cell. 2003. 112(2): 257–69. doi: 10.1016/s0092-8674(03)00035-7.
- Ribases M., Gratacos M., Fernandez-Aranda F. et al. Association of BDNF with anorexia, bulimia, and age of onset of weight loss in six European populations. Hum Mol Genet. 2004; 13(12): 1205–12. doi: 10.1093/hmg/ddh137.
- Gratacos M., Gonzalez J.R., Mercader J.M. et al. Brain-derived neurotrophic factor Val66Met and psychiatric disorders: meta-analysis of case-control studies confirm association to substance-related disorders, eating disorders, and schizophrenia. Biol Psychiatry. 2007; 61(7): 911–22. doi: 10.1016/j.biopsych.2006.08.025.
- Ribases M., Gratacos M., Armengol L. et al. Met66 in the brain-derived neurotrophic factor (BDNF) precursor is associated with anorexia nervosa restrictive type. Mol Psychiatry. 2003; 8(8): 745–51. doi: 10.1038/sj.mp.4001281.
- Koizumi H., Hashimoto K., Itoh K. et al. Association between the brain-derived neurotrophic factor 196G/A polymorphism and eating disorders. Am J Med Genet B Neuropsychiatr Genet. 2004; 127B(1): 125–27. doi: 10.1002/ajmg.b.20153.
- De Krom M., Bakker S.C., Hendriks J. et al. Polymorphisms in the brain-derived neurotrophic factor gene are not associated with either anorexia nervosa or schizophrenia in Dutch patients. Psychiatr Genet. 2005; 15(2): 81. doi: 10.1097/00041444-200506000-00003.
- Friedel S., Horro F.F., Wermter A.K. et al. Mutation screen of the brain derived neurotrophic factor gene (BDNF): Identification of several genetic variants and association studies in patients with obesity, eating disorders, and attention-deficit/hyperactivity disorder. Am J Med Genet B Neuropsychiatr Genet. 2005; 132B(1): 96–99. doi: 10.1002/ajmg.b.30090.
- Gunstad J., Schofield P., Paul R.H. et al. BDNF Val66Met polymorphism is associated with body mass index in healthy adults. Neuropsychobiology. 2006; 53(3): 153–56. doi: 10.1159/000093341.
- Monteleone P., Zanardini R., Tortorella A. et al. The 196G/A (Val66met) polymorphism of the BDNF gene is significantly associated with binge eating behavior in women with bulimia nervosa or binge eating disorder. Neurosci Lett. 2006; 406(1–2): 133–37. doi: 10.1016/j.neulet.2006.07.040.
- Dardennes R.M., Zizzari P., Tolle V. et al. Family trios’ analysis of common polymorphisms in the obestatin/ghrelin, BDNF and AGRP genes in patients with Anorexia nervosa: Association with subtype, body-mass index, severity, and age of onset. Psychoneuroendocrinology. 2007; 32(2): 106–113. doi: 10.1016/j.psyneuen.2006.11.003.
- Considine R.V., Kriauciunas A., Ohannesian J.P., Bauer T.L. Serum immunoreactive-leptin concentrations in normal-weight and obese humans. N Engl J Med. 1996; 334(5): 292–95. doi: 10.1056/NEJM199602013340503.
- Zhang Y., Chua S. Leptin function and regulation. In Comprehensive Physiology; Terjung, R. Ed.; John Wiley & Sons, Inc.: Hoboken, NJ, USA. 2017; 351–69. ISBN: 978-0-470-65071-4.
- Elmquist J.K., Elias C.F., Saper C.B. From lesions to leptin: Hypothalamic control of food intake and body weight. Neuron. 1999; 22(2): 221–32. doi: 10.1016/s0896-6273(00)81084-3.
- Baicy K., London E.D., Monterosso J. et al. Leptin replacement alters brain response to food cues in genetically leptin-deficient adults. Proc Natl Acad Sci U S A. 2007; 104(46): 18276–79. doi: 10.1073/pnas.0706481104.
- Garfield A.S., Patterson C., Skora S. et al. Neurochemical characterization of body weight-regulating leptin receptor neurons in the nucleus of the solitary tract. Endocrinology. 2012; 153(10): 4600–07. doi: 10.1210/en.2012-1282.
- Anand B.K., Brobeck J.R. Localization of a «feeding center» in the hypothalamus of the rat. Proc Soc Exp Biol Med. 1951; 77(2): 323–24. doi: 10.3181/00379727-77-18766.
- Ahima R.S., Bjorbaek C., Osei S., Flier J.S. Regulation of neuronal and glial proteins by leptin: Implications for brain development. Endocrinology. 1999; 140(6): 2755–62. doi: 10.1210/endo.140.6.6774.
- Cowley M.A., Smart J.L., Rubinstein M. et al. Leptin activates anorexigenic POMC neurons through a neural network in the arcuate nucleus. Nature. 2001; 411(6836): 480–84. doi: 10.1038/35078085.
- Wang P., Loh K.H., Wu M. et al. A leptin–BDNF pathway regulating sympathetic innervation of adipose tissue. Nature. 2020; 583(7818): 839–44. doi: 10.1038/s41586-020-2527-y.
- Li C., Meng F., Lei Y. et al. Leptin regulates exon-specific transcription of the BDNF gene via epigenetic modifications mediated by an AKT/P300 HAT cascade. Mol Psychiatry. 2021; 26(8): 3701–22. doi: 10.1038/s41380-020-00922-0.
- Monteleone P., Maj M. Dysfunctions of leptin, ghrelin, BDNF and endocannabinoids in eating disorders: beyond the homeostatic control of food intake. Psychoneuroendocrinology. 2013; 38(3): 312–30. doi: 10.1016/j.psyneuen.2012.10.021.
- Никанорова А.А., Барашков Н.А., Находкин С.С. с соавт. Анализ уровня циркулирующего в крови лептина в популяции якутов. Вопросы биологической, медицинской и фармацевтической химии. 2020; 5: 10–14.
- Никанорова А.А., Готовцев Н.Н., Барашков Н.А. с соавт. Уровень циркулирующего в крови лептина у молодых якутов в зависимости от индекса массы тела. Якутский медицинский журнал. 2020; 4: 16–19.
- Couillard C., Mauriege P., Prud’homme D. et al. Plasma leptin concentrations: Gender differences and associations with metabolic risk factors for cardiovascular disease. Diabetologia. 1997. 40(10): 1178–84. doi: 10.1007/s001250050804.
- Fox C.S., Esparza J., Nicolson M. et al. Is a low leptin concentration, a low resting metabolic rate, or both the expression of the «thrifty genotype»? Results from Mexican Pima Indians. Am J Clin Nutr. 1998; 68(5): 1053–57. doi: 10.1093/ajcn/68.5.1053.
- Chan J.L., Heist K., DePaoli A.M. et al. The role of falling leptin levels in the neuroendocrine and metabolic adaptation to short-term starvation in healthy men. J Clin Invest. 2003; 111(9): 1409–21. doi: 10.1172/JCI17490.
- Esteghamati A., Khalilzadeh O., Ashraf H. et al. Physical activity is correlated with serum leptin independent of obesity: results of the national surveillance of risk factors of noncommunicable diseases in Iran (SuRFNCD-2007). Metabolism. 2010; 59(12): 1730–35. doi: 10.1016/j.metabol.2010.04.016.
- Guzman D.D., Marchau L.A.M., Reyes J.L. et al. Leptin levels and nutritional status of indigenous Tepehuan and Mestizo subjects in Durango, Mexico. Dis Markers. 2014; 2014: 974503. doi: 10.1155/2014/974503.
- MacIver N.J., Thomas S.M., Green C.L., Worley G. Increased leptin levels correlate with thyroid autoantibodies in nonobese males. Clin. Endocrinol (Oxf). 2016; 85(1): 116–21. doi: 10.1111/cen.12963.
- Koca T.T., Berk E., Seyithanoglu M. et al. Relationship of leptin, growth hormone, and insulin-like growth factor levels with body mass index and disease severity in patients with fibromyalgia syndrome. Acta Neurol Belg. 2020; 120(3): 595–99. doi: 10.1007/s13760-018-01063-6.
- Farr O.M., Chiang-Shan R.L., Mantzoros C.S. Central nervous system regulation of eating: Insights from human brain imaging. Metabolism. 2016; 65(5): 699–713. doi: 10.1016/j.metabol.2016.02.002.
- Scott M.M., Lachey J.L., Sternson S.M. et al. Leptin targets in the mouse brain. J Comp Neurol. 2009; 514(5): 518–32. doi: 10.1002/cne.22025.
- Zhou Y., Rui L. Leptin signaling and leptin resistance. Front Med. 2013; 7(2): 207–22. doi: 10.1007/s11684-013-0263-5.
- King B.M. Amygdaloid lesion-induced obesity: relation to sexual behavior, olfaction, and the ventromedial hypothalamus. Am J Physiol Regul Integr Comp Physiol. 2006; 291(5): R1201–14. doi: 10.1152/ajpregu.00199.2006.
- Kim K.W., Sohn J.W., Kohno D. et al. SF-1 in the ventral medial hypothalamic nucleus: a key regulator of homeostasis. Mol Cell Endocrinol. 2011; 336(1–2): 219–23. doi: 10.1016/j.mce.2010.11.019.
- Xu B., Goulding E.H., Zang K. et al. Brain-derived neurotrophic factor regulates energy balance downstream of melanocortin-4 receptor. Nat Neurosci. 2003; 6(7): 736–42. doi: 10.1038/nn1073.
- Halaas J., Gajiwala K., Maffei M. et al. Weight-reducing effects of the plasma protein encoded by the obese gene. Science. 1995; 269(5223): 543–46. doi: 10.1126/science.7624777.
- Liao G.Y., An J.J., Gharami K. et al. Dendritically targeted BDNF mRNA is essential for energy balance and response to leptin. Nat Med. 2012; 18(4): 564–71. doi: 10.1038/nm.2687.
Алена Афанасьевна Никанорова, младший научный сотрудник лаборатории молекулярной генетики ФГБНУ «Якутский научный центр комплексных медицинских проблем». Адрес: 677018, г. Якутск, ул. Ярославского,
д. 6/3. E-mail:
nikanorova.alena@mail.ru. ORCID: 0000-0002-7129-6633
Николай Алексеевич Барашков, к.б.н., руководитель лаборатории молекулярной генетики ФГБНУ «Якутский научный центр комплексных медицинских проблем». Адрес: 677018, г. Якутск, ул. Ярославского, д. 6/3. E-mail:
barashkov2004@mail.ru. ORCID: 0000-0002-6984-7934
Сергей Сергеевич Находкин, научный сотрудник научно-исследовательской лаборатории молекулярной биологии Института естественных наук ФГАОУ ВО «Северо-Восточный университет им. М.К. Аммосова». Адрес: 677010,
г. Якутск, ул. Кулаковского, д. 48. E-mail:
sergnahod@mail.ru. ORCID: 0000-0002-6917-5760
Вера Геннадиевна Пшенникова, к.б.н., руководитель лаборатории популяционной генетики ФГБНУ «Якутский научный центр комплексных медицинских проблем». Адрес: 677018, г. Якутск, ул. Ярославского, д. 6/3. E-mail:
pshennikovavera@mail.ru. ORCID: 0000-0001-6866-9462
Ньургун Наумович Готовцев, научный сотрудник лаборатории молекулярной генетики ФГБНУ «Якутский научный центр комплексных медицинских проблем». Адрес: 677018, г. Якутск, ул. Ярославского, д. 6/3. E-mail:
donzcrew@mail.ru. ORCID: 0000-0002-4710-1592
Айсен Васильевич Соловьев, к.б.н., старший научный сотрудник научно-исследовательской лаборатории молекулярной биологии Института естественных наук ФГАОУ ВО «Северо-Восточный университет им. М.К. Аммосова». Адрес: 677010, г. Якутск, ул. Кулаковского, д. 48. E-mail:
nelloann@mail.ru. ORCID: 0000-0002-0664-4224
Георгий Прокопьевич Романов, научный сотрудник научно-исследовательской лаборатории молекулярной биологии Института естественных наук ФГАОУ ВО «Северо-Восточный университет им. М.К. Аммосова». Адрес: 677010, г. Якутск, ул. Кулаковского, д. 48. E-mail:
gpromanov@gmail.com. ORCID: 0000-0002-2936-5818
Саргылана Семеновна Кузьмина, к.б.н., доцент Института естественных наук ФГАОУ ВО «Северо-Восточный университет им. М.К. Аммосова». Адрес: 677010, г. Якутск, ул. Кулаковского, д. 48. E-mail:
sskuzmina@bk.ru
Николай Никитич Сазонов, д.б.н., профессор Института естественных наук ФГАОУ ВО «Северо-Восточный университет им. М.К. Аммосова». Адрес: 677010, г. Якутск, ул. Кулаковского, д. 48. E-mail:
saznikol@mail.ru
Сардана Аркадьевна Федорова, д.б.н., зав. научно-исследовательской лабораторией молекулярной биологии Института естественных наук ФГАОУ ВО «Северо-Восточный университет им. М.К. Аммосова». Адрес: 677010,
г. Якутск, ул. Кулаковского, д. 48. E-mail:
sardaanafedorova@mail.ru. ORCID: 0000-0002-6952-3868





