ВВЕДЕНИЕ
Коронавирусная болезнь – 2019 (COVID-19), вызванная коронавирусом 2 тяжелого острого респираторного синдрома (SARS-CoV-2), стала причиной самой масштабной пандемии XXI в. По данным Всемирной организации здравоохранения (ВОЗ), к началу июня 2021 г. в мире было зафиксировано 170 812 250 случаев COVID-19, при этом более 5 млн пациентов погибли в результате этого заболевания [1]. В России на 1 июня 2021 г. было зарегистрировали 5,01 млн случаев COVID-19 и 119 464 случая смерти [2].
Большинство стран мира столкнулось с драматическими последствиями пандемии в силу высоких показателей заболеваемости и смертности от коронавирусной инфекции. Однако ее влияние на общество и человека не ограничивается демографическими или экономическими характеристиками, непосредственно связанными с болезнью. Многие авторы сообщают о том, что элиминация вируса из организма не означает излечения от заболевания, поскольку последствия инфекции могут сохраняться у пациентов в течение недель и даже месяцев [3, 4]. Национальным институтом усовершенствования клинической практики (National Institute of Clinical Excellence, NICE) Великобритании предложены определения синдромов post-COVID и long-COVID, которые характеризуют пациентов с остаточными симптомами и признаками заболевания в течение 12 и более недель или в течение 4–12 нед после инфицирования [5]. К числу особенностей COVID-19 относится повышенный риск тромботических осложнений как в остром периоде заболевания [6], так и у пациентов с перенесенной инфекцией [7–11]; существует мнение, что если при post-COVID более распространенными являются тромбозы и тромбоэмболии сосудов легких, то при long-COVID возрастает частота нарушений коронарного кровообращения и инфаркта миокарда (ИМ) [7]. Вместе с тем отсутствие больших проспективных когортных и рандомизированных контролируемых исследований ограничивает возможность стратифицировать риск тромбоэмболических событий в период post- и long-COVID [12]. Тем не менее, важно рассмотреть причины тромбоэмболий и эффективность существующих подходов к управлению данным риском у больных COVID-19.
Артериальные тромбозы при COVID-19
Риск тромбоэмболических осложнений при COVID-19 обусловлен влиянием вируса на систему гемостаза: он непосредственно или через вызванный им цитокиновый шторм повреждает эндотелий (SARS‑CoV‑2-ассоциированая эндотелиальная дисфункция). При этом также активируются тромбоциты, что в конечном итоге приводит к синдрому гиперкоагуляции с развитием тромботической микроангиопатии легких, миокарда, головного мозга, почек и других органов и тромбоза крупных артерий и вен (нередко с тромбоэмболией). Существуют доказательства связи части наблюдений постковидного синдрома наряду с другими патологическими процессами с пролонгированной тромботической микроангиопатией и сохраняющимся синдромом гиперкоагуляции [13].
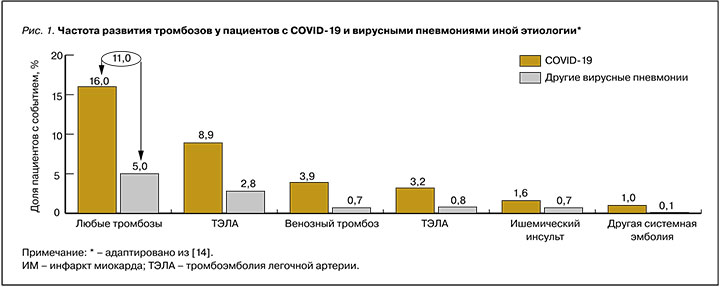
В крупном ретроспективном исследовании Smilowitz N.R. et al. (2020) сравнили риск развития тромбозов у пациентов с COVID-19 (n=3334) и больных другими вирусными пневмониями (n=954 521 случай за 2002–2014 гг.). У пациентов с COVID-19 риск любых тромботических осложнений был втрое выше, чем у больных вирусными пневмониями иной этиологии (рис. 1), и составил 16 против 5% (p <0,01) [14].
Modin D. et al. (2020) в популяционном исследовании установили, что у пациентов с COVID-19 (n=5119) отношение частоты острых сердечно-сосудистых осложнений в сравнении с контрольной популяцией без инфекции составляло 12,9 (95% доверительный интервал (ДИ): 7,1–23,5) для ишемического инсульта (p <0,001) и 5,9 (95% ДИ: 1,9–18,2) для острого ИМ [15]. Bilaloglu S. et al. (2020) в проспективном исследовании (n=3334) отметили, что среди пациентов с COVID-19 частота артериальных тромботических событий достигала 11,1% (n=365), причем 8,9% таких случаев приходилось на острый ИМ. Дополнительно авторы выяснили, что вероятность артериальных тромбозов увеличивалась пропорционально возрасту [16]. В проспективном международном многоцентровом исследовании с участием 1216 пациентов с предполагаемым COVID-19 у 667 человек (55%) были выявлены изменения на эхокардиограмме (ЭхоКГ). Среди 901 больного без ранее существовавшего сердечно-сосудистого заболевания (ССЗ) отклонения на ЭхоКГ были обнаружены в 46% случаев [17]. В ранних исследованиях пандемии COVID-19 20–35% госпитализированных пациентов с COVID-19 имели повышенные уровни сердечных биомаркеров (тропонина и натрийуретических пептидов) [18].
Влияние сопутствующих состояний на прогноз пациентов с коронавирусной инфекцией
Помимо непосредственного риска, связанного с повышенным тромбообразованием, существенный вклад в риск развития тромботических осложнений и смертности при COVID-19 вносят сопутствующие заболевания, частота которых в популяции достигает 30% [19]. К основным факторам риска тяжелого течения инфекции и смертности относят артериальную гипертензию [20, 21] и другие ССЗ [21–23], сахарный диабет [20, 21, 23, 24], хронические болезни легких [23–26], заболевания почек [22, 23]. Yang J. et al. (2020) в метаанализе исследований COVID-19 показали, что ССЗ, сахарный диабет и болезни дыхательной системы более чем в два раза повышают вероятность тяжелого течения инфекции (рис. 2) [21]. По данным Guo T. et al. (2020), у пациентов с ССЗ и признаками повреждения миокарда смертность в течение 50 дней повышалась до 70%, тогда как у пациентов без заболеваний сердечно-сосудистой системы аналогичный показатель составлял лишь 7,5% (рис. 3) [25].


Влияние COVID-19 на развитие сердечно-сосудистых заболеваний
Kwong J.C. et al. продемонстрировали, что пациенты имеют повышенный риск развития острого ИМ после гриппа (отношение риска (ОР): 6,1; 95% ДИ: 3,9–9,5) и после других вирусных заболеваний, не связанных с гриппом, включая некоторые виды коронавируса (коэффициент заболеваемости: 2,8; 95% ДИ: 1,2–6,2) [26].
К настоящему времени известно, что негативное влияние COVID-19 на здоровье и прогноз пациента не ограничивается периодом острой инфекции. Для формирования окончательной позиции относительно риска тромбозов после перенесенной инфекции недостаточно данных, однако ряд авторов указывает на сохранение патофизиологических механизмов, которые отвечают за повышенный риск тромбоза в остром периоде, в течение длительного времени после клинического выздоровления [27, 29]. Patell R. et al. (2020) сообщили, что среди перенесших COVID-19 пациентов (n=163) частота тромбозов равнялась 2,5% (95% ДИ: 0,8–7,6) [11].
У пациентов без ССЗ после острой фазы заболевания могут возникнуть как типичные симптомы поражения сердечно-сосудистой системы (например, признаки сердечной недостаточности, боль в груди и сердцебиение), так и неспецифические жалобы – усталость, слабость, одышка или кашель. Усталость, боль в груди и одышка вместе с проблемами со сном и тревогой/депрессией относятся к наиболее часто регистрируемым симптомам через несколько недель после выписки из больницы у больных, перенесших острую фазу COVID-19 [18]. Тяжесть инфекции – наиболее значимый предиктор симптомов в течение 6 мес после начала COVID. Поэтому пациенты, которые перенесли тяжелую коронавирусную инфекцию, по-видимому, должны быть основным объектом для тщательного наблюдения после выписки [27].
Помимо клинических проявлений COVID-19, в амбулаторных условиях в постковидном периоде необходимо учитывать также уровень тропонина, данные визуализирующих методов обследования во время острой фазы и методы лечения острого COVID-19. Это позволит получить представление о потенциальном повреждении миокарда и его последствиях [29]. Наряду с прямым воздействием на сердце, сосуды, легкие и другие ткани, инфекция SARS-CoV-2 и ее последствия могут влиять на различные факторы риска развития ССЗ. Такими факторами являются длительное воспаление, гиперкоагуляция, дислипидемия, вызванная или усугубляемая иммуносупрессивным лечением, депрессия и саркопения [18].
Более того, на фоне пандемии COVID-19 во многих странах отмечается снижение числа обращений за медицинской помощью по поводу больших коронарных событий [30–35]. Tanislav C. et al. (2021) сообщили, что с апреля по июнь 2020 г. число обращений за помощью в связи с ИМ, инсультом и транзиторной ишемической атакой снизилось на 9, 10 и 16% соответственно по сравнению с тем же периодом в 2019 г. [30]. Andersen J. et al. (2020) установили, что в Дании в 2020 г. в сравнении с показателями 2019 г. уменьшение числа обращений происходило преимущественно среди пациентов с низким и средним уровнем образования, в то время как для населения с высоким уровнем образования показатель не изменялся или несущественно увеличивался [36]. При этом сама частота регистрации событий могла не изменяться [37], что указывает на разрыв между числом случаев сердечно-сосудистых осложнений и частотой оказания медицинской помощи в связи с ними. Таким образом, разработка амбулаторных стратегий снижения сердечно-сосудистого риска представляется необходимой мерой в период пандемии.
Влияние антиагрегантов на тромбозы при COVID-19
Роль антиагрегантов в комплексной терапии пациентов с инфекционными заболеваниями изучается на протяжении длительного времени. Так, недавно проведенный метаанализ 7 обсервационных исследований (n=7660) пациентов из группы высокого риска показал, что антитромбоцитарная терапия была связана со снижением частоты острого респираторного дистресс-синдрома (отношение шансов (ОШ) 0,68; 95% ДИ: 0,52–0,88; p=0,004) [38].
Тикагрелор, по сравнению с клопидогрелом, снижает риск смертности от легочных инфекционных осложнений и сепсиса у пациентов с острым коронарным синдромом (ОКС) [39].
Ацетилсалициловая кислота (АСК) обладает как антиагрегантным, так и противовоспалительным эффектом. Вместе с тем особенности инфекционного процесса COVID-19 обусловливают потребность в изучении применения АСК при этом заболевании. В настоящее время по крайней мере в 9 клинических исследованиях приведена оценка влияния приема профилактических доз АСК на риск тромбозов [40].
По мнению ряда авторов, применение АСК для профилактики тромбозов в период пандемии рационально, что объясняется положительными результатами клинических исследований и метаанализов, посвященных изучению профилактического приема этого лекарственного средства для снижения риска тромбозов [41, 42]. В то же время воздействие препарата как на агрегацию тромбоцитов, так и воспаление может влиять на развитие инфекционного процесса и сопутствующих тромбозов [43, 44]. Godino C. et al. (2020) установили, что АСК и другие антиагреганты способны оказывать прямое действие на звенья патогенеза гипервоспаления при COVID-19 и одновременно уменьшать тромбообразование [45].
Sayed Ahmed H.A. et al. (2021) рекомендовали использование АСК в низких дозах (75–100 мг/сут) для снижения риска тромбозов в период пандемии COVID-19 [46].
При коронавирусной инфекции, кроме АСК, используются и другие антиагреганты. Например, в протокол лечения COVID-19 медицинского центра МГУ был включен дипиридамол [47].
Потенциальная польза антиагрегантов при COVID-19
Canzano P. et al. (2021) в исследовании in vitro показали, что АСК в концентрации 100 мкмоль/л подавляла агрегацию тромбоцитов с моноцитами и гранулоцитами в присутствии плазмы крови, полученной от больных COVID-19 (рис. 4) [48].

Ретроспективное исследование исходов у госпитальных пациентов (n=1729) показало, что лечение антиагрегантами было связано с меньшим риском смерти (ОР 0,6; 95% ДИ: 0,4–0,9). Применялись низкие дозы АСК, клопидогрела, тикагрелора и прасугрела [49].
Aghajani M.H. et al. (2021) в ретроспективном исследовании продемонстрировали, что у больных, госпитализированных по поводу тяжелого течения COVID-19, которые постоянно получали АСК (n=336), риск смерти был статистически значимо ниже, чем у пациентов, не принимавших АСК (n=655): скорректированное ОР составило 0,753 (95% ДИ: 0,573–0,991; p=0,043) [50].
Схожие результаты получили Chow J.H. et al. (2021). В проведенный ими анализ были включены ретроспективные данные 412 пациентов с COVID-19, которые получали АСК до госпитализации (n=98; 23,7%) или не принимали это лекарственное средство (n=314; 76,3%). У пациентов, которые принимали АСК, частота госпитализаций в отделение реанимации и интенсивной терапии (ОРИТ) была ниже, чем у больных, не получавших препарат, и составила 38,8 против 51% соответственно (p=0,04). Также на фоне приема АСК статистически значимо реже приходилось прибегать к помощи искусственной вентиляции легких (ИВЛ): 35,7 против 48,5% у пациентов, которые не принимали АСК (p=0,03). После поправки на ковариаты (рис. 5) было установлено, что прием АСК также ассоциировался со статистически значимо меньшим риском госпитальной смертности (скорректированное ОР=0,53; 95% ДИ: 0,31–0,9; p=0,02) [51].

По данным ретроспективного исследования Meizlich M.L. et al. (2021), прием профилактических доз АСК до госпитализации по поводу COVID-19 оказывал сопоставимое с антикоагулянтной терапией положительное влияние на госпитальную смертность. ОР смерти на фоне приема АСК составляло 0,522 (95% ДИ: 0,336–0,812), а при использовании антикоагулянтов в профилактических дозах – 0,518 (95% ДИ: 0,308–0,872) [52]. Osborne T.F. et al. (2021) при изучении ретроспективных данных когорты пациентов с COVID- 19 (n=35 370) также выявили снижение риска смертности в течение 14 дней (ОР=0,38; 95% ДИ: 0,32–0,46) и 30 дней (ОР=0,38; 95% ДИ: 0,33–0,45) при использовании профилактических доз АСК до заболевания [53].
В рандомизированном исследовании RECOVERY (n=14 892) госпитализированные пациенты, получавшие АСК в дозе 150 мг (n=7 351), имели меньшую продолжительность госпитализации (медиана 8 против 9 дней); большая доля таких пациентов была выписана из больницы живыми в течение 28 дней (75 против 74%; ОР 1,06; 95% ДИ 1,02–1,10; р=0,0062). Отдельно была проанализирована подгруппа пациентов, принимавших только АСК без антикоагулянтов (гепарина), – около 500 человек. Данная подгруппа имела более высокие шансы на выписку из госпиталя в 28-дневный срок (ОР 1,19; 95% ДИ 1,01−1,41) по сравнению с пациентами, не принимавшими АСК [54].
В то же время в отдельных исследованиях явные преимущества применения АСК при COVID- 19 отсутствовали. В частности, Yuan S. et al. (2020) сообщили, что прием АСК не был ассоциирован с изменением смертности на фоне COVID- 19 у пациентов с ишемической болезнью сердца (ИБС): ОШ составило 0,944 (95% ДИ: 0,411–2,172; p=0,893) [55]. Однако, согласно результатам метаанализа Martha J.W. et al. (2021), в который вошли 6 исследований (n=13 993), прием АСК в низких дозах был связан со снижением риска общей смертности (ОР=0,46; 95% ДИ: 0,35–0,61; p <0,001), а также меньшим риском госпитальной смертности (ОР=0,39; 95% ДИ: 0,16–0,96; p <0,001). Авторы отметили, что небольшой объем имеющихся данных исследований и их ретроспективный дизайн указывают на необходимость проведения тематических контролируемых клинических исследований [56].
Поскольку АСК оказывает влияние на воспаление и иммунный ответ, ряд авторов предполагали возможное повышение риска инфицирования COVID-19 на фоне ее использования. Вместе с тем анализ данных 2 736 091 пациента из США, Великобритании и Швеции, проведенный Drew D.A. et al. (2021), не выявил связи между приемом АСК и заражением COVID-19 (ОР=1,13; 95% ДИ: 0,92–1,38) [57]. Более того, Merzon Е. et al. (2021) в ретроспективном исследовании продемонстрировали, что доля пациентов с положительным тестом на COVID-19 среди пациентов, получавших АСК, составляла 11,03 против 15,77% среди тех, кто не принимали АСК (p=0,001). При этом средняя продолжительность болезни на фоне приема АСК также была ниже: 19,8±7,8 против 21,9±7,9 дней (p=0,045). Авторы, однако, указали, что репрезентативность полученных результатов ограничена, поскольку прием АСК в реальной практике обычно связан с большим возрастом и наличием сопутствующих заболеваний, при которых в период пандемии была рекомендована строгая самоизоляция [58]. В качестве механизма действия АСК при COVID-19 некоторые авторы предполагают подавление избыточной воспалительной реакции, вследствие чего проявления заболевания и его длительность могут уменьшаться [59].
В свете вышесказанного повышенный практический интерес представляет разработанная группой российских специалистов Резолюция Совета экспертов по обмену научным опытом применения антиагрегантов, включая ацетилсалициловую кислоту, в качестве профилактики артериальных сосудистых осложнений COVID-19 в разные периоды заболевания (далее – резолюция Совета экспертов), которая приводится ниже.
АНАЛИЗ НАУЧНЫХ ДАННЫХ ПО ПРИМЕНЕНИЮ АНТИАГРЕГАНТОВ, В ТОМ ЧИСЛЕ АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ, ПРИ COVID-19: РЕЗОЛЮЦИЯ СОВЕТА ЭКСПЕРТОВ
Коронавирусная инфекция (COVID-19), вызванная РНК-вирусом SARS-CoV-2, характеризуется не только поражением дыхательного тракта, но и серьезными повреждениями эндотелия и нарушениями в системе гемостаза, которые могут приводить к развитию артериальных и венозных тромбозов. Согласно результатам наблюдательных исследований, ССЗ часто встречаются среди стационарных пациентов с коронавирусной инфекцией. Также наличие у пациентов ССЗ связано с повышенным риском осложнений и смертельного исхода при COVID-19. В связи с клинической картиной коронавирусной инфекции, высоким риском сердечно-сосудистых осложнений как в острый, так и в отдаленный период COVID-19 на сегодняшний день особенно остро стоит вопрос повышения эффективности лечения и профилактики COVID- 19 и его осложнений в реальной клинической практике. На основании опубликованных результатов рандомизированных клинических исследований и метаанализов одним из логических звеньев профилактики ишемических и тромботических осложнений коронавирусной инфекции представляется уточнение и дополнение существующих рекомендаций по антитромботической терапии в контексте COVID-19.
С целью получения экспертного мнения по вопросам, связанным с актуальностью, протоколами и режимами антитромботической терапии у пациентов с COVID-19 на госпитальном и амбулаторном этапах лечения, а также после перенесенной коронавирусной инфекции, под председательством члена-корр. РАН О.М. Драпкиной и д.м.н. Н.В. Ломакина 12 октября 2021 г. при научной и организационной поддержке ФГБУ «Национальный медицинский исследовательский центр терапии и профилактической медицины» Минздрава России и Российского общества профилактики неинфекционных заболеваний состоялось заседание Совета экспертов для обмена опытом. Группа экспертов различных специальностей (терапия, кардиология и ангиология, лабораторная медицина, гематология, клиническая фармакология, реанимация и интенсивная терапия), имеющих клинический опыт лечения пациентов с COVID-19, ответила на вопросы об использовании антиагрегантов, в частности АСК, на различных этапах оказания помощи при COVID-19.
Как известно, гибель эндотелиоцитов служит предрасполагающим механизмом тромбообразования при COVID-19. При изучении коронавирус-опосредованного повреждения эндотелия были получены доказательства непосредственного цитотоксического воздействия SARS-CoV-2 на эндотелиальные клетки: отмечено появление многочисленных отверстий на мембранах эндотелиоцитов, размер которых сопоставим с диаметром суперкапсида вириона SARS-CoV-2. Предполагается, что такие отверстия произведены многократно реплицировавшимся в эндотелиальных клетках вирусом, выходящим из поврежденной или убитой им клетки. Реплицируясь в эндотелиальных клетках, коронавирус убивает «приютившую» клетку, которая отделяется от стенки сосудов, оголяя субэндотелиальную поверхность. Это, в свою очередь, приводит к развитию коагулопатии, периваскулярному воспалению, отеку тканей и прокоагулянтному статусу. Повреждение сосудов вирусом SARS-CoV-2 влечет за собой весьма значительную денудацию сосудов, что неизбежно вызывает нарушение нормального функционирования сосудистой системы, а также сдвиг параметров крови, приводящий в том числе к активации тромбоцитов. В дальнейшем это ведет к интенсивному внутрисосудистому тромбообразованию и изменениям эритроцитов, сопровождающимся нарушением газообмена в органах и тканях и в конечном счете выраженной гипоксии [60]. Также выявлено, что повреждение вирусом кишечника, в частности подвздошной и толстой кишки, может привести к нарушению всасывания лекарственных препаратов [61, 62]. Это должно учитываться при выборе фармакотерапии: по возможности следует отдавать предпочтение таким формам лекарственных препаратов, которые всасываются преимущественно в желудке. Примером здесь может служить АСК без кишечнорастворимой оболочки.
Особого внимания заслуживают положения российских и зарубежных рекомендаций научных сообществ в отношении применения антиагрегантов и, в частности АСК, с целью снижения риска сердечно-сосудистых осложнений у пациентов с COVID-19 и имеющимися ССЗ. Накопленные клинические данные свидетельствуют, что у пациентов после COVID-19 различной степени тяжести наблюдается повышенный риск ИМ и ишемического инсульта [9]. Рекомендации научных обществ говорят о необходимости продолжения терапии антиагрегантами у пациентов с уже имеющимися ССЗ при COVID-19 [63, 64]. При возникновении же новых ССЗ лечение должно осуществляться согласно клиническим рекомендациям по лечению соответствующих нозологий (Клинические рекомендации «Стабильная ишемическая болезнь сердца», 2020; «Острый коронарный синдром без подъема сегмента ST электрокардиограммы», 2020; «Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы», 2020) [65–67].
Также необходимо учитывать лекарственные взаимодействия. При совместном применении антиагрегантов и антикоагулянтов повышается вероятность геморрагических осложнений; с целью снижения риска кровотечений рекомендовано использование минимально возможных доз АСК (75 мг) с одновременной коррекцией дозировки антикоагулянта и применение ингибиторов протонной помпы [68]. При необходимости применения жаропонижающих средств рекомендуется выбирать лекарственные препараты, содержащие парацетамол.
Среди пациентов как в раннем, так и позднем периоде реконвалесценции наблюдается повышенный риск развития ССЗ и артериальных тромбозов [9, 69, 70]. В настоящее время СOVID-19 рассматривается экспертами как еще один фактор риска развития ССЗ и проявления их осложнений [9, 70]. Максимальный риск наблюдается в первые недели от момента постановки диагноза и сохраняется на протяжении более полугода. При этом повышается как частота развития стабильной ИБС, так и острых состояний – ИМ и инсульта. Поэтому врачи должны учитывать эти данные в своей практике и своевременно обследовать пациентов высокого риска, перенесших коронавирусную инфекцию, с целью постановки диагноза ССЗ и назначения адекватного лечения. У пациентов высокого риска, которые не получают АСК с целью первичной профилактики, перенесенная коронавирусная инфекция повышает риск сердечно-сосудистых осложнений и может служить основанием для назначения АСК. Недавно обновленные рекомендации по профилактике ССЗ Европейского общества кардиологов (ESC, сентябрь 2021 г.), а также актуальные рекомендации Американского колледжа кардиологов/Американской ассоциации сердца (2019) указывают на возможность применения АСК у пациентов высокого риска или у больных с сахарным диабетом и высоким риском после индивидуальной оценки соотношения «риск/польза» [71, 72]. Для оценки кардиоваскулярного риска у пациентов после коронавирусной инфекции возможно использование шкал, которые отражают изменения, происходящие под влиянием COVID-19. Например, это может быть шкала Reynolds (http://www.reynoldsriskscore.org), учитывающая уровень высокочувствительного С-реактивного белка.
В отличие от пациентов высокого риска в отношении пациентов с низким риском ССЗ после перенесенной коронавирусной инфекции консенсуса по вопросу назначения АСК в качестве первичной профилактики сердечно-сосудистых осложнений и уменьшения тяжести проявления заболевания достигнуто не было. Обсуждалась возможность использования минимально эффективной дозы АСК 75 мг/сут на срок 1–2 мес после обязательного определения соотношения рисков развития тромботических и геморрагических осложнений. Необходимо дальнейшее накопление данных для определения категорий пациентов с низким риском ССЗ, которым показан прием антиагрегантов (в частности, АСК) для профилактики сердечно-сосудистых осложнений в отдаленный период после перенесенной коронавирусной инфекции.
В августе 2021 г. были сообщены данные, которые указывали, что назначение АСК до постановки диагноза ассоциировалось со снижением уровня смертности среди пациентов с COVID-19 [53]. Один из членов Совета экспертов – д.м.н. Н.В. Ломакин – в связи с этим обратил внимание на результаты работ, где применение АСК для первичной профилактики ССЗ было связано с меньшей вероятностью заболевания COVID-19 [60]. Как руководитель отделения неотложной помощи кардиологии с блоком кардиореанимации, он подчеркнул, что у получающих АСК пациентов реже возникала потребность в ИВЛ и в переводе в блок интенсивной терапии [51].
Результаты метаанализа, опубликованного в мае 2021 г., также продемонстрировали, что назначение низких доз АСК пациентам с COVID-19 до или во время госпитализации было связано с более чем двукратным снижением смертности [56]. Ставшие доступными в июне 2021 г. результаты крупного рандомизированного контролируемого исследования RECOVERY продемонстрировали, что применение АСК у госпитализированных пациентов с COVID-19 уменьшает длительность госпитализации на 1 день и несколько повышает вероятность выписки из стационара в течение 28 дней. Анализ подгрупп в этом исследовании продемонстрировал, что наибольшую пользу от применения АСК могут получить пациенты, которым препарат был назначен в первые 7 дней с момента постановки диагноза «коронавирусная инфекция», а также пациенты, не получавшие антикоагулянты [54]. Эксперты поддержали идею раннего назначения АСК в минимально возможной дозе 75 мг у пациентов с COVID- 19 с целью снижения риска осложнений коронавирусной инфекции и неблагоприятных исходов. Это может быть актуально, в частности, для пациентов на догоспитальном этапе в случае, если они не получают антикоагулянтную терапию.
В своем заключительном слове председатели Совета экспертов подчеркнули актуальность рассмотренных вопросов и плодотворный характер обсуждения.
Таким образом, группой экспертов различных специальностей (терапия, кардиология и ангиология, лабораторная медицина, гематология, клиническая фармакология, реанимации и интенсивная терапия) после обсуждения и подведения итогов были предложены рекомендации по назначению антиагрегантной терапии у пациентов с COVID-19 на разных этапах оказания медицинской помощи. Ожидается, что по мере накопления клинических данных и доказательной базы рекомендации приобретут больший уровень достоверности.
По итогам заседания эксперты пришли к следующим выводам:
1. У пациентов с имеющимися ССЗ, определяющими показания к приему АСК, следует рассмотреть возможность продолжения приема препарата во время коронавирусной инфекции и после перенесенного заболевания. При этом необходимо мотивировать к приему АСК пациентов, которые перенесли инфекцию и по каким-то причинам не получают этот антиагрегант.
2. У пациентов с развившимся ССЗ во время коронавирусной инфекции следует руководствоваться актуальными рекомендациями научных сообществ (Клинические рекомендации «Стабильная ишемическая болезнь сердца», 2020; «Острый коронарный синдром без подъема сегмента ST электрокардиограммы», 2020; «Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы», 2020). При этом следует выбирать антитромботические стратегии с учетом повышенного ишемического и тромботического риска, а также межлекарственного взаимодействия. Необходимо рассматривать инфекционный процесс как дополнительный фактор риска сердечно-сосудистых осложнений.
3. У стационарных пациентов использование АСК на фоне коронавирусной инфекции способствует сокращению сроков госпитализации и летальности. Может быть рассмотрен вопрос о добавлении АСК к стандартной антикоагулянтной терапии у пациентов низкого риска геморрагических осложнений при отсутствии противопоказаний. Для решения этого вопроса целесообразно использование специальных шкал (например, HAS-BLED).
4. У амбулаторных пациентов, не получающих по той или иной причине антикоагулянты, возможно назначение АСК в минимально возможной дозе 75 мг с целью снижения риска осложнений и неблагоприятных исходов. Необходимо тщательно взвесить соотношение пользы терапии и возможного риска геморрагических осложнений.
5. У пациентов без ССЗ, перенесших коронавирусную инфекцию и не получающих АСК, следует пересмотреть основания к назначению препарата, принимая во внимание факт перенесенного инфекционного заболевания как дополнительный фактор сердечно-сосудистого риска. Для расчета глобального сердечно-сосудистого риска в этом случае рекомендовано пользоваться альтернативными сердечно-сосудистыми шкалами, учитывающими протромботический и провоспалительный статус пациента (например, Reynolds Score http://www.reynoldsriskscore.org/).
Таким образом, применение АСК у разных категорий пациентов во время и после новой коронавирусной инфекции COVID-19 нацелено на снижение риска развития кардиоваскулярных тромботических осложнений, повышение качества оказываемой медицинской помощи и снижение затрат на лечение.



