ВВЕДЕНИЕ
Легкие человека каждый день прокачивают через себя около 12 000 л воздуха, содержащего ≈100 млрд химических частиц и патогенов, защищаясь от их воздействия мощным «гидрогелем» и слизистым барьером [1]. Обычная слизь, или трахеобронхиальный секрет (ТБС), способна создавать защиту, жизненно важную для эпителия дыхательных путей. Именно слизь обеспечивает первую линию обороны мукозальной иммунной системы (врожденный иммунитет). Кроме того, улавливая вдыхаемые патогенные частицы, растворяя в себе опасные/вредные газы, она предотвращает адсорбцию, адгезию и инвазию патогенов в подлежащие ткани. Только захваченные слизью частицы и токсические вещества активно удаляются из дыхательных путей скоординированным биением реснитчатого эпителия (ресничек) – мукоцилиарным клиренсом (МЦК). Признается, что основными макромолекулярными защитными компонентами слизи являются О-связанные гликопротеины и респираторные муцины MUC5AC/MUC5B [2]. При этом их гиперсекреция служит основой продуктивного кашля, сопровождающего такие заболевания, как острый и хронический бронхит (ХБ), хроническая обструктивная болезнь легких (ХОБЛ), бронхиальная астма (БА), бронхоэктатическая болезнь легких [3]. Гиперсекреция является следствием гиперплазии/гипертрофии бокаловидных клеток и подслизистых желез. При этом хронический воспалительный процесс приводит к ремоделированию бронха (утрачивается его структура), потере ресничкой двигательной функции, разрушению поверхностно-активного слоя (сурфактанта), изменению нормальных свойств слизи. Важно помнить, что побочные продукты воспаления, а именно нейтрофильная ДНК, нитчатый актин (F-актин), апоптозные клетки, бактерии, остатки клеточной стенки формируют другую «патологическую» слизь, получившую название «мокрота» [4].
Выбор препарата, модифицирующего продукцию, состав, реологию секрета, – важная и подчас вполне реальная «клиническая головоломка» из-за отсутствия у практикующего специалиста четких представлений о механизмах нарушений МЦК и алгоритмах мукоактивной терапии [5]. В настоящем обзоре нами приводится краткое изложение знаний о секрете, мокроте, муцинах, механизмах защиты бронхолегочной системы, а также доказательства уникальных свойств карбоцистеина – мукорегулятора с широким терапевтическим окном возможностей в лечении хронических легочных заболеваний с секреторной гиперреактивностью.
ТРАХЕОБРОНХИАЛЬНЫЙ СЕКРЕТ: ЗАЩИТА ДЫХАТЕЛЬНЫХ ПУТЕЙ
ТБС играет жизненно важную роль в защите дыхательных путей от химических, микробиологических и опасных физических факторов. Всю бронхолегочную систему человека возможно разделить на две зоны: верхние дыхательные пути (ВДП) и нижние дыхательные пути (НДП). ВДП включают нос, глотку и гортань, которые расположены за пределами грудной клетки, тогда как НДП состоят из трахеи, легких и всех сегментов бронхиального дерева (в том числе альвеол), расположенных внутри грудной клетки (рис. 1) [6].
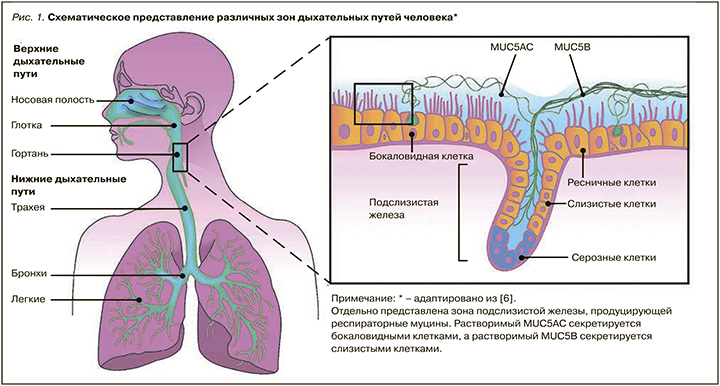
Дыхательные пути выстланы «псевдостратифицированным столбчатым эпителием» (т.е. образованным одним слоем клеток, создающих впечатление многослойности, особенно если смотреть в поперечном сечении), состоящим из трех типов клеток: реснитчатых, бокаловидных и базальных (слизистых и серозных) [6]. Линией первой защиты от проникновения патогенов в низлежащие эпителиальные клетки выступает «растворимая слизь» (гидрофильная), продуцируемая бокаловидными клетками. Она служит неотъемлемой частью врожденной МАЛТ-системы (мукозо-ассоциированной лимфоидной ткани), которая препятствует адсорбции (приближению), адгезии (прикреплению) и инвазии (проникновению) патогенов, и получила название МЦК. Мукоцилиарная очистка требует скоординированных и гармоничных действий секреторных клеток (продукция слизи, ее вязкость/упругость) и подвижных ресничек. Только содружественное их функционирование обеспечит дренаж секрета по бронхиальному дереву [6, 7]. Благодаря этому слизь постоянно обновляется и движется изнутри кнаружи. Например, слизь ВДП обновляется каждые 10 мин и движется кнаружи со скоростью ≈10 мм/мин, в то время как для секрета НДП аналогичные показатели составляют 120 мин (2 ч) и ≈4 мм/мин. Кроме того, контакт слизи с поверхностью реснитчатой клетки, совершающей 15–16 колебаний в секунду, не превышает 0,1 с, что препятствует бактериальной адгезии и инвазии (эффект скольжения). Важно помнить, что гармонизация работы МЦК – важная клиническая стратегия защиты легочного аппарата от респираторных патогенов [1].
МУЦИНЫ КАК ОСНОВНЫЕ КОМПОНЕНТЫ СЛИЗИ
Основным компонентом нормальной слизи служат высокомолекулярные муцины (HMW, от англ. high-molecular-weight). В настоящее время известно 22 гена, ответственных за синтез респираторных муцинов. Основными муцинами являются: 1) растворимые муцины бокаловидных клеток (MUC5AC и MUC5B); 2) трансмембранные муцины эпителиальных клеток (MUC1, MUC4, MUC16), способные подавляться респираторными патогенами (бактериальными/вирусными) на всем протяжении дыхательных путей. Специальный слой О-гликановых структур из трансмембранных муцинов, притягивающих воду, получил название «перицилиарного жидкого слоя»; он жизненно необходим для правильного функционирования реснички по продвижению слизи из дыхательных путей. Сверх него расположен вязкоупругий слизистый гель, состоящий из муцинов (рис. 2) [8].
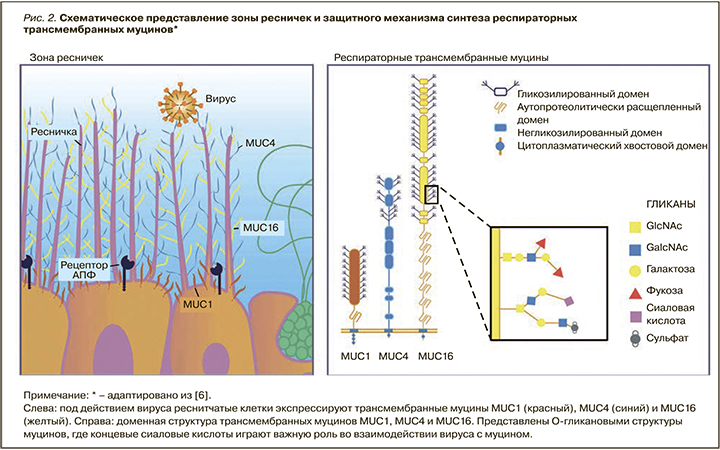
Важно знать, что трансмембранные муцины содержат высоко гликозилированные области с тандемными повторами (VNTR, от англ. variable-number tandem repeat), богатые пролином, треонином и серином (PTS, от англ. proline, threonine, serine), которые позволяют присоединять к себе сложные углеводные структуры, включающие N-ацетилгалактозамин (GalNAc), N-ацетилглюкозамин (GlcNAc), фукозу, галактозу, сиаловую кислоту и маннозу. Таким образом, присоединенные структуры (О-гликаны) составят ≈80% молекулярной массы конечных муцинов (гликолизированных муцинов). После добавления GalNAc к остатку серина или треонина образуются структуры антигена GalNAc-O-SER/THR или Tn (см. рис. 2), препятствующие бактериальной адгезии (антибактериальные копья). Однако если сиалил-трансферазы и фукозил-трансферазы прекращают удлинение и разветвление цепей, то возможно образование абнормальных респираторных муцинов с «заряженными концами», либо с гидрофильными остатками сиаловой кислоты, либо с гидрофобными остатками фукозы. Все это становится «идеальной зоной» для адсорбции и адгезии большинства микробных патогенов. Несомненно, что основные функции респираторных муцинов (MUC1, MUC4, MUC16) и нормальное их О-гликозилирование существенно изменены при обструкции и хроническом течении респираторного заболевания; так возникает предпосылка для колонизации НДП бактериями и вирусами (микробные биопленки). Вот почему нормализация синтеза и баланса муцинов разного типа (мукорегуляция) современными муколитиками – важная практическая задача [9].
Респираторные муцины MUC5AC и MUC5B (рис. 3) играют различные роли в поддержании «здоровья» дыхательного эпителия. Так, MUC5B является основным для здоровых лиц. Он секретируется в виде больших сгустков/«пучков» слизистыми клетками трахеобронхиальных желез (ТБЖ) путем специальной внутриклеточной упаковки муцина [10]. У здоровых лиц преобладает «хорошо заряженная копьями» сиалированная форма MUC5B (гидрофильный сиаломуцин) [11]. Наоборот, MUC5AC синтезируется преимущественно в НДП при действии микробных агентов и воспалительных цитокинов [12]. Белковые основы MUC5AC и MUC5B имеют сходные доменные структуры и гликаны. Однако присоединение фукозы (фукозилирование) к MUC5AC происходит интенсивнее, что делает его крайне устойчивым к воде и крайне вязким (гидрофобный фукомуцин). Это существенно снижает эффективность МЦК и становится причиной «застоя слизи» в условиях хронического воспалительного процесса. Восстановление синтеза нормальных по вязкости и гидрофобности муцинов муколитическими агентами позволяет восстанавливать защиту дыхательных путей и МЦК [8].
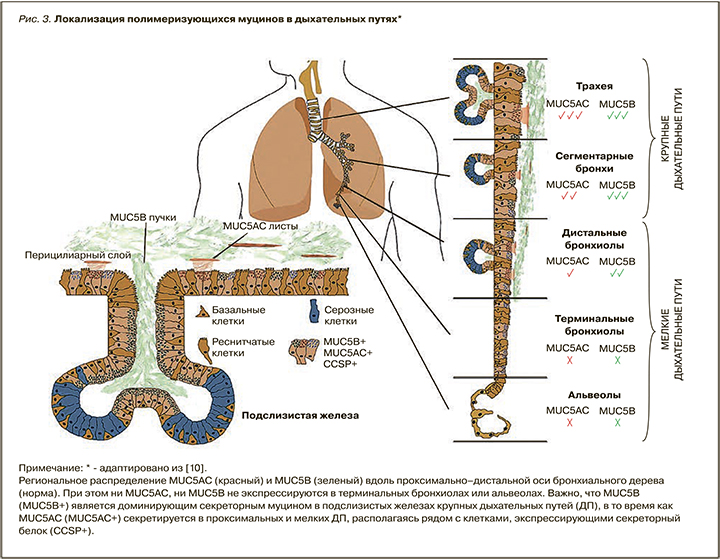
ИЗМЕНЕНИЕ МУЦИНОВОГО ИНТЕРФЕЙСА ПРИ ВОСПАЛЕНИИ
Взаимодействие муцинов при различных заболеваниях носит название «муциновый интерфейс». Например, экспрессия растворимых и трансмембранных муцинов резко снижает их гликозилирование, что усиливает защитные свойства слизистой оболочки [6].
Чтобы воздействовать на «муциновый интерфейс», важно понимать его модификацию при респираторных заболеваниях. Так, липополисахарид Pseudomonas aeruginosa (синегнойной палочки) и Haemophilus influenzae (гемофильной палочки) активно препятствуют гликозилированию и сульфатированию MUC5AC, приводя к резкому повышению вязкости и гидрофобности слизи [7]. Защитой от этого служит активность нейтрофильной эластазы по усилению экспрессии MUC4, позволяющая восстанавливать эпителий [1]. Здесь важны цитокиновый Th2-ответ (интерлейкины -4, -9, -13) и продукция фактора некроза опухоли альфа (ФНО-α), усиливающие сиалирование и отрицательный заряд муцинов; это подавляет катионный белок и воспаление бронха в целом [13]. Однако, если воспалительная реакция будет продолжаться, произойдет фукозилирование не только MUC5AC, но и MUC5B, что драматически изменит вязкость и полностью парализует МЦК. Такая экспрессия фукозил-трансфераз и их продуктов наблюдается при остром бронхите, ХБ, ХОБЛ и БА [11].
МУКОРЕГУЛЯТОРЫ: КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ
Препараты, активно регулирующие секрецию и/ или управляющие сетью ДНК/F-актин, получили название «регуляторные агенты», или «мукорегуляторы». К ним относят карбоцистеин, антихолинергические препараты, глюкокортикоиды [14]. В связи с очевидным неоспоримым преимуществом клинически полезных качеств карбоцистеина это лекарственное средство будет рассмотрен нами подробнее.
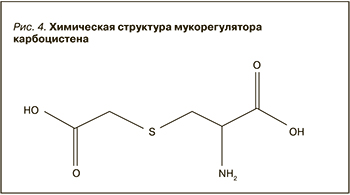
Карбоцистеин (S-карбокси-метил-цистеин – рис. 4) является мукоактивным препаратом с выраженным мукорегуляторным, антиоксидантным и противовоспалительным действием [15]. Впервые он был синтезирован в 1930-х гг. и стал доступен для использования в качестве мукорегулятора при респираторных заболеваниях в 1960-х гг. В настоящее время в России зарегистрирован карбоцистеин под торговым наименованием Касцебене (ООО «Алколоид Рус»), соответствующий российскому и европейскому стандарту качества GMP. Разнообразные клинические исследования убедительно продемонстрировали способность карбоцистеина повышать синтез сиаломуцинов – важных структурных компонентов нормальной слизи. По сути карбоцистеин восстанавливает гармонию и баланс между сиаломуцинами и фукомуцинами посредством повышения внутриклеточной активности сиалил-трансферазы, нормализующей вязкоупругие свойства слизи [16].
Важно, что в отличие от «истинных тиолов», таких как N-ацетилцистеин или N-ацистелин, карбоцистеин не оказывает «прямого» воздействия на ТБС. Это связано с более безопасной и «закрытой сульфидной группой», способной активировать сиаловую трансферазу – фермент бокаловидных клеток слизистой оболочки бронхов. Карбоцистеин нормализует количественное соотношение гидрофильных и гидрофобных муцинов бронхиального секрета. Он воздействует на гидрофобные муцины, разрывая дисульфидные связи гликопротеинов, что приводит к разжижению патологически вязкого секрета. При этом не происходит увеличения количества секрета, вследствии чего применение карбоцистеина является предпочтительным. Кроме того, мукорегуляторный эффект карбоцистеина обусловлен нормализацией секреторной функции железистых клеток, регенерацией слизистой оболочки, редукцией количества бокаловидных клеток в терминальных бронхах. Именно под действием карбоцистеина уменьшается выработка слизи, активизируется деятельность реснитчатого эпителия, что ускоряет МКЦ и способствует более быстрому купированию воспаления [17].
Карбоцистеин обладает прямой (кинин-ингибирующей) и непрямой (посредством восстановления капиллярной перфузии и микроциркуляции) противовоспалительной активностью. В клинических исследованиях у пациентов с ХОБЛ препарат существенно уменьшал инфильтрацию нейтрофилов в просвет дыхательных путей [18], снижал уровни цитокинов, интерлейкина-8 (ИЛ-8), ИЛ-6 и 8-изопростана в выдыхаемом воздухе [19]. Известно, что рекрутирование мононуклеарных клеток периферической крови в легкие с помощью ИЛ-8 играет решающую роль в развитии и поддержании воспаления при ХОБЛ. Карбоцистеин достоверно снижал продукцию ИЛ-8 вызывая значимый положительный эффект [15].
Также карбоцистеин демонстрировал в исследованиях защитные свойствами при оксидативном стрессе, а именно поглощал активные формы кислорода. В результате сравнительной оценки различных методов отхаркивающей терапии у больных с БА установлено, что после курса карбоцистеина кашлевой порог, по данным функционального теста с капсаицином, имел достоверно более высокий уровень, чем после лечения амброксолом или плацебо [20].
Карбоцистеин ингибирует адгезию патогенных бактерий к эпителию дыхательных путей, чем способствует снижению бактериальной колонизации респираторного тракта. Он изменяет поверхностную структуру Streptococcus pneumoniae, затрудняя фиксацию возбудителя на клетках респираторного эпителия [21]. В ходе одного из исследований было выявлено, что под влиянием карбоцистеина происходит уменьшение адгезивных свойств эпителия ВДП и снижается количество захваченных клетками возбудителей. По мнению авторов, это способствует уменьшению частоты респираторных инфекций [22]. Кроме того, при одновременном применении карбоцистеина и амоксициллина в момент тяжелых обострений ХБ и ХОБЛ содержание антибиотика в бронхиальном секрете повышалось в 2,5 раза с развитием «стерильности» от бактерий к пятому дню терапии [23].
Карбоцистеин предотвращает развитие риновирусной инфекции путем ее ингибирования в эпителиальных клетках трахеи человека. Он оказывает влияние на воспалительный процесс в респираторном тракте при вирусной инфекции через снижение выработки ИЛ-6, ИЛ-8, растворимых форм молекул межклеточной адгезии (ICAM-1) [24]. Кроме того, имеются данные об устойчивом повышении уровней секреторного IgA на фоне приема карбоцистеина, сохраняющемся длительное время после окончания лечения (протективное действие) [25].
Интерес представляет рандомизированное двойное слепое плацебо-контролируемое исследование PEACE длительностью 12 мес по оценке влияния карбоцистеина на частоту обострений ХОБЛ среди 709 пациентов из 22 центров в Китае, рандомизированных для приема карбоцистеина (1500 мг/ сут) или плацебо. Первичной конечной точкой служила частота обострений за год с выполнением анализа «по намерению лечить». Было установлено значительное снижение числа обострений на 1 пациента/год в группе карбоцистеина по сравнению с плацебо (1,01 (SE 0,06) против 1,35 (SE 0,06); отношение рисков 0,75: 95% ДИ: 0,62–0,92; р=0,004), при этом переносимость исследуемого препарата была хорошей [26].
Заслуживает внимания и метаанализ рандомизированных контролируемых исследований, выполненный Zeng Z. et al. (2017), по оценке эффектов длительного приема карбоцистеина (длительность 10,4 мес (6; 12) в дозе 1500 мг/сут) среди 1357 взрослых пациентов с ХОБЛ. В нем были получены следующие ключевые результаты: статистически значимое снижение частоты обострений в группе карбоцистеина по сравнению с группой плацебо (-0,43; 95% ДИ: от -0,57 до -0,29; p <0,00001); улучшение качества жизни в группе карбоцистеина по сравнению с плацебо (-6,29; 95% ДИ: от -9,30 до -3,27); уменьшение числа пациентов в группе карбоцистеина, имеющих хотя бы одно обострение/год (0,86; 95% ДИ: 0,78–0,95). Не было установлено достоверной разницы между группами в частоте госпитализации, показателях объема форсированного выдоха за одну секунду (ОФВ1), побочных эффектах. Это позволяет говорить о положительном влиянии длительного приема высоких доз карбоцистеина на частоту обострений и качество жизни пациентов с ХОБЛ [27].
Влияние длительного приема высоких доз карбоцистеина на частоту и продолжительность обострений пациентов с бронхоэктазами оценивалось также Minov J. et al. (2019) в наблюдательном «исследовании в реальной жизни» с группой контроля у 64 пациентов с бронхоэктазами, получавших и не получавших в дополнение к основной терапии по 2 капсулы карбоцистеина (375 мг) 3 раза/сут в течении 3 мес. Было обнаружено статистически значимое снижение числа обострений в группе карбоцистеина по сравнению с контролем (0,5+/-0,1 против 0,8+/-0,2; p=0,0001) при хорошей переносимости в обеих группах терапии карбоцистеином в высоких дозах [28].
ЗАКЛЮЧЕНИЕ
ТБС играет жизненно важную роль в защите дыхательных путей от химических, микробиологических и опасных физических факторов окружающей среды. Респираторные муцины, являясь сложными гликопротеинами и базисными структурными компонентами слизи, действуют не только как механический барьер, но и ключевой трансмиттер клеточных сигналов. Понимание этого, а также специфических взаимодействий патогенов с респираторными муцинами позволяет практикующему специалисту избежать ошибок в выборе стратегии муколитической таргетной терапии. Выбор карбоцистеина как уникального мукорегулятора, обладающего выраженной муколитической, антиоксидантной, противовоспалительной активностью, способностью повышать концентрацию респираторных антибиотиков в бронхиальном секрете, а также проявляющего протективное действие в отношении вирусной инфекции, открывает реальную клиническую возможность эффективной терапии пациентов с обструктивными легочными заболеваниями и секреторной гиперреактивностью, что является важной задачей современной прецизионной медицины.



