ВВЕДЕНИЕ
Остеоартрит (ОА) в последние десятилетия является одной из ведущих проблем медицины как в нашей стране, так и за рубежом в силу своей высокой распространенности и социальной значимости, приводящей к инвалидизации и сокращению продолжительности жизни населения. По статистическим данным Минздрава России, в 2017 г. численность пациентов с ОА составила более 4,3 млн человек при устойчивой тенденции ежегодного прироста новых случаев заболевания [1]. Однако эти данные существенно ниже, чем реальное количество больных, поскольку учитывают только выявленные и зарегистрированные случаи заболевания. Так, результаты масштабного российского эпидемиологического исследования свидетельствуют, что ОА коленных и(или) тазобедренных суставов выявляется у 13% взрослого населения. Таким образом, истинная численность пациентов с ОА в нашей стране может достигать 14–16 млн человек [2]. Согласно оценке глобального исследования бремени болезней за 2019 г., ОА выявляется у 7% населения земного шара, что превышает 500 млн человек; при этом прогнозируется рост числа больных за счет увеличения продолжительности жизни и количества пациентов с избыточной массой тела [3].
ОА оказывает существенную финансовую нагрузку на общество в целом как за счет инвалидизации пациентов, так и повышенной смертности. Недавно опубликованный обзор метаанализов (2020) еще раз подтвердил, что при ОА, независимо от локализации поражения, значимо увеличивается коэффициент риска (КР) как общей летальности (КР 1,18=1,23), так и смертности, связанной с кардиоваскулярными катастрофами (КР 1,21=1,53) [4]. К основным причинам, объясняющим развитие таких осложнений, относятся хронический болевой синдром, гиподинамия, высокая коморбидность, метаболические и психоэмоциональные нарушения, а также персистирование низкоинтенсивного воспаления, лежащего в основе патогенеза ОА [5].
За последние десятилетия представления об ОА претерпели значительную эволюцию – от дегенеративного процесса до «воспалительной» болезни, где центральная роль принадлежит низкоинтенсивному воспалению (low-grade inflammation). В 2015 г. Международное общество по изучению ОА (Osteoarthritis Research Society International, OARSI) представило новое определение этой болезни: «ОА – заболевание суставов, характеризующееся клеточным стрессом и деградацией экстрацеллюлярного матрикса, возникающими при макро- или микроповреждениях, которые активируют ненормальные адаптивные восстановительные процессы, включая провоспалительные пути иммунной системы». На первых этапах изменения происходят на молекулярном уровне (нарушение метаболизма тканей сустава) с последующими анатомическими и физиологическими нарушениями (деградация хряща, костное ремоделирование, образование остеофитов, воспаление и т.д.) [6]. Новое понимание патогенеза способствовало тому, что в настоящее время инициировано большое количество исследований, изучающих перспективные молекулы и лекарственные препараты, которые потенциально способны модифицировать течение ОА, а возможно, и оказывать протективный эффект.
На современном этапе лечение ОА направлено не только на купирование/уменьшение болевого синдрома, но и на улучшение функционального состояния суставов, физической, профессиональной и социальной активности пациента, а также на замедление прогрессирования заболевания с помощью комплексного воздействия нефармакологических и фармакологических методов. К сожалению, рекомендованные методы ведения пациентов с ОА не всегда в полной мере используются в клинической практике. Это может быть обусловлено, с одной стороны, гетерогенностью заболевания (множество фенотипов), а с другой – наличием большого числа руководств по его лечению как в России, так и за рубежом, которые зачастую противоречат друг другу, не учитывая при этом ряд важных факторов [7].
Важно отметить, что ОА – это мульдисциплинарная проблема, и ведение пациентов с этим заболеванием осуществляют различные специалисты: терапевты, ревматологи, травматологи-ортопеды, врачи общей практики, реабилитологи и др. В нашей стране в сентябре 2021 г. были утверждены клинические рекомендации Минздрава России по диагностике и лечению остеоартрита коленных и тазобедренных суставов, в создании которых принимали участие специалисты трех ассоциаций: травматологи-ортопеды, ревматологи и реабилитологи. С 01.01.2023 лечебные учреждения обязаны обеспечить оказание медицинской помощи согласно данным рекомендациям, а также создать условия, гарантирующие соответствие оказываемой помощи критериям оценки качества (п. 2.1 ч. 1 ст. 79 Закона № 323-ФЗ, письмо Минздрава России от 20.05.2021 № 17-4/И/1-7530). Однако в этих рекомендациях больше внимания уделено различным хирургическим пособиям и значительно меньше – консервативным методам терапии, хотя и представлены основные группы лекарственных препаратов, которые применяются в настоящее время. Вместе с этим остаются вопросы о последовательности назначения таких препаратов, основным показаниям и противопоказаниям к их использованию и др. Также в представленных рекомендациях не сформулирована позиция насчет генерализованной формы ОА (вовлечение 3 и более групп суставов, в том числе мелких суставов кистей и стоп), с которой чаще всего встречаются врачи в реальной клинической практике.
В связи с этим мы разработали пошаговый алгоритм лечения пациентов с ОА, который состоит из четырех последовательных этапов и включает нефармакологические, фармакологические и хирургические методы, а также предполагает возможность совместного ведения одного пациента врачами различных специальностей. Важно отметить, что он согласуется с рекомендациями Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартрита 2019 г. (European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases, ESCEO) по лечению ОА коленного сустава [8]. В то же время в этом алгоритме имеются незначительные отличия от указанных рекомендаций, которые позволяют использовать его при лечении пациентов с ОА любой локализации (рис.).
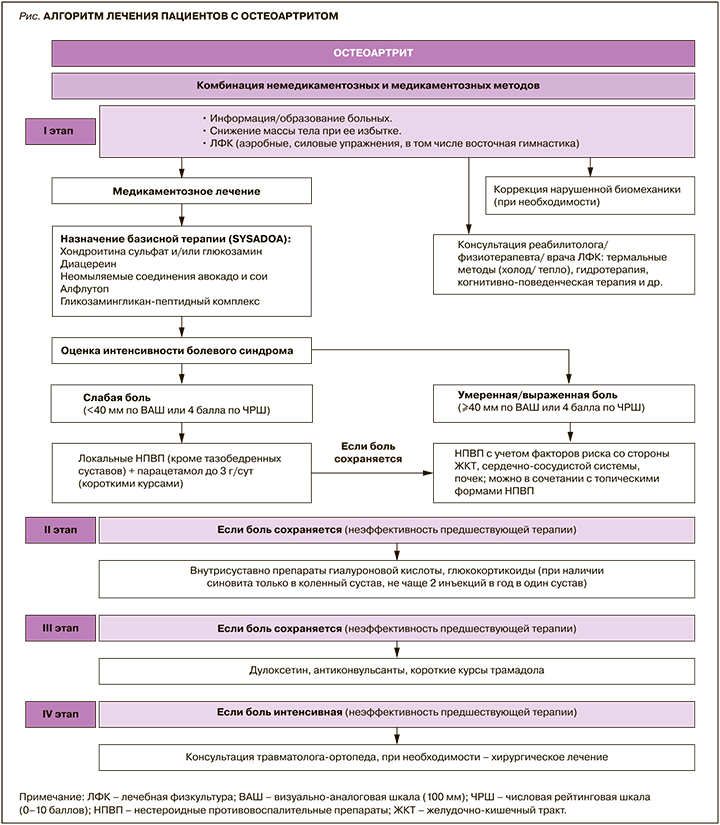
В данном алгоритме еще раз подчеркивается необходимость назначения комбинации фармакологических и нефармакологических методов лечения сразу же после установления диагноза ОА. Так, обязательным компонентом всех терапевтических программ является образование пациентов, которое должно проводиться с учетом индивидуальных особенностей больного и включать информацию о заболевании, рекомендации по изменению образа жизни, снижению массы тела и необходимости выполнения физических упражнений. Основной целью программ обучения служит повышение эффективности проводимой терапии путем активного вовлечения пациента в лечебный процесс. Такие программы должны быть организованы на постоянной основе с привлечением волонтерского движения. В частности, действующая в настоящее время Всероссийская социально-профилактическая программа «Здоровье суставов в надежных руках», разработанная при поддержке Научно-исследовательского института ревматологии (НИИР) им. В.А. Насоновой, Ассоциации ревматологов России, Российского научного медицинского общества терапевтов и компании «Биотехнос» с участием волонтерских организаций, способствует не только образованию пациентов (а это положительно сказывается на симптомах заболевания, функции суставов и качестве жизни), но и повышению их комплаентности как в плане повышения физической активности, так и приема лекарственных препаратов.
Пациента с ОА надо убедить регулярно заниматься лечебной физкультурой (ЛФК), поскольку получены данные, что упражнения в воде, силовые тренировки для нижних конечностей, тренировка четырехглавой мышцы бедра, аэробные упражнения и другое приводят к снижению выраженности болей в суставах [9]. Действительно, ЛФК, включая восточные виды гимнастики, имеет серьезную доказательную базу и единогласно рекомендована различными сообществами по лечению ОА [10– 13].
Снижение веса – довольно эффективный, но часто трудно достижимый в реальной жизни метод лечения ОА. Пациентам с избыточным весом (индекс массы тела более 25 кг/м2) рекомендуется уменьшение массы тела не менее чем на 10% за год. В последних опубликованных систематических метаанализах было показано, что снижение веса, особенно в сочетании с ЛФК, приводит к уменьшению боли, улучшению функционального состояния суставов, позитивно влияет на структурные изменения в хряще и биохимические маркеры обмена хряща и кости. Недавние результаты крупномасштабного исследования убедительно продемонстрировали, что потеря веса на 1% снижает риски тотального эндопротезирования коленного сустава на 2% [14].
I ЭТАП ЛЕЧЕНИЯ
I этап лечения ОА – самый масштабный, предполагающий ведение пациентов врачами различных специальностей (в частности, врачом по физической и реабилитационной медицине, физиотерапевтом и др.), что дает возможность оптимизировать процессы диагностики и терапии. Так, с первых шагов при отсутствии противопоказаний рекомендовано проведение физиотерапевтического лечения. При этом выбор того или иного метода физиотерапии должен носить индивидуализированный характер с учетом показаний и противопоказаний (например, при наличии признаков воспаления в суставе предпочтительнее проведение криотерапии и т.д.).
При первичном обращении пациента в медицинское учреждение необходимо оценить, есть ли у него нарушения биомеханики сустава (варусная или вальгусная деформация, плоскостопие и др.), и при необходимости скорректировать их с помощью ортезов, супинаторов: это приводит к уменьшению боли, снижению функциональной недостаточности и скорости прогрессирования заболевания. Кроме того, для разгрузки суставов при продвинутых стадиях ОА рекомендуется хождение с тростью в руке, противоположной пораженной конечности, использование костылей или других вспомогательных приспособлений.
Основу медикаментозного лечения ОА составляет применение симптоматических препаратов замедленного действия (SYSADOA). Эта группа лекарственных средств довольно обширна: она включает хондроитина сульфат (ХС), глюкозамина (ГА) сульфат/гидрохлорид и их комбинации, диацереин, неомыляемые соединения авокадо и сои, различные инъекционные препараты комплексного состава – Алфлутоп, гликозамингликан-пептидный комплекс и др. В настоящее время имеется серьезная доказательная база, основанная на серии метаанализов и систематических обзоров, подтверждающая хороший терапевтический потенциал таких средств. SYSADOA обладают не только обезболивающим и противовоспалительным эффектами, но и способны замедлять прогрессирование заболевания. В опубликованном в июле 2021 г. большом систематическом обзоре и метаанализе (28 рандомизированных контролируемых исследований, n=11 890) еще раз было продемонстрировано, что ГА и ХС обладают структурно-модифицирующим действием: так, стандартизированная разница средних (SMD, standardised mean difference) для ГА была равна 0,16 (95% доверительный интервал (ДИ): 0,04–0,28), а для ХС = 0,21 (95% ДИ: 0,1–0,32) [15].
Важное преимущество SYSADOA заключается в возможности на фоне их приема снижения дозы или полной отмены нестероидных противовоспалительных препаратов (НПВП), что приводит к уменьшению частоты неблагоприятных явлений (НЯ), связанных с использованием этого класса лекарственных средств. В начале терапии для повышения биодоступности и достижения более быстрого анальгетического эффекта препараты из группы SYSADOA могут назначаться парентерально в виде внутримышечных инъекций.
К таким лекарственным средствам относится хорошо зарекомендовавший себя среди медицинского сообщества и пациентов препарат Алфлутоп® (биоактивный концентрат мелкой морской рыбы), который уже более 25 лет уверенно занимает одну из лидирующих позиций среди инъекционных форм SYSADOA в нашей стране. Показанием для его назначения является ОА различной локализации. В настоящее время существует убедительная доказательная база (результаты, полученные в серии клинических исследований) в отношении его эффективности и безопасности. Так, в 15 исследованиях (более 1200 пациентов), посвященных ОА коленных суставов, уже после первого курса лечения препарата отмечалось значимое уменьшение болевого синдрома (от 25 до 58,6%, в среднем 43,1%) по визуальной аналоговой шкале (ВАШ) и индексу WOMAC (Western Ontario and McMaster Universities Osteoarthritis Index), оценивающему состояние больных ОА [16]. Важно, что большая часть работ была выполнена на высоком методическом уровне (плацебо-контролируемые исследования, наличие контрольных групп, длительное наблюдение, использование современных инструментальных методов, в частности магнитно-резонансной томографии, Т2-картирования и др.). В частности, симптоматический и противовоспалительный эффекты Алфлутопа® были подтверждены в двухлетнем многоцентровом двойном слепом плацебо-контролируемом исследовании (n=90), проведенном в НИИР им. В.А. Насоновой [17]. В нем было установлено статистически значимое улучшение как отдельных показателей индекса WOMAC (боли, скованности и функциональной недостаточности), так и суммарного показателя. Хороший клинический потенциал препарата был подтвержден и по критерию OMERACT-OARSI – лечение оказалось эффективным у 73% пациентов, получавших Алфлутоп®, и у 40% – плацебо (р=0,001). Кроме того, в группе основного лечения все пациенты снизили дозу или вовсе прекратили применение НПВП. Однако основной ценностью этой работы стало подтверждение структурно-модифицирующего действия препарата: на фоне терапии в 1,5 раза снижался риск прогрессирования ОА (сужение суставной щели или появление/увеличение в размерах остеофитов) коленных суставов (относительный риск (OP) =1,5; 95% ДИ: 1,17–1,99; р <0,003) [18].
В ряде работ отечественных авторов также были получены результаты, свидетельствующие о том, что препарат Алфлутоп® способствует замедлению прогрессирования заболевания; наряду с прочим это доказано при помощи магнитно-резонансной томографии с использованием методики цветового Т2-картирования и измерения времени Т2-релаксации [19].
Во всех представленных работах отмечен хороший профиль безопасности у препарата, нежелательные явления развивались в единичных случаях (в основном местные постинъекционные реакции). Хорошая переносимость и безопасность Алфлутопа® позволяют применять его в том числе у пациентов с высокой коморбидностью. Недавно были опубликованы результаты многоцентрового проспективного исследования (n=130) по оценке эффективности и безопасности Алфлутопа® в альтернирующем режиме (по 2 мл внутримышечно через день № 10) по сравнению со стандартным его введением (по 1 мл внутримышечно ежедневно № 20) у пациентов с ОА и наличием коморбидности (дислипидемия, и/или артериальная гипертензия, и/или сахарный диабет 2-го типа) [20]. Было установлено, что альтернирующая схема обеспечивает такой же терапевтический эффект, как и стандартное применение. В обеих группах лечения выявлено значимое уменьшение интенсивности болевого синдрома, улучшение функции коленных суставов и качества жизни. Кроме этого, еще раз подтверждена безопасность препарата, не обнаружено его отрицательного влияния на течение коморбидных заболеваний. При этом альтернирующий режим применения Алфлутопа® способствовал повышению комлаентности пациентов [21].
Врачу при определении дальнейшей тактики лечения ОА необходимо оценить интенсивность болевого синдрома в наиболее болезненном суставе. Если боль незначительна (40 мм и менее по ВАШ), то назначаются локальные формы НПВП (допустимо в сочетании с парацетамолом). У больных с умеренной или сильной болью в суставах целесообразно назначение системных НПВП (при отсутствии противопоказаний), которые используются одновременно с SYSADOA и топическими НПВП.
Локальные формы НПВП обладают хорошим обезболивающим эффектом. В частности, в систематическом обзоре и метаанализе 2021 г. были представлены данные, что НПВП для местного использования при ОА коленного сустава по сравнению с плацебо имеют значимое превосходство по анальгетическому действию (SMD = 0,365; 95% ДИ: 0,24–0,49) и способствуют улучшению функциональной способности (SMD = 0,354; 95% ДИ: 0,268–0,493) [22]. При этом авторы отметили, что наибольшая доказательная база имеется у локальных форм диклофенака и кетопрофена. Данные средства следует применять длительностью до 2 нед с кратностью не менее 4 раза/сут. Необходимо выполнять рекомендации по дозировке локальных средств: до 10 см мази/геля на крупные суставы (плечевые, коленные), до 5 см – на средние (голеностопные, локтевые, лучезапястные) и до 2–3 см – на мелкие (суставы кистей и стоп).
Локальные формы НПВП благодаря низкой системной абсорбции характеризуются высоким профилем безопасности. Они не увеличивают риск развития класс-специфических нежелательных явлений со стороны желудочно-кишечного тракта (ЖКТ), сердечно-сосудистой системы и почек, что дает возможность назначать их пациентам с выраженной коморбидной патологией.
Парацетамол может назначаться пациентам со слабым болевым синдромом в комбинации с топическими формами НПВП, а также при наличии противопоказаний к применению системных НПВП, но не более 3 г/сут. Хотелось бы отметить, что в России этот анальгетик очень редко назначается при лечении ОА в отличие от США и многих странах Западной Европы, где он до недавнего времени считался препаратом «первой линии» для купирования боли при ОА и рассматривался как одно из безопасных лекарственных средств. Так, по данным масштабного исследования (Osteoarthritis Initiative), 80% пациентов с ОА хотя бы однократно принимали парацетамол в течение одного года [23]. Однако в последние годы стало увеличиваться количество информации, свидетельствующей о том, что препарат не имеет преимуществ перед плацебо. Представленные в 2017 г. в журнале Lancet результаты сетевого метаанализа свидетельствовали, что парацетамол в дозах 3900–4000 мг незначительно лучше плацебо (размер эффекта (ES) = -0,16; 95% ДИ: от -0,27 до -0,06) [24]. В связи с этим авторы высказали мнение, что монотерапия ОА парацетамолом не оправдана. Кроме того, появились данные, указывающие на высокую частоту развития НЯ со стороны сердечно-сосудистой системы, ЖКТ, печени и почек при его применении, особенно на фоне высоких суточных доз [25]. В 2019 г. Conaghan P.G. et al. представили обзор литературы, где подтвердились опасения по поводу профиля безопасности парацетамола, причем риски развития НЯ возрастали при увеличении дозы и длительности приема препарата [26]. Последний Кокрановский систематический обзор (10 плацебо-контролируемых рандомизированных контролируемых исследований, n=3541) не выявил увеличения риска НЯ, однако подтвердил незначительный симптоматический эффект парацетамола (абсолютное снижение боли на 3%; 95% ДИ: 1–5) [27].
Несмотря на эти данные, парацетамол до сих пор остается одним из самых часто назначаемых препаратов в Европе при лечении пациентов с ОА и по-прежнему включен во многие клинические рекомендации [28].
НПВП занимают центральное место в фармакотерапии болевого синдрома при ОА, обладая хорошим анальгетическим потенциалом [29]. Систематический обзор и метаанализ (2020), включавший 72 рандомизированных контролируемых исследований (n=26 424), еще раз продемонстрировал значимое обезболивающее действие у этих препаратов (SMD = -0,43; 95% ДИ: от -0,48 до -0,38), достигающее максимума к 10–14 дням лечения. Вместе с тем было обращено внимание на то, что эффективность НПВП снижается со временем. Идентичная закономерность была отмечена и при оценке функции суставов: максимальное улучшение функциональной способности выявлялось через 2 нед лечения (SMD = -0,45; 95% ДИ: от -0,52 до -0,38) со значительным снижением эффекта к 26 нед (SMD = -0,19; 95% ДИ: -0,32 до 0,07). Кроме того, авторы еще раз подтвердили, что применение НПВП ассоциируется с увеличением НЯ со стороны ЖКТ (ОР=1,36; 95% ДИ: 1,25–1,49) и сердечно-сосудистой системы (ОР=1,37; 95% ДИ: 1,05–1,77). Большинство желудочно-кишечных и сердечно-сосудистых НЯ было преходящим и легкой степени тяжести; наиболее часто развивалась диспепсия, диарея, периферические отеки и повышение артериального давления [30].
Таким образом, назначая НПВП, врач всегда должен учитывать наличие факторов риска НЯ (прежде всего коморбидной патологии) и выбирать препараты с наилучшим профилем безопасности. К сожалению, в рутинной клинической практике назначение НПВП сопряжено с рядом сложностей, в частности с отсутствием мониторинга НЯ и учета коморбидных состояний, неоправданно длительными курсами лечения, одновременным назначением пациенту различных препаратов этой группы, что приводит к значимому увеличению риска осложнений. На сегодняшний день при лечении пациентов с ОА целесообразно ограничивать прием НПВП не только в плане дозировки, но и длительности приема.
При выборе НПВП следует руководствоваться клиническими рекомендациями «Рациональное использование нестероидных противовоспалительных препаратов» [31], в которых представлен алгоритм назначения средств этого класса с учетом сопутствующей патологии. Кроме того, важно подчеркнуть следующие моменты:
- эффективность как селективных (сНПВП), так и неселективных НПВП (нсНПВП) сопоставима и зависит от дозы;
- применение инъекционных форм НПВП, а также быстрорастворимых препаратов для приема внутрь может иметь преимущество в скорости наступления обезболивающего эффекта по сравнению с пероральным приемом «обычных» форм препаратов;
- необходим дифференцированный подход к выбору НПВП в зависимости от наличия у пациента коморбидных заболеваний;
- при наличии у пациентов факторов риска развития НПВП-гастропатии необходимо сочетать использование сНПВП с ингибиторами протонной помпы;
- прием любых НПВП может вызывать острую почечную недостаточность, особенно в первый месяц лечения. Этот риск снижен у пациентов с нормальной функцией почек. Пациентам со скоростью клубочковой фильтрации менее 30 мл/мин прием НПВП не рекомендован;
- при наличии кардиоваскулярных заболеваний НПВП применяются в минимальной эффективной дозе на короткие сроки. НЯ со стороны сердечно-сосудистой системы свойственны всем препаратам этой группы. Риск их развития зависит от индивидуальных характеристик препарата и используемой дозы, но не селективности в отношении циклооксигеназы-2 (ЦОГ-2). Очень высокий риск кардиоваскулярных осложнений (инфаркт миокарда, острый коронарный синдром, ишемический инсульт, декомпенсированная хроническая недостаточность и др.), прием двойной-тройной антикоагулянтной терапии служат противопоказанием для назначения любых НПВП;
- при назначении НПВП необходимо учитывать возможность лекарственных взаимодействий. Не рекомендован одновременный прием НПВП из различных групп, так как в этом случае значимо повышается вероятность развития НЯ;
- решение о модификации НПВП-терапии рекомендуется принимать через 5–7 сут от начала лечения препаратами этого класса.
При противопоказаниях к применению НПВП или недостаточном ответе на проводившуюся ранее терапию (нефармакологические методы, SYSADOA, локальные и/или системные НПВП) необходимо перейти ко второму этапу терапии ОА.
II ЭТАП ЛЕЧЕНИЯ
II этап лечения ОА подразумевает добавление к проводимой терапии внутрисуставных введений препаратов гиалуроновой кислоты (ГиК) или глюкокортикоидов (ГК).
Препараты ГиК (производные гиалуроната) применяют при неэффективности предыдущих методов лечения и отсутствии синовита («сухой» сустав), в связи с чем целесообразно введение этих лекарственных препаратов под ультразвуковой навигацией или по крайней мере выполнение данного исследования перед этой процедурой. Во многих рандомизированных контролируемых исследованиях и метаанализах при ОА коленных и тазобедренных суставов доказано существенное превосходство ГиК над плацебо по влиянию на боль, функцию и общую оценку состояния пациента [36]. Показано, что использование производных гиалуроната имеет более благоприятный профиль безопасности, чем НПВП, и может служить альтернативой при лечении ОА, особенно у пожилых пациентов и у лиц с высокой коморбидностью. Результаты сравнительных исследований препаратов ГиК и ГК показывают примерно равную их эффективность через 4 нед после инъекции и достоверно больший эффект гиалуроната спустя 5–13 нед после курса терапии [32].
В то же время до сих пор остаются спорные моменты в оценке терапевтической ценности препаратов ГиК в зависимости от состава молекул, их молекулярного веса, количества курсов лечения, стадии ОА, индекса массы тела (ИМТ), физической активности пациентов и др. В частности, систематический анализ (2020) 14 исследований (n=2796) продемонстрировал преимущества высокомолекулярных ГиК (SMD = -0,57; 95% ДИ: от -1,04 до -0,11) над низкомолекулярными (SMD = -0,23; 95% ДИ: от -0,67 до 0,2) [37]. Метаанализ 30 работ показал, что один курс ГиК не имеет превосходства над плацебо, однако при последующих введениях (2–4 курса) выявлено значимое превосходство этой группы препаратов [38]. Похожие результаты были получены и в систематическом анализе Altman R. et al. [39]. Исследователи также отметили, что повторные внутрисуставные инъекции ГиК не только эффективны, но и безопасны.
В литературе имеется много работ, доказывающих, что на фоне применения ГиК уменьшается потребность в приеме НПВП, опиодов, а также в эндопротезировании суставов. Тем не менее нельзя не отметить и те факторы, которые могут снижать эффективность терапии: это продвинутая рентгенологическая стадия (чем выше стадия, тем ниже эффективность), высокий ИМТ, неправильная методика выполнения внутрисуставных инъекций, введение препарата не по показаниям (не в «сухой» сустав) и др.
ГК для внутрисуставного введения рекомендованы при наличии синовита и отсутствии ответа на предшествующую терапию при ОА коленных суставов. В случае ОА суставов кистей или тазобедренных суставов локальное применение ГК условно не рекомендовано. Данные разногласия связаны с тем, что существует ограниченное количество публикаций по эффективности и безопасности внутрисуставных введений ГК при этих локализациях заболевания.
ГК обладают большей эффективностью по сравнению с плацебо, однако их действие в основном кратковременно (2–4 нед). В Кокрановском обзоре 2015 г. (27 исследований, 1767 участников) подтверждено более значимое анальгетическое действие ГК при ОА коленных суставов, при этом наибольшая эффективность отмечена через 1–2 нед после инъекции (ES=0,48; 95% ДИ: 0,27–0,70). В дальнейшем наблюдалось постепенное снижение эффекта: через 4–6 нед ES составлял 0,41 (95% ДИ: 0,21–0,61), через 13 нед – 0,22 (95% ДИ: от 0,00–0,44) и через 26 нед – 0,07 (95% ДИ: 0,11–0,25) [32]. В 2020 г. опубликован систематический обзор и метаанализ эффективности ГК при ОА тазобедренных суставов, которые включали 5 краткосрочных исследований (n=346). Во всех работах через 3–4 нед после инъекции отмечено уменьшение боли по сравнению с контролем: через 1–2 нед SMD составлял -1,58 (95% ДИ: от -3,42 до 0,26; p=0,09), через 3–4 нед – -1,93 (95% ДИ: от -3,34 до -0,52; p=0,007) и к 8–12 нед – -1,77 (95% ДИ: от -2,94 до -0,61; p=0,003) [33].
В настоящее время для внутрисуставного применения одобрены следующие ГК: метилпреднизолона ацетат (20–80 мг), триамцинолона ацетат (10–40 мг), триамцинолона гексацетонид (10–20 мг), бетаметазона натрия фосфат/ацетат (0,25–2 мл) и гидрокортизона ацетат (10–25 мг). Не рекомендуется выполнять более 3 инъекций ГК в год в один и тот же сустав в связи с высоким риском развития остеонекроза и уменьшения объема хрящевой ткани. Проведение внутрисуставных инъекций показано под визуальным контролем (ультразвуковое исследование), что повышает терапевтическую эффективность и снижает риск развития НЯ [34, 35].
III ЭТАП ЛЕЧЕНИЯ
При сохранении выраженного болевого синдрома на фоне вышеуказанного лечения после детальной диагностики его характера (нейропатическая, ноципластическая боль) проводится коррекция терапии с назначением опиоидных анальгетиков (трамадол), антиконвульсантов или антидепрессантов (дулоксетин).
Трамадол возможно применять для купирования сильной боли в течение короткого периода времени при неэффективности предыдущих этапов лечения, а также невозможности назначения НПВП. В первые дни приема рекомендована доза 50 мг/сут с последующим ее увеличением при необходимости до 200–300 мг/сут.
В последние годы появилось много данных, которые значимо дискредитируют трамадол, свидетельствуя о его недостаточном анальгетическом действии и при этом высокой частоте развития НЯ. В Кокрановском обзоре 2019 г. (21 рандомизированное контролируемое исследование, 3871 участник) не отмечено значимого влияния трамадола или его комбинации с парацетамолом на болевой синдром при ОА коленных или тазобедренных суставов: абсолютное улучшение составляло всего 4% (95% ДИ: 3–5) [40]. В 2021 г. был опубликован систематический обзор и метаанализ 6 рандомизированных контролируемых исследований (n=3611), где продемонстрирован дозозависимый анальгетический эффект препарата: так, максимальное его обезболивающее действие отмечено при приеме 300 мг/ сут и снижение эффекта при назначении 200 и 100 мг/ сут. При этом одновременно с увеличением дозировки наблюдалось нарастание рисков развития НЯ, особенно со стороны ЖКТ и центральной нервной системы. В частности, ОР развития желудочно-кишечных осложнений для 100 мг/сут составил 2,29 (95% ДИ: 1,22–4,25), для 200 мг/ сут – 4,35 (95%ДИ: 2,31–8,01), для 300 мг/сут – 6,02 (95% ДИ: 3,22–11,1) [41].
Таким образом, учитывая взаимоотношение пользы и риска от применения трамадола, целесообразно назначать его только при неэффективности других анальгетических средств и на короткий период времени.
Антидепрессанты (дулоксетин) и антиконвульсанты могут быть альтернативой слабым опиоидам, в первую очередь у пациентов с признаками центральной сенситизации, депрессии и распространенной боли. Так, согласно данным ряда авторов, более чем у 30% пациентов с ОА выявляется центральная сенситизация, которая оказывает существенное влияние на интенсивность хронического болевого синдрома, а также увеличивает риск развития депрессии [42]. В связи с этим при ОА необходимо учитывать «окраску» болевого синдрома, и, если пациент предъявляет жалобы на онемение, жжение, покалывание, ползание мурашек, аллодинию и т.д., необходимо провести дополнительное обследование для исключения невропатической боли или центральной сенситизации и при необходимости рекомендовать консультацию невролога. В случае подтверждения диагноза таким пациентам возможно назначение препаратов центрального действия из группы антиконвульсантов. В ряде работ было показано, что включение антиконвульсанта прегабалина в комплексную терапию ОА вызывало более быстрое снижение выраженности болевого синдрома, а также улучшение функционального и эмоционального состояния пациентов [43].
Значимую роль в лечении хронического болевого синдрома при ОА играют и антидепрессанты. Дулоксетин, который относится к группе селективных ингибиторов обратного захвата серотонина и норадреналина, способствует также слабому подавлению захвата дофамина. Хороший терапевтический потенциал этого препарата подтвержден в ряде рандомизированных контролируемых исследований, в которых продемонстрировано улучшение функциональной способности у пациентов с ОА и превосходство дулоксетина над плацебо по анальгетическому действию. Систематический обзор и метаанализ 2021 г. (n=2059) еще раз показал значимый симптоматический эффект препарата по краткому опроснику боли (MD от -0,54 до -0,87). Кроме того, на фоне приема дулоксетина наблюдалось снижение скованности по WOMAC и улучшение функции по этому индексу. Вместе с тем авторы указывали на высокий уровень НЯ дулоксетина, среди которых превалировали тошнота, запоры, гипергидроз, кашель, миалгии, артралгии, тахикардия, сухость во рту и др. (ОР=1,31; 95% ДИ: 1,20–1,43; р <0,00001) [44].
Таким образом, дулоксетин и прегабалин могут быть альтернативой слабым опиоидам, в первую очередь у пациентов с хронической болью и признаками центральной сенситизации, однако их применение требует строгого врачебного контроля.
IV ЭТАП ЛЕЧЕНИЯ
При неэффективности предшествующей терапии ОА, прогрессировании болевого синдрома, наличии деформаций, приводящих к значительному нарушению функций сустава и снижению качества жизни, всем пациентам показана консультация ортопеда для решения вопроса о возможности и целесообразности проведения оперативного вмешательства на суставах.
ЗАКЛЮЧЕНИЕ
Таким образом, современная стратегия лечения ОА заключается в реализации мультидисциплинарного подхода и предполагает пошаговую схему назначения различных методов. Рациональное сочетание нефармакологических и медикаментозных средств позволяет во многих случаях не только стабилизировать течение заболевания, но и предотвращать быстрое его прогрессирование, а также способствует повышению качества и безопасности оказания медицинский помощи пациентам с ОА.



