1. ВВЕДЕНИЕ
Легочная эмболия (ЛЭ) занимает третье место в списке наиболее распространенных острых заболеваний сердечно-сосудистой системы, с заболеваемостью 100–200 случаев на 100 000 населения в год. Более того, в последние несколько лет заболеваемость ЛЭ растет во многих странах [1]. По оценкам, ЛЭ диагностируют у 1–2% госпитализированных пациентов [2].
Риск возникновения ЛЭ удваивается каждые 10 лет в возрастных группах старше 40 лет, хотя она встречается у пациентов всех категорий и любого возраста, являясь неотложным состоянием с потенциально летальным исходом [3]. Важную роль также играет связанная с перенесенной ЛЭ патология, в том числе хроническая тромбоэмболическая легочная гипертензия (ХТЭЛГ) [4].
В странах Европы от острой ЛЭ ежегодно умирает примерно 370 000 человек. До 90% смертей, обусловленных этим заболеванием, наступает в течение первых двух часов от момента появления симптомов [5]. На основании анализа данных регистра ВОЗ (2000–2015 гг.) в странах Восточной, Западной, Северной и Южной Европы, а также Центральной Азии ЛЭ была отнесена к числу главных причин смерти по МКБ-10 [6].
В последние 20 лет были проведены исследования, которые изменили тактику ведения пациентов с острой ЛЭ с позиций ее диагностики и лечения. Значимость этих исследований была подтверждена международными сообществами, которые приняли обновленные клинические рекомендации (КР) по ведению таких пациентов.
Интеграция полученных данных в ежедневную клиническую практику является сложной задачей для врачей, которые часто имеют дело с пожилыми коморбидными пациентами. Это обстоятельство затрудняет принятие решений по вопросам диагностики и лечения.
Целью настоящего документа стала адаптация рекомендаций из существующих КР для помощи практическим врачам в принятии решений, связанных со сложными и специфическими ситуациями при ЛЭ. Последовательность процедуры адаптации заключалась в выявлении нерешенных клинических вопросов (PICO) при ведении пациентов с ЛЭ, критической оценке действующих КР и выборе положений, наиболее применимых в сложных и специфических случаях.
2. МЕТОДЫ
Для получения надежных рекомендаций, позволяющих помочь клиницистам в обеспечении соответствующей помощи пациентам с острой ЛЭ в сложных ситуациях, мы следовали методологии, разработанной рабочей группой (РГ) по критической оценке рекомендаций по внутренним болезням Европейской федерации внутренней медицины (EFIM) [7]. Процесс консенсуса и обзора состоял из трех стадий: подготовки, адаптации и распространения.
2.1. Стадия подготовки
Рабочая группа EFIM определила ЛЭ как проблему для практикующих врачей и назначила членов группы по подготовке рекомендаций в соответствии с ранее определенной структурой: председатель РГ (Д. Диккер), два сопредседателя группы по подготовке рекомендаций по ЛЭ (В.А. Кокорин и Ч. Бекаттини), шесть членов рабочей группы (В. Лесняк, И. Марин-Леон, Ф.Х. Медрано, Л. Морбидони, А.М. Марра и Э. Бискуп) и один независимый эксперт в области ЛЭ (А. Риера-Местре).
2.2. Стадия адаптации
2.2.1. Определение клинических вопросов
Для определения ключевых клинических вопросов (PICO) был проведен опрос на веб-сайте EFIM, а также с помощью рассылки по электронной почте среди врачей-терапевтов стран Европы о наиболее сложных вопросах в ведении (диагностике, стратификации риска, лечении и амбулаторном наблюдении) пациентов с ЛЭ. Заключительный выбор PICO был сделан путем достижения консенсуса в процессе обсуждения, основанного на оценке клинической актуальности данных проблем в ежедневной практике.
2.2.2. Поиск и сортировка клинических рекомендаций для адаптации
Актуальные документы (опубликованные за последние 5 лет) были идентифицированы с помощью поиска в базах данных MEDLINE, Embase и Scopus. Подробная информация о стратегии поиска представлена в дополнительном материале (приложение 1). После удаления дубликатов полные версии документов были проверены на подлинность как минимум двумя членами рабочей группы. Все разногласия между экспертами разрешались путем обсуждения на встречах РГ по ЛЭ.
2.2.3. Выбор и оценка качества обновленных КР для включения в адаптацию
Четырьмя членами РГ по ЛЭ проведена независимая оценка качества рекомендаций с помощью оценочного инструмента анализа КР (AGREE-II) [8] для Домена 1 (область применения и цель) и Домена 3 (тщательность разработки). Клинические рекомендации признавались соответствующими для включения в случае: а) если средний балл для каждого критерия составлял как минимум 3 (т.е. минимум 9 баллов в Домене 1 и 24 балла в Домене 3); б) если было достигнуто как минимум 50% порогового значения от максимально возможного количества баллов для каждого домена. В анализ также включали обновленные версии КР, появившиеся в период подготовки и рассмотрения данного документа.
2.2.4. Выбор необходимых положений из уже существующих КР
Из членов РГ по ЛЭ были сформированы команды по рассмотрению каждого из клинических вопросов (PICO), включавшие по 2–3 эксперта. Выбор и разработка рекомендаций осуществлялись в три этапа.
На первом этапе каждый из экспертов независимо от других производил поиск в отобранных КР положений, соответствующих изучаемому PICO, а затем адаптировал их, следуя формату GRADE по определению уровня качества доказательности (УКД) и силы данной рекомендации (СР) [9] (табл. 1), параллельно интегрируя информацию из других рекомендаций, посвященных этому клиническому вопросу. На втором этапе эксперты по каждому из PICO устраняли расхождения и несоответствия в спорных рекомендациях. На третьем этапе все члены РГ разрешили оставшиеся противоречия и с помощью консенсуса одобрили окончательный вариант рекомендаций.
2.3. Стадия распространения
В завершающей стадии РГ путем консенсуса разработала и одобрила проект документа, который впоследствии прошел рецензирование двумя независимыми экспертами в области ЛЭ, а также исполнительным комитетом EFIM для публикации и распространения.
3. РЕЗУЛЬТАТЫ
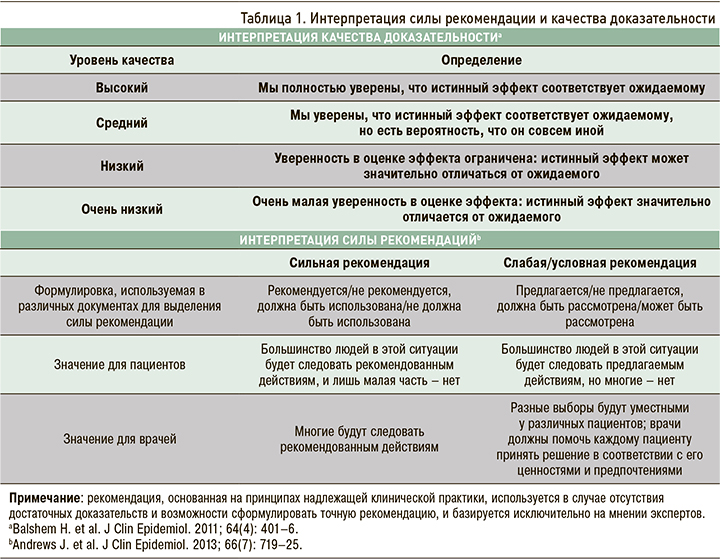
В период с 13 января по 1 марта 2020 г. были получены анкеты от 281 врача-терапевта из стран Европы по актуальным вопросам ведения пациентов с острой ЛЭ, из которых были выбраны 20 наиболее часто упоминаемых клинических вопросов. В ходе двух заседаний РГ по ЛЭ на основе этих 20 вопросов был составлен более короткий список из 5 клинических вопросов со структурой PICO (табл. 2). В ходе проведенного с 1 по 8 октября 2020 г. поиска по базам данных были обнаружены 3298 документов по ЛЭ. После отбора и исключения дубликатов как минимум два члена РГ по ЛЭ независимо оценили оставшиеся 130 полных текстов статей. Были выбраны 20 КР по ЛЭ для оценки их качества с помощью оценочного инструмента анализа рекомендаций (AGREE-II), и 10 из них были включены для решения всех 5 клинических вопросов (рис. 1).

PICO № 1: как исключить диагноз ЛЭ, если проведение КТ-ангиографии легочной артерии (ЛА) невозможно или высок риск осложнений из-за введения контрастного вещества/лучевой нагрузки в случаях, когда D-димер невозможно оценить или его определение малоспецифично (например, при тяжелой хронической болезни почек или беременности)?
Оценку содержания D-димера необходимо проводить больным с низкой или средней предтестовой клинической вероятностью ЛЭ, с целью определения целесообразности выполнения КТ-ангиографии ЛА. К сожалению, у некоторых пациентов с подозрением на ЛЭ изменения уровня D-димера могут быть мало специфичными (например, при тяжелой хронической болезни почек или беременности), а проведение КТ-ангиографии невозможно или небезопасно. Данный клинический вопрос обсуждается в четырех из выбранных КР [10– 13]. Были рассмотрены 3 ситуации: 1) контраст-индуцированная аллергия; 2) хроническая болезнь почек (ХБП); 3) беременность. Контраст-индуцированную аллергию рассматривали совместно с ХБП, а беременность – отдельно от них. Вероятность ЛЭ определяется на основании оценки по клиническим шкалам.
3.1. Контраст-индуцированная аллергия и нарушение функции почек
1.1. В трех КР [8–10] в случае наличия контраст-индуцированной аллергии или тяжелой ХБП, а также при недоступности КТ-ангиографии ЛА рекомендовано выполнение вентиляционно-перфузионного (V/Q) сканирования (сцинтиграфии) легких (СР – слабая, УКД – низкий/средний).
1.2. У пациентов с низкой или средней предтестовой вероятностью (ПТВ) предлагается выполнять V/Q-сканирование. При получении отрицательного результата V/Q-сканирования дальнейшие обследования обычно не требуются. Однако в популяции пациентов с высокой ПТВ (≥50%) V/Q-сканирование может быть использовано, если при получении сомнительного результата есть возможность проведения дополнительных тестов, таких как КТ-ангиография ЛА и/или УЗИ нижних конечностей [11] (СР – слабая, УКД – низкий).
Если незамедлительное проведение дополнительных тестов невозможно, то пациентам с высокой ПТВ (≥50%) и сомнительным результатом V/Q-сканирования должна быть предложена антикоагулянтная терапия в лечебных дозах [10].
Необходимо отметить, что V/Q-сканирование недоступно во многих клинических случаях. В такой ситуации для дифференциальной диагностики могут быть использованы другие диагностические тесты (см. 1.3, 1.4 и 1.5).
1.3. В условиях отделения неотложной помощи возможно использование критериев исключения ЛЭ (PERC) для оценки вероятности наличия ЛЭ у пациентов с ее низкой предтестовой вероятностью и определения необходимости выполнения теста на D-димер (СР – слабая, УКД – низкий/средний) [10].
Комментарий: PERC – это утвержденный метод исключения ЛЭ у пациентов с низкой ПТВ ее развития [14–17]. К критериям исключения ЛЭ, согласно правилу PERC, относят: возраст <50 лет, пульс <100 уд/мин, сатурацию кислорода ≥95% и отсутствие отеков нижних конечностей, кровохарканья, хирургических вмешательств/травм, требующих госпитализации в течение предшествующих 4 нед, эпизодов тромбоэмболии легочной артерии (ТЭЛА) или тромбоза глубоких вен (ТГВ) в анамнезе, а также приема эстрогенов.
1.4. Пациентам с предполагаемой ЛЭ, которым требуется проведение диагностической визуализации, обзорная рентгенография органов грудной клетки может позволить выявить альтернативный диагноз, объясняющий симптомы пациента, и избежать проведения других визуализирующих обследований [11] (рекомендация, основанная на принципах надлежащей клинической практики).
Комментарий: следует отметить, что подобные ситуации встречаются достаточно редко.
1.5. Трансторакальная эхокардиография (ТТ-ЭХОКГ) у постели больного (или прикроватное УЗИ – POCUS) должна проводиться гемодинамически нестабильным пациентам с предполагаемой ЛЭ. В случае выявления признаков дисфункции правого желудочка и отсутствии возможности выполнения КТ-ангиографии пациентам должна быть немедленно начата реперфузионная терапия [13] (СР – сильная, УКД – очень низкий).
Комментарий: отрицательная прогностическая значимость ТТ-ЭХОКГ при диагностике ЛЭ варьирует от 40 до 50% [18]. Несмотря на ограниченную специфичность, она может быть полезна при отсутствии возможности проведения других тестов, поскольку позволяет исключить альтернативные причины дисфункции сердца (острую дисфункцию левого желудочка, тампонаду, острую клапанную недостаточность, расслоение аорты).
1.6. Если при компрессионной ультрасонографии (КУС) у пациента с клиническим подозрением на ЛЭ выявляется проксимальный тромбоз глубоких вен, то диагноз венозной тромбоэмболии (и ЛЭ) рекомендуется считать подтвержденным [13] (СР – сильная, УКД – высокий).
Комментарий: КУС целесообразно проводить пациентам с подозрением на ЛЭ после оценки ее ПТВ с помощью клинических шкал и при доступности дополнительных тестов (биомаркеров, ТТ-ЭХОКГ).
3.2. Беременность
1.7. У беременных V/Q-сканирование легких следует предпочесть [12] КТ-ангиографии ЛА в случае недоступности протокола низкодозового облучения [13] (СР – слабая, УКД – низкий).
Комментарий: разработан и валидизирован адаптированный для беременных алгоритм YEARS, позволяющий исключить диагноз ЛЭ в этой категории пациентов и основанный на оценке уровня D-димера [19].
1.8. Для исключения диагноза ЛЭ у беременных следует рассмотреть возможность проведения КТ-ангиографии ЛА с протоколом низкодозового облучения или перфузионной сцинтиграфии [13] (СР – слабая, УКД – очень низкий).
1.9. Проведение КУС вен может быть рассмотрено у беременных с предполагаемым диагнозом ЛЭ (в частности, при наличии симптомов ТГВ) во избежание ненужной лучевой нагрузки [13] (СР – слабая, УКД – средний).
PICO № 2: Как лечить пациентов с ЛЭ и сопутствующими состояниями?
3.3. Как лечить пациентов с ЛЭ и раком?
Восемь выбранных обновленных КР касаются этого клинического вопроса [10, 12, 13, 20–24]. В них рассматриваются пять различных клинических сценариев: а) начальное (инициальное) лечение подтвержденной ЛЭ у больных раком; б) амбулаторное ведение онкологических больных с ЛЭ; в) ранняя поддерживающая терапия (до 6 мес) и длительное лечение (свыше 6 мес); г) лечение рецидива ЛЭ у онкологических больных, получающих антикоагулянтную терапию; e) другие особые ситуации.
3.4. Начальное лечение подтвержденной ЛЭ
2.1. Предлагается использовать прямые оральные антикоагулянты (апиксабан, эдоксабан или ривароксабан) или низкомолекулярные гепарины (НМГ) для начального лечения венозной тромбоэмболии (ВТЭ) у онкологических больных [20] (СР – сильная, УКД – средний).
Комментарий: имеются убедительные доказательства безопасности апиксабана у пациентов со злокачественными новообразованиями желудочно-кишечного тракта и высоким риском кровотечения.
2.2. Рекомендуется использовать НМГ вместо нефракционированного гепарина (НФГ) для начального лечения ВТЭ у онкологических больных [20] (СР – сильная, УКД – средний).
2.3. Предлагается использовать НМГ вместо фондапаринукса для начальной терапии ВТЭ у онкологических больных [20] (СР – слабая, УКД – очень низкий).
2.4. Тромболитическую терапию у гемодинамически нестабильных онкологических пациентов с ЛЭ целесообразно рассматривать в индивидуальном порядке, уделяя особое внимание наличию противопоказаний, прежде всего риску кровотечений, например, при метастазировании опухоли в головной мозг [10, 21–25] (СР – слабая, УКД – низкий).
Комментарий: пациенты должны получать антикоагулянтную терапию в лечебных дозах и находиться под наблюдением для выявления признаков ухудшения клинической картины. Подобное ухудшение должно служить поводом для рассмотрения вопроса о проведении тромболитической терапии даже при отсутствии шока, если риск кровотечения расценивается как допустимый [24]. Альтернативное решение может быть принято у пациентов с высоким риском кровотечения (см. рекомендацию 2.5).
2.5. У пациентов с острой ЛЭ, сопровождающейся артериальной гипотензией, которые также имеют (1) высокий риск кровотечения, (2) недостаточный эффект от проведенного системного тромболизиса или (3) шок, который может привести к смерти до того, как будет достигнут эффект от проведенного тромболизиса (например, в течение нескольких часов), при наличии соответствующего опыта и ресурсов рекомендуется катетер-управляемое удаление тромба вместо отказа от данного вмешательства [24] (СР – слабая, УКД – низкий).
3.5. Первичное лечение (до 6 мес) и вторичная профилактика (свыше 6 мес)
2.6. Прямые оральные антикоагулянты (предпочтительно) или НМГ следует применять в течение как минимум 6 мес для лечения верифицированной ЛЭ у онкологических больных, при условии, что клиренс креатинина (КК) ≥30 мл/мин [10, 13, 20–22, 24] (СР – сильная, УКД – высокий). У пациентов с новообразованиями желудочно-кишечного тракта и высоким риском развития кровотечения прием апиксабана считается безопасным [24] (СР – сильная, УКД – средний).
2.7. После инициальной 6-месячной терапии у отдельных пациентов (например, с активной формой рака, метастазами или получающих химиотерапию) следует рассмотреть возможность продолжения антикоагулянтной терапии (без запланированной даты прекращения). Решение об отмене или продолжении приема антикоагулянтов должно основываться на оценке индивидуальных особенностей пациента [10, 13, 20–22] (СР – слабая, УКД – очень низкий).
2.8. В случае рецидива ЛЭ, оценив риск кровотечения с помощью утвержденной шкалы, следует рассмотреть следующие варианты лечения: 1) увеличение дозы НМГ [22] на 20–25% [21, 24] или переход на прием прямых оральных антикоагулянтов (ПОАК); 2) переход с приема ПОАК на НМГ; 3) при использовании антагонистов витамина К (АВК) переход на НМГ или ПОАК. Если из-за высокого риска кровотечения нельзя увеличить дозу антикоагулянта, в крайнем случае для предотвращения ЛЭ может быть установлен кава-фильтр в нижнюю полую вену [21, 22, 25] (СР – слабая, УКД – низкий).
3.6. Как лечить пациентов с ЛЭ и тяжелой ХБП?
Этот клинический вопрос рассматривается в четырех из выбранных обновленных КР [10, 12, 21, 22]. Все рекомендации полностью совпадают.
2.9. При тяжелой ХБП (КК <30 мл/мин) для лечения ЛЭ предлагается использовать НФГ с последующим ранним переводом пациента на прием АВК или НМГ в дозах, скорректированных по уровню анти-Ха в соответствии с утвержденными локальными стандартами [10, 12, 21, 22] (СР – слабая, УКД – низкий).
Комментарий: хотя соответствие между наиболее часто используемыми формулами для оценки ХБП, формулами Кокрофта–Голта (CG) и Сотрудничества по эпидемиологии хронической болезни почек (CKD-EPI) далеко от совершенства, частота крупных кровотечений одинаково идентифицируется независимо от используемой формулы.
3.7. Как лечить пациенток с ЛЭ и беременностью?
Две из актуальных КР посвящены этому клиническому вопросу [12, 23]. В них рассматриваются 3 специфических клинических сценария: а) лечение ЛЭ у беременных; б) применение антикоагулянтов в период родов; c) применение антикоагулянтов у кормящих женщин с ЛЭ. Только первый из этих сценариев применим к практике врачей терапевтического профиля.
2.10. НМГ рекомендованы вместо НФГ. В то же время НФГ рекомендуется пациенткам, которым может потребоваться тромболитическая терапия, хирургическое вмешательство или срочные роды [12, 23] (СР – сильная, УКД – низкий/средний).
ПОАК или АВК применять у беременных не следует.
При назначении НМГ не рекомендуется проводить мониторинг уровня анти-Xa фактора.
3.8. Как лечить пациентов с ЛЭ и тромбоцитопенией?
Две рассмотренные КР (одна соответствует, а вторая не соответствует критериям качества) косвенно затрагивают этот клинический вопрос [13, 26]. Рекомендации даны двумя консенсусами экспертов для онкологических пациентов, хотя они могут быть применены и к неонкологическим пациентам.
2.11. Консенсусы экспертов предлагают руководствоваться следующими пороговыми значениями уровня тромбоцитов:
1) >50×109/л: терапевтическая доза антикоагулянта;
2) 30–50×109/л: 50% дозы антикоагулянта;
3) <30×109/л: прекращение приема или профилактическая доза антикоагулянта ± фильтр нижней полой вены ± переливание тромбоцитарной массы [13, 26] (рекомендация, основанная на принципах надлежащей клинической практики).
3.9. Как лечить пациентов с ЛЭ и анемией?
Ни одна из обновленных КР, как принятых и отвечающих требованиям критериев качества, так и не отвечающих критериям качества, не затрагивают этот клинический вопрос.
Специфические рекомендации по лечению ЛЭ у пациентов с анемией отсутствуют.
Хотя анемия включена в некоторые шкалы риска развития кровотечений [27–29], конкретных рекомендаций о том, какой тактикой руководствоваться при лечении таких пациентов антикоагулянтами, нет.
Таким образом, мы определили серьезный недостаток сведений по этому вопросу. Необходимы дальнейшие исследования, посвященные оценке риска и ведению пациентов с анемией и ЛЭ.
PICO № 3: Какая шкала является наиболее точной для прогнозирования кровотечений у коморбидных пациентов, получающих лечение по поводу ЛЭ?
Этот вопрос был рассмотрен в четырех КР [10, 13, 25, 30]. В целом, на сегодняшний день ни одна из шкал прогнозирования развития кровотечений не прошла внешней валидации, в связи с чем необходимы дальнейшие исследования. Шкалы прогнозирования кровотечений должны использоваться прежде всего для выявления и коррекции обратимых факторов риска (ФР) их развития, а также для принятия решения о продлении антикоагулянтной терапии после первых 3 мес лечения (минимальный период лечения, рекомендуемый для всех пациентов с ЛЭ). Рекомендации по данному вопросу приведены только в двух КР [10, 25].
3.1. Один из предлагаемых вариантов [10] заключается в использовании шкалы HAS- BLED (артериальная гипертензия, нарушение функции почек/печени, инсульт, кровотечения в анамнезе или предрасположенность к ним, лабильное международное нормализованное отношение, пожилой возраст, употребление наркотиков/алкоголя) для оценки риска крупных кровотечений на фоне приема антикоагулянтной терапии. Однако точность шкалы HAS-BLED при ЛЭ не была подтверждена в достаточной мере [31–34], что не позволяет использовать ее в качестве единственного основания для принятия решений (СР – слабая, УКД – низкий).
3.2. Дальнейшая стратификация риска возникновения крупного кровотечения может быть проведена путем оценки наличия следующих факторов риска (ФР) [24]: 1) возраст >75 лет; 2) активная форма рака; 3) наличие метастазов; 4) хроническая почечная или печеночная недостаточность; 5) количество тромбоцитов <80×109/л; 6) необходимость проведения антитромбоцитарной терапии; 7) кровотечение в анамнезе без установленной причины (рекомендация, основанная на принципах надлежащей клинической практики).
Комментарий: такая оценка, вероятно, позволяет распределить пациентов на группы низкого (при отсутствии ФР частота развития крупного кровотечения составляет 0,8% в год), умеренного (при наличии одного ФР частота крупных кровотечений достигает 1,6% в год) и высокого риска (при наличии ≥2 ФР частота крупных кровотечений увеличивается до 6,5% в год). Однако данная шкала показала недостаточную прогностическую значимость у пациентов, включенных в итальянский регистр START2 [35]. Недавно была предложена удобная для применения шкала оценки риска раннего (в первые 30 дней) крупного кровотечения именно у пациентов с острой ЛЭ [36].
PICO № 4: Какова должна быть продолжительность антикоагулянтной терапии после перенесенной ЛЭ (включая особые группы пациентов)?
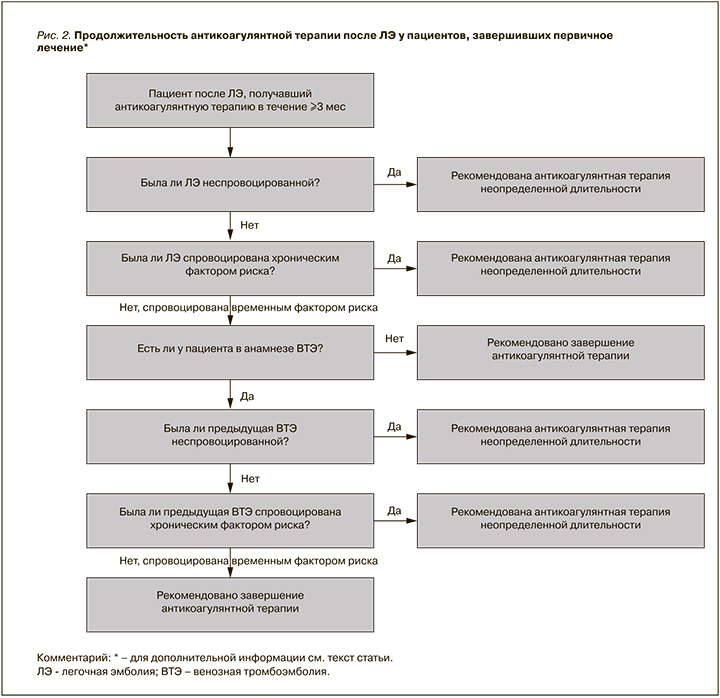
Данный клинический вопрос рассматривается в шести обновленных КР, отвечающих критериям качества и включенных в наш обзор [10, 12, 13, 20, 25, 30]. Мы использовали классификацию североамериканских КР, подразделяющих ЛЭ на неспровоцированную и спровоцированную какими-либо идентифицируемыми ФР, а также выделяющих начальную (инициальную), первичную (раннюю поддерживающую) и продленную (длительную, вторичную профилактику) фазы лечения ЛЭ. В этих КР рассматривали 4 различных клинических сценария: а) все пациенты с ЛЭ (в совокупности); б) ЛЭ, спровоцированная хроническим ФР; в) ЛЭ, спровоцированная преходящим ФР; г) неспровоцированная ЛЭ (без идентифицируемых ФР). Во всех включенных КР наблюдается почти полное согласие. В шести из выбранных КР также рассмотрен вопрос о продолжительности антикоагулянтной терапии после ЛЭ в отдельных подгруппах, таких как пациенты с ВТЭ, ассоциированной с раком, антифосфолипидным синдромом, беременностью или пациенты, принимающие гормональные контрацептивы и страдающие ХТЭЛГ [10, 12, 20–22, 25]. Для определения различных периодов лечения ЛЭ в разных КР использовались различные определения.
Критерии, влияющие на решение вопроса о продолжительности антикоагулянтной терапии после перенесенной ЛЭ, представлены на рисунке 2.
Все недавние КР [13, 30] рекомендуют при отсутствии противопоказаний для лечения ЛЭ использовать ПОАК вместо АВК.
3.10. Все пациенты с ЛЭ
4.1. Всем пациентам с ЛЭ рекомендуется антикоагулянтная терапия в лечебных дозах в течение не менее 3 мес [13] (СР – сильная, УКД – высокий).
4.2. Для первичного лечения острой ЛЭ рекомендуются более короткие курсы антикоагулянтной терапии (3–6 мес) по сравнению с более длительными курсами (6–12 меся) [29] (СР – слабая, УКД – средний).
3.11. ЛЭ, спровоцированная хроническим фактором риска (не раком)
4.3. Продленная или неопределенно долгая антитромботическая терапия предлагается вместо ее прекращения [13, 25, 30] (СР – слабая, УКД – средний).
3.12. ЛЭ, спровоцированная преходящим фактором риска
4.4. Если ЛЭ спровоцирована преходящим (временным, устраняемым) ФР, прекращение пероральной антикоагулянтной терапии рекомендуется через 3 мес [13, 25, 30] (СР – сильная, УКД – средний).
Комментарий: предлагается различать случаи ЛЭ, спровоцированной преходящими факторами высокого и низкого риска ее развития. Пациенты, страдающие ЛЭ, спровоцированной факторами низкого риска (малая операция, госпитализация менее чем на 3 дня, терапия/контрацепция эстрогенами, послеродовой период, амбулаторные пациенты с острым заболеванием, прикованные к постели в течение ≥3 дней, травма ноги (без перелома), связанная с уменьшением подвижности в течение ≥3 дней, длительный авиаперелет) могут являться кандидатами на проведение вторичной профилактики ВТЭ [13]. Такое решение должно быть взвешенным с учетом риска кровотечений [30]. Хотя ни одно исследование не рассматривало этот вопрос, имеются доказательства, доступные из анализа данных подгруппы пациентов в рандомизированных клинических исследований и метаанализа, показывающие различный риск рецидива у таких больных.
4.5. У пациентов с ЛЭ, спровоцированной преходящим ФР, имеющих эпизод ВТЭ в анамнезе:
- если предыдущий эпизод ВТЭ был неспровоцированным или спровоцирован хроническим ФР, предлагается антитромботическая терапия неопределенной длительности [13, 25, 30];
- если предыдущий эпизод ВТЭ также был спровоцирован преходящим ФР, рекомендуется прекратить прием антикоагулянтов после завершения первичного лечения [25, 30] (СР – слабая, УКД – средний).
3.13. Неспровоцированная ЛЭ
4.6. В данном случае должна быть рассмотрена продленная пероральная антикоагулянтная терапия неопределенной длительности [13, 25, 30] (СР – слабая, УКД – высокий). Эта рекомендация не распространяется на пациентов с высоким риском кровотечений [28] (СР – слабая, УКД – средний).
3.14. Продолжительность антикоагулянтной терапии у определенных групп больных
3.14.1. ВТЭ, ассоциированная с раком
В пяти выбранных обновленных КР рассматривается этот клинический вопрос [13, 20–22, 25]. Существует полное согласие по данному вопросу во всех них (см. рекомендацию 2.5).
3.14.2. Антифосфолипидный синдром
Только две из выбранных обновленных КР освещают этот клинический вопрос [13, 25].
4.7. Всем пациентам с антифосфолипидным синдромом рекомендуется пероральное лечение АВК в течение неопределенно долгого периода [13, 25] (СР – сильная, УКД – средний).
3.15. Беременные и женщины, принимающие контрацептивы
Три из выбранных обновленных КР посвящены этому клиническому вопросу [12, 13, 25].
4.8. Антикоагулянтную терапию следует рассматривать в течение ≥6 нед после родов и с минимальной общей продолжительностью лечения 3 мес [12, 24] (СР – слабая, УКД – низкий).
4.9. У молодых женщин, перенесших острую ЛЭ во время приема пероральных эстрогенсодержащих контрацептивов, рекомендуется прекратить прием гормональных контрацептивов после обсуждения альтернативных методов контрацепции и рассмотреть возможность прекращения приема антикоагулянтной терапии через 3 мес [13, 23] (СР – слабая, УКД – низкий).
4.10. У молодых женщин, перенесших острую ЛЭ во время приема других контрацептивов, рекомендуется проводить длительную антикоагулянтную терапию, как при острой ЛЭ, развившейся в отсутствие идентифицируемых ФР [12, 13] (СР – слабая, УКД – низкий).
3.16. Хроническая тромбоэмболическая легочная гипертензия
Только одна из выбранных обновленных КР освещает этот клинический вопрос [24].
4.11. Рекомендуется пожизненная пероральная антикоагулянтная терапия с помощью АВК даже после успешной легочной эндартерэктомии или баллонной легочной ангиопластики [25] (СР – сильная, УКД – низкий).
PICO № 5: Необходим ли скрининг пациентов на наличие злокачественных новообразований и тромбофилии у пациентов с ЛЭ без идентифицированных предрасполагающих ФР?
Этот вопрос рассматривается только в рекомендациях NICE [10].
3.17. Скрининг на рак
5.1. У пациентов с неспровоцированным ТГВ или ЛЭ, у которых нет известного злокачественного образования, рекомендуется ограниченный скрининг на его наличие (включающий сбор данных анамнеза, физикальное обследование, развернутый анализ крови с оценкой функции почек и печени, а также определение активированного частичного тромбопластинового времени). Расширенный скрининг (с помощью КТ) рекомендуется только в случае наличия клинических симптомов или признаков, указывающих на рак (СР – сильная, УКД – низкий/средний).
Комментарий: никаких явных преимуществ стратегии расширенного скрининга (включая комплексную визуализацию) по сравнению с базисной стратегией (физикальное обследование, анализы крови и т.д.) с точки зрения исходов (выявление рака на ранней стадии, время диагностики рака, смертность от всех причин, смертность, связанная с раком) не наблюдалось.
Новые данные, поступающие в ходе текущих исследований, которые, как мы надеемся, будут доступны в скором времени, способны помочь решить этот вопрос. В частности, стоит упомянуть следующие продолжающиеся клинические исследования: исследование образованных опухолью тромбоцитов при ВТЭ (NCT02739867) с изучением «жидкостной биопсии» крови, SOME RIETE (NCT03937583) и MVTEP2-SOME2 (NCT04304651) – оба из регистра Riete, оценивающие КТ/ПЭТ в качестве расширенной стратегии скрининга [37].
3.18. Скрининг на тромбофилию
5.2. Пациентам со спровоцированной или неспровоцированной ЛЭ, которые продолжают антикоагулянтную терапию, не рекомендуется предлагать тестирование на наследственную тромбофилию. Тем не менее, пациентам с неспровоцированным ТГВ/ЛЭ, которые планируют прекратить лечение антикоагулянтами, рекомендуется тестирование на наследственную тромбофилию и антифосфолипидные антитела. Клиницисты должны помнить, что принимаемые антикоагулянты могут влиять на показатели свертывания крови. Стоит также рассмотреть возможность тестирования на наследственную тромбофилию пациентов, у которых родственники первой степени также перенесли ТГВ/ЛЭ (рекомендация, основанная на принципах надлежащей клинической практики).
Комментарий: нет никаких доказательств того, что результаты тестирования на тромбофилию или антифосфолипидные антитела влияют на какой-либо из исходов (частота рецидива ВТЭ, смертность, связанная с ВТЭ, симптомная/бессимптомная ЛЭ/ТГВ, психологическое состояние, предпочтения или взгляды пациентов) у больных, продолжающих прием антикоагулянтной терапии [38]. При этом отсутствие тестирования на тромбофилию ассоциировано с предотвратимыми финансовыми затратами [39]. Таким образом, данная рекомендация основывается только на консенсусе экспертов. Группа по подготовке рекомендаций сфокусировала внимание на более высокой вероятности положительного теста у пациентов с неспровоцированной ВТЭ и значимости дополнительной информации для принятия решения о продолжении или прекращении приема антикоагулянтов.
4. ОБСУЖДЕНИЕ
В нашем документе по ведению пациентов с острой ЛЭ EFIM представлены 35 рекомендаций, ориентированных на пять клинических сценариев, касающихся типичной практики ведения пожилых, уязвимых и коморбидных пациентов.
Был рассмотрен широкий спектр сложных клинических ситуаций у пациентов с ЛЭ, связанных с диагностикой и лечением больных с раком, беременностью, ХБП, анемией, тромбоцитопенией или подверженных высокому риску кровотечения.
Данный документ посвящен пациентам со сложными клиническими ситуациями, поскольку создается впечатление, что современные КР непоследовательно сообщают об этих сценариях. Крупные регистры показывают, что распространенность сопутствующих заболеваний у пациентов с острой ЛЭ является достаточно существенной [2]. Около 20–30% этих пациентов имеют рак, у многих снижена функция почек, возраст более 40% из них составляет 70 лет и старше [2, 3]. По тем же причинам распространенность анемии и наличие противопоказаний для проведения КТ-ангиографии легочной артерии являются повседневной проблемой при ведении таких пациентов.
Рекомендации были отобраны из 10 высококачественных, научно обоснованных и недавно обновленных КР. Благодаря процессу адаптации мы избежали напрасной траты ресурсов на разработку новых КР в тех ситуациях, когда такие рекомендации уже имеются, и сконцентрировались на облегчении практики при повседневном уходе и распространении обновленных вторичных доказательств. Примечательно, что рекомендации, которые использовались в наших пяти клинических сценариях у пациентов с раком, тяжелой ХБП, беременностью, анемией или нарушениями свертывания крови, показали высокую степень последовательности и согласованности между исходными источниками. Во многих случаях РГ нужно было лишь переписать и обобщить данные из нескольких оригинальных рекомендаций. В целом, из 35 положений 3 основаны на высоком, 9 – среднем, 4 – низком/среднем, 11 – низком и 4 – очень низком качестве доказательности. Из них 11 являются сильными, 20 – имеют слабую силу, а еще 4 относятся к рекомендациям, основанным на принципах надлежащей клинической практики.
Следует подчеркнуть, что 4 рекомендации базируются сугубо на консенсусе экспертов, основанном на принципах надлежащей клинической практики. Доказательства по вопросам лечения ЛЭ у пациентов с анемией, а также объему поиска причины тромбоза при неспровоцированном эпизоде ЛЭ, отсутствуют. Этот пробел в доказательной базе был описан у коморбидных пациентов [40, 41] и должен быть восполнен в ходе последующего углубленного изучения.
В настоящем документе процесс адаптации был воспроизводимым, четко следовавшим ранее опубликованной методологии, что увеличивает его внешнюю валидность [7], как и выбор обоснованных рассматриваемых руководств и рекомендаций, получивших твердое согласие по своему качеству от всех экспертов и внутри команд по рассмотрению каждого из клинических вопросов. В случае отсутствия достаточной доказательной базы был сделан ряд замечаний, которые должны стимулировать новые исследования, как, например, у пациентов с ЛЭ и анемией.
Наша адаптация рекомендаций имеет некоторые ограничения. Во-первых, она представляет собой резюме других существующих КР, и возможная предвзятость в первичных источниках может быть перенесена и в наш документ, хотя, вероятно, это не является значимой проблемой, учитывая наблюдаемую высокую согласованность оригинальных рекомендаций. Во-вторых, ограниченная сфера применения наших рекомендаций, охватывающая лишь несколько клинических ситуаций, возникающих при ведении пациентов с ЛЭ, делает невозможным разработку универсальных клинических подходов. В-третьих, поскольку различные оригинальные КР использовали разную методологию оценки рекомендаций, мы были вынуждены применить невалидированную систему соответствия для определения силы рекомендаций, адаптированную к процедуре GRADE, отдавая приоритет качеству доказательств, указанному в КР. И, наконец, в-четвертых, имеются некоторые несоответствия рекомендаций в различных КР, которые могут быть связаны со сроками их подготовки (и доступными в то время доказательствами), различиями в используемой методологии (применением подхода GRADE или других методов) и особенных предпочтений групп экспертов в разных странах мира.
Указанные ограничения не снижают клинической значимости данных КР EFIM. В них изложены рекомендации, которые должны использоваться терапевтами в сложных клинических ситуациях. Представленные положения в ряде случаев непросто обнаружить в рекомендациях более узкоспециализированных профессиональных сообществ.
Благодарности
Мы благодарим г-жу Анну Багинскую и г-жу Агату Жмый из Польского института доказательной медицины за обеспечение полными текстами рекомендаций, а также профессоров Ремедиоса Отеро Канделеру (Севилья, Испания) и Ставроса В. Константинидеса (Майнц, Германия) за их усилия по внешнему рецензированию документа.
Дополнительные материалы
Дополнительные материалы, связанные с этой статьей, можно найти в онлайн-версии по адресу: https://dx.doi.org/10.1016/j.ejim.2021.12.001.



