По мнению акад. И.В. Давыдовского, приспособление является самым универсальным и важным законом жизни, а болезнь есть физиологический процесс приспособительного характера как один из возможных вариантов адаптации [1]. Адаптация организма к постоянно изменяющимся условиям среды (внешним и внутренним) – безостановочно происходящий процесс приспособления организма к данным изменениям, призванный сохранять в нем гомеостатическое равновесие [2]. Теория адаптации неразрывно связана с работами Selye H., посвященными изучению неспецифических адаптационных реакций организма на чрезмерные по силе воздействия (стресс) с последующей реализацией стресс-синдрома [3]. При этом наблюдается значительное возбуждение высших вегетативных центров с резким возрастанием концентраций катехоламинов и глюкокортикоидов. Известно, что массивный выброс катехоламинов сопровождает фазу компенсации при генерализованном судорожном эпилептическом статусе [4]. В соответствии с этим можно рассматривать эпилептические приступы как проявление внутреннего стрессового фактора с последующей реализацией стресс-синдрома.
Учитывая, что течение эпилепсии неразрывно связано со свободно-радикальными процессами [5, 6], изменения показателей окислительного стресса представляется возможным трактовать с позиции развития процесса воспаления, вызванного активацией первичного неспецифического (адаптативного) звена иммунитета.
Цель исследования – изучение окислительного стресса у пациентов молодого возраста с фокальной симптоматической эпилепсией и эпилепсией неясной этиологии, а также после впервые развившихся эпилептических приступов.
МАТЕРИАЛ И МЕТОДЫ
Все пациенты в возрасте от 19 до 44 лет были распределены в 3 группы по 30 человек:
- 1-я группа – пациенты после единичных (первых) эпилептических приступов;
- 2-я группа – пациенты с клинической ремиссией приступов в течение года и более;
- 3-я группа – пациенты с эпилептическими приступами, резистентными к лечению, с частотой вторично-генерализованных приступов от 4 в год до 1–2 в неделю и парциальных – от 2 в неделю до 5 в день (3-я группа).
Наряду с этим в исследование были включены практически здоровые лица (20 человек), которые составили контрольную группу.
Средняя длительность заболевания в группе пациентов с резистентной эпилепсией составляла 19 лет, у пациентов с ремиссией – 12 лет. Пациенты 1-й группы противоэпилептическую терапию не получали, у пациентов 2-й и 3-й групп применялись противоэпилептические препараты в виде моно- и политерапии.
Клиническое исследование проводилось в соответствии с принципами Хельсинской декларации последнего пересмотра (2000) и требованиями качественной клинической практики.
В ходе исследования изучались показатели прооксидантного статуса – активные продукты тиобарбитуровой кислоты (ТБК-активные продукты), а также антиоксидантной защиты (АОЗ) – общая супероксид-перехватывающая активность плазмы, каталаза, общая антиоксидантная активность плазмы крови и восстановленные тиолы (SH-группы) плазмы крови. Биохимический анализ крови (общий белок, альбумин, мочевая кислота) проводили на автоматическом биохимическом анализаторе «Сапфир-400» (Япония). Определение ТБК-активных продуктов осуществлялось спектрофотометрическим методом; концентрацию SH-групп измеряли спектрофотометрическим методом с измерением оптической плотности при длине волны 412 нм, общую супероксид-перехватывающую активность плазмы и активность каталазы исследовали при помощи колориметрического метода с использованием набора реагентов SuperoxideDismutase Assay Kit (CaymanChemical, США), каталожный номер 706002, и Catalase Assay Kit (CaymanChemical, США), каталожный номер 707002.
Регистрацию общей антиоксидантной активности плазмы крови проводили на хемилюминометре «LUM-1200» (Россия), в качестве активатора использовали люминол.
Стандартный образец содержал 10 мМ боратного буфера (рН 9,0), 10 мкМ люминола, 100 мкл плазмы, разбавленной в 100 раз, 10 мкМ водорастворимого азоинициатора ААРН. Общий объем пробы составлял 1000 мкл. Реакцию запускали добавлением 10 мкМ ААРН (2,2-азобис 2-амидинопропан гидрохлорид). Измеряли интеграл под кривой спектра хемилюминесценции (ХЛ) (светосумму) в интервале времени с 0 по 12 мин. Далее рассчитывалась светосумма свечения (ΔS): разность светосуммы контрольного (без плазмы) и опытного (с плазмой) образца в период измерения с 0 по 12 мин. Длительность измерения составляла 16 мин.
Полученные результаты обрабатывались с помощью программ Excel (MicrosoftOffice) и STATISTICA (версия 6, Stat Soft Corporation, США). Для анализа различий количественных признаков в трех и более несвязанных группах использовался статистический критерий Краскелла–Уоллиса ANOVA, в двух несвязанных группах применялся критерий Манна–Уитни. Достоверными считались различия при р <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При изучении окислительного стресса было выявлено отсутствие достоверных различий по концентрации ТБК-активных продуктов в плазме крови между пациентами с эпилепсией и контрольной группой. Достоверное снижение по сравнению с контролем выявлено в отношении концентрации восстановленных SH-групп, общей супероксид-перехватывающей активности плазмы и активности каталазы (p <0,05; для общей антиоксидантной активности плазмы p=0,008).
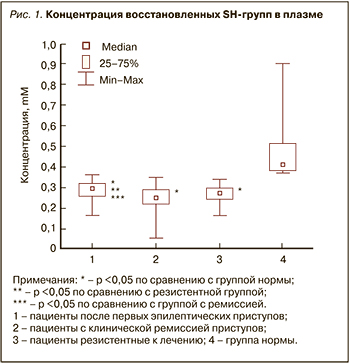 Достоверное снижение концентрации восстановленных SH-групп во всех трех группах пациентов с эпилепсией по сравнению с контрольной группой свидетельствует об окислительном повреждении тиолсодержащих низкомолекулярных соединений плазмы крови. Считается, что в состоянии окислительного стресса атаке активных форм кислорода в первую очередь подвергаются не липиды, а белки плазматических мембран [7]. Концентрация восстановленных SH-групп в плазме крови у 1-й группы пациентов составляла Ме=0,29мM [LQ=0,26; UQ=0,31], у 2-й – Ме 0,24 мМ [LQ=0,22; UQ=0,29], у 3-й – Ме 0,27 мМ [LQ=0,24; UQ=0,29]. В контрольной группе этот показатель был Ме=0,41 мМ [LQ=0,37; UQ=0,51] (рис. 1). Кроме этого, достоверной (p=0,043) оказалась разница по содержанию SH-групп между пациентами с дебютом заболевания и группой с ремиссией эпилептических приступов. Также достоверными (p=0,049) были отличия между группой с дебютом эпилепсии и пациентами с фармакорезистентной формой заболевания.
Достоверное снижение концентрации восстановленных SH-групп во всех трех группах пациентов с эпилепсией по сравнению с контрольной группой свидетельствует об окислительном повреждении тиолсодержащих низкомолекулярных соединений плазмы крови. Считается, что в состоянии окислительного стресса атаке активных форм кислорода в первую очередь подвергаются не липиды, а белки плазматических мембран [7]. Концентрация восстановленных SH-групп в плазме крови у 1-й группы пациентов составляла Ме=0,29мM [LQ=0,26; UQ=0,31], у 2-й – Ме 0,24 мМ [LQ=0,22; UQ=0,29], у 3-й – Ме 0,27 мМ [LQ=0,24; UQ=0,29]. В контрольной группе этот показатель был Ме=0,41 мМ [LQ=0,37; UQ=0,51] (рис. 1). Кроме этого, достоверной (p=0,043) оказалась разница по содержанию SH-групп между пациентами с дебютом заболевания и группой с ремиссией эпилептических приступов. Также достоверными (p=0,049) были отличия между группой с дебютом эпилепсии и пациентами с фармакорезистентной формой заболевания.
Этот факт может быть обусловлен длительностью течения заболевания: чем больше времени прошло с момента начала заболевания, тем выше уровень окислительного повреждения низкомолекулярных тиолов.
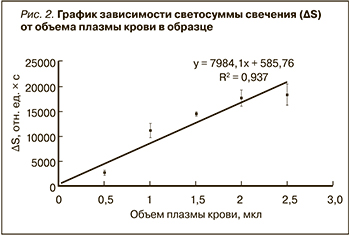 При исследовании общей антиоксидантной активности плазмы за количественный критерий степени тушения ХЛ была принята светосумма свечения (ΔS). Величина ΔS прямо пропорциональна объему добавленной в образец плазмы крови в исследуемом нами диапазоне объемов (рис. 2), а значит, она линейно зависит и от количества содержащихся в плазме антиоксидантных соединений. Данный факт позволяет использовать ΔS как критерий сравнения уровня содержания плазменных антиоксидантов у разных пациентов между собой [8].
При исследовании общей антиоксидантной активности плазмы за количественный критерий степени тушения ХЛ была принята светосумма свечения (ΔS). Величина ΔS прямо пропорциональна объему добавленной в образец плазмы крови в исследуемом нами диапазоне объемов (рис. 2), а значит, она линейно зависит и от количества содержащихся в плазме антиоксидантных соединений. Данный факт позволяет использовать ΔS как критерий сравнения уровня содержания плазменных антиоксидантов у разных пациентов между собой [8].
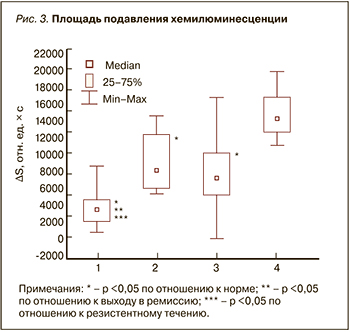 Общая антиоксидантная активность плазмы, о которой судили по площади подавления (∆S) ХЛ, также была достоверно ниже у всех трех групп пациентов с эпилепсией, чем в контроле (p=0,008) (рис. 3). Этот факт позволяет сделать вывод, что общая антиоксидантная активность плазмы крови у пациентов с эпилепсией снижается вне зависимости от длительности, стадии и тяжести заболевания.
Общая антиоксидантная активность плазмы, о которой судили по площади подавления (∆S) ХЛ, также была достоверно ниже у всех трех групп пациентов с эпилепсией, чем в контроле (p=0,008) (рис. 3). Этот факт позволяет сделать вывод, что общая антиоксидантная активность плазмы крови у пациентов с эпилепсией снижается вне зависимости от длительности, стадии и тяжести заболевания.
Величина площади подавления ХЛ составляла:
- в 1-й группе – МЕ 3710 отн. ед. [LQ=2320; UQ=4695];
- во 2-й группе – Ме 8315 отн. ед. [LQ=6143; UQ=12300];
- в 3-й группе – Ме 7415 отн. ед. [LQ=5437; UQ=10239];
- в группе контроля – Ме 14371 отн. ед. [LQ=12706; UQ=16865].
При попарном сравнении групп пациентов с эпилепсией были выявлены достоверно более низкие значения ∆S в 1-й группе по сравнению с 2-й (p=0,0001) и 3-й (р =0,009).
Вероятно, этот факт связан со следующими факторами:
- пациенты с впервые остро возникшими приступами эпилепсии не находились на какой-либо лекарственной терапии, способствующей повышению антиоксидантной устойчивости организма в целом. Это согласуется с установленными нами более высокими уровнями антиоксидантной устойчивости плазмы у пациентов в ремиссии и пациентов с резистентной формой заболевания, которые подвергались лечению противоэпилептическими препаратами;
- у пациентов на ранней стадии эпилепсии происходит дисбаланс активации окислительных и антиоксидантных физиологических процессов: антиокислительные системы не успевают должным образом активироваться в ответ на интенсивные свободно-радикальные процессы, инициируемые острыми эпилептическими приступами.
Как известно, общая антиоксидантная активность плазмы крови в основном определяется содержанием в ней таких веществ, как мочевая кислота, мочевина, альбумин [9]; в меньшей степени это свойство плазмы крови зависит от концентрации в плазме альфа-токоферола, аскорбата, восстановленного глутатиона, билирубина и коэнзима Q [10]. Нами были изучены плазменные концентрации мочевой кислоты, альбумина, билирубина и мочевины, которые у исследуемых пациентов оказались в пределах нормы.
Учитывая этот факт, а также снижение концентрации восстановленных сульфгидрильных групп в плазме крови всех трех опытных групп, можно высказать предположение, что именно снижение содержания восстановленных тиолсодержащих низкомолекулярных антиоксидантов (глутатиона, цистеина и т.д.), вызванное интенсивно протекающими окислительными процессами, оказывает существенное влияние на уровень общей антиоксидантной активности плазмы.
Помимо этого, альбумин, который играет важную роль в системе антиоксидантной защиты плазмы, может находиться в крови как в восстановленном, так и окисленном состоянии. Антиоксидантный эффект способна оказывать только восстановленная форма альбумина. Биохимический анализ крови, на который мы опирались при анализе результатов, дает информацию о суммарной фракции альбумина без учета степени его окисленности. Возможно, у пациентов с эпилепсией повышена доля окисленного альбумина, что сказывается на уровне общей антиоксидантной активности плазмы крови. Данные предположения требуют дальнейшего, более детального исследования.
Для определения антиоксидантного статуса организма нами также изучалась общая супероксид-перехватывающая активность плазмы. Как известно, при участии супероксиддисмутазы (СОД) прерывается цепь свободно-радикальных процессов в начале своего зарождения на стадии одноэлектронного восстановления кислорода с образованием супероксидного анион-радикала.
Общая супероксид-перехватывающая активность плазмы крови пациентов с эпилепсией составляла:
- в 1-й группе – МЕ 0,021 ед. акт/мл [LQ=0,012; UQ=0,025];
- во 2-й группе – Ме 0,013 ед. акт/мл [LQ=0,008; UQ=0,018];
- в 3-й группе – Ме 0,024 ед. акт/мл [LQ=0,019; UQ=0,025];
- в контрольной группе – Ме 0,100 ед. акт/мл [LQ=0,047; UQ=0,257].
Нами было выявлено существенное снижение общей супероксид-перехватывающей активности в плазме крови у пациентов всех трех опытных групп по сравнению с нормальными показателями.
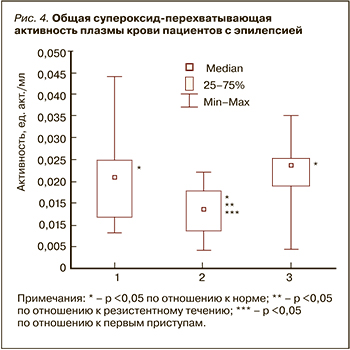 Кроме того, общая супероксид-перехватывающая активность у пациентов, находящихся в медикаментозной ремиссии, оказалась достоверно ниже этого показателя у пациентов с впервые возникшими приступами (p=0,041) и резистентной к лечению формой заболевания (p=0,003) (рис. 4).
Кроме того, общая супероксид-перехватывающая активность у пациентов, находящихся в медикаментозной ремиссии, оказалась достоверно ниже этого показателя у пациентов с впервые возникшими приступами (p=0,041) и резистентной к лечению формой заболевания (p=0,003) (рис. 4).
При измерении активности каталазы, как и в случае с общей супероксид-перехватывающей активностью, нами установлено снижение данного показателя в плазме крови пациентов с эпилепсией в сравнении с показателями у здоровых людей (p <0,05). Достоверные различия при попарном сравнении активности каталазы у пациентов трех опытных групп в данном случае не найдены (p >0,05).
Результаты, полученные нами, согласуются с результатами подобного исследования, в котором не было выявлено какой-либо разницы в уровне активности каталазы плазмы крови у леченых и нелеченых пациентов [11].
Анализируя полученные результаты исследования, можно сделать вывод, что включенные нами в исследование группы больных с эпилепсией (пациенты после первых единичных эпилептических приступов, с ремиссией приступов и эпилептических приступов, резистентных к лечению) могут рассматриваться в рамках единого адаптационного процесса в ответ на эпилептический приступ.
Основным содержанием общего адаптационного синдрома является значительное возбуждение высших вегетативных центров. В результате реализуется эффект высоких концентраций катехоламинов и глюкокортикоидов, что позволяет мобилизовать энергетические и структурные резервы организма. При стресс-синдроме происходит не просто мобилизация энергетических и структурных ресурсов организма, а их дискриминативное перераспределение – передача из систем, не участвующих в адаптации данному конкретному фактору, в системы, специфически ответственные за адаптацию.
Показано, что стресс-реакция, вызванная экстремальным воздействием, влияет на процессы перекисного окисления липидов (ПОЛ) [12]. При экстремальных воздействиях регуляция клетками уровня ПОЛ снижается, и его интенсивность выходит за пределы нормы [13]. Наряду с усилением ПОЛ при стрессе различной этиологии отмечаются явления инактивации АОЗ [14, 15]. Все это приводит к накоплению неспецифических модификаций белков и ферментов, увеличению проницаемости и текучести мембран, нарастанию повреждения в клеточных компартментах, а также к повреждению митохондрий и электрон-транспортному дисбалансу [16].
При повторном действии на организм сильных раздражителей стресс-синдром постепенно угасает по мере того, как формируется системный структурный след, составляющий основу адаптации [17].
Предполагается, что организм располагает регуляторными модуляторными системами, которые сопряжены как со стресс-реализующими гипоталамо-гипофизарно-адреналовой и симпатической системами, так и стресс-лимитирующими, среди которых значимая роль отводится ГАМК-ергической системе. ГАМК-система может ограничивать стресс-реакцию на центральном уровне, а именно на уровне центров адренергической регуляции и на пресинаптическом уровне, лимитируя высвобождение норадреналина из синаптических терминалей [18]; тем самым ограничивается реализация адренергической регуляции на уровне органов-мишеней. В процессе адаптации при многократном повторении стрессорной ситуации функциональные возможности стресс-лимитирующих систем возрастают, и они начинают более эффективно ограничивать длительность и интенсивность возбуждения нервных центров, детерминирующих стресс-реакцию, и более полно блокировать действие стрессорных гормонов на уровне органов-мишеней.
Стадия сформировавшейся долговременной адаптации характеризуется наличием системного структурного следа, отсутствием стресс-синдрома и совершенным приспособлением к определенному фактору или ситуации. При этом снижены функция и структурный резерв других, подавленных доминантой систем. Такое доминирование одних и «разоружение» других систем организма составляет основу успешной, но весьма специализированной адаптации к определенным факторам и вместе с тем может стать предпосылкой болезней одностороннего развития, функциональной несостоятельности других систем [17]. То есть адаптационная программа организма будет иметь значительную структурную «цену».
В соответствии с вышеизложенным пациенты после единичных (первых) эпилептических приступов могут рассматриваться как подвергшиеся острому стрессу с последующим высвобождением высоких концентраций катехоламинов и глюкокортикоидов.
Больные с клинической ремиссией приступов – это пациенты со сформировавшейся долговременной адаптацией, которым путем приспособления удалось избавиться от стресс-синдрома.
Пациенты с резистетной эпилепсией постоянно подвергаются влиянию хронического стресса с одновременным функционированием стресс-реализующей и стресс-лимитирующей систем.
ЗАКЛЮЧЕНИЕ
Таким образом, если эпилепсию рассматривать с позиции адаптационного синдрома, то свободно-радикальные процессы будут выступать неотъемлемым компонентом (звеном) стресс-реакций, которые проявляют себя сразу после действия стресс-фактора и сохраняются в дальнейшем вне зависимости от течения эпилепсии. Учитывая, что в трех группах больных с эпилепсией показатели активности АОЗ достоверно отличаются между собой, можно предположить, что на разных стадиях адаптации реализуются различные звенья окислительного стресса. Также в группах больных с клинической ремиссией и пациентов с резистентной формой заболевания, помимо первичных изменений свободно-радикальных процессов на антиоксидантную устойчивость организма в целом, может оказывать влияние противоэпилептическая фармакотерапия.



