ОПРЕДЕЛЕНИЕ
Остеоартрит (ОА) – гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава: хряща, субхондральной кости, синовиальной оболочки, связок, капсулы, околосуставных мышц.
Остеоартрит характеризуется клеточным стрессом и деградацией экстрацеллюлярного матрикса всех тканей сустава, возникающих на фоне макро- и микроповреждений, при этом активируются ненормальные адаптивные восстановительные ответы, включая провоспалительные пути иммунной системы. Первоначально изменения происходят на молекулярном уровне с последующими анатомическими и физиологическими нарушениями (деградация хряща, костное ремоделирование, образование остеофитов, синовит и т.д.), приводящими к развитию заболевания.
ЭПИДЕМИОЛОГИЯ
Остеоартрит остается актуальной междисциплинарной проблемой. В последние десятилетия в мире наблюдается увеличение распространенности этого заболевания. Согласно отчетам Минздрава России, за 5 лет (с 2013 по 2017) число пациентов с ОА в нашей стране увеличилась на 3,7% и составило более 4,3 млн человек [1]. Между тем эти данные не отражают истинного количества больных, поскольку учитывают только выявленные и зарегистрированные случаи заболевания. Так, результаты масштабного российского эпидемиологического исследования подтверждают, что ОА коленных и (или) тазобедренных суставов выявляется у 13% взрослого населения. Таким образом, истинная численность пациентов с ОА в России может достигать 14–16 млн человек [2].
По результатам глобального исследования бремени болезней 2019 г., ОА выявляется у 7% населения земного шара, что составляет более 500 млн человек. При этом прогнозируется рост числа больных за счет увеличения продолжительности жизни и количества пациентов с избыточной массой тела [3].
КЛАССИФИКАЦИЯ
Выделяют две основные формы ОА – первичный (идиопатический) и вторичный, возникающий на фоне различных заболеваний. Первичный ОА (рис. 1) может быть локальным, когда поражается одна группа суставов, или генерализованным, когда имеется поражение трех суставных групп и более.
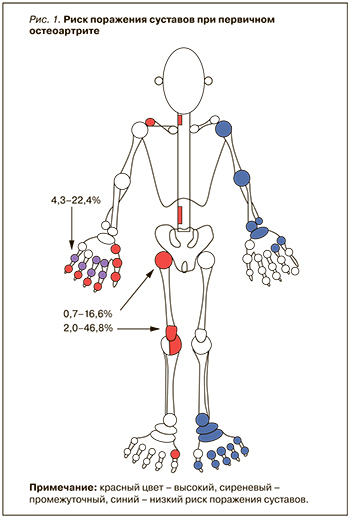
Клиническая классификация ОА
1. Первичный ОА:
- коленные суставы;
- тазобедренные суставы;
- суставы кистей;
- суставы стоп;
- позвоночник;
- другие суставы.
2. Вторичный ОА:
- посттравматический: травмы суставов, переломы или остеонекрозы, хирургические вмешательства на суставе (например, менискэктомия), профессиональное заболевание суставов;
- врожденные, приобретенные, эндемические заболевания: болезнь Блаунта, гемофилии, болезнь Педжета, синдром гипермобильности суставов (синдром Марфана, Элерса–Данлоса и др.), болезнь Легг–Кальве–Пертеса, врожденный вывих бедра, врожденное утолщение вертлужной впадины, эпифизарная дисплазия и другие дисплазии опорно-двигательного аппарата;
- метаболические и эндокринные заболевания: акромегалия, гиперпаратиреоз, охроноз, гемахроматоз, болезнь Вильсона–Коновалова, болезнь Гоше, кристалл-ассоциированные заболевания (подагра, пирофосфатная и гидроксиапатитная артропатия), сахарный диабет, болезнь Шарко;
- другие заболевания костей и суставов: ревматоидный артрит, инфекционные артриты, спондилоартриты и др.
ДИАГНОЗ/ГРУППА ДИАГНОЗОВ В СООТВЕТСТВИИ С МКБ-10
M15–М19 – остеоартрит:
- М15 – первичный генерализованный остеоартроз:
- М15.1 – узлы Гебердена;
- М15.2 – узлы Бушара;
- М16 – коксартроз;
- М17 – гонартроз;
- М18 – артроз 1-го запястно-пястного сустава;
- М19 – другие остеоартрозы.
МЕТОДЫ ДИАГНОСТИКИ ЗАБОЛЕВАНИЯ
Диагноз ОА устанавливается на основании тщательного сбора жалоб, анамнеза и классификационных критериев Американской коллегии ревматологов (ACR). При подозрении на ОА необходимо обращать внимание на особенности суставного синдрома, характерные для этого заболевания.
Клинические и лабораторные методы исследования при подозрении на ОА обобщены в таблицах 1 и 2.
Одним из самых важных рентгенологических симптомов ОА, позволяющих косвенно судить о состоянии суставного хряща, является ширина суставной щели. Согласно рекомендациям WHO/ILAR (World Health Organization/International League of Associations for Rheumatology), ширину суставной щели необходимо измерять в наиболее суженном участке (табл. 3).
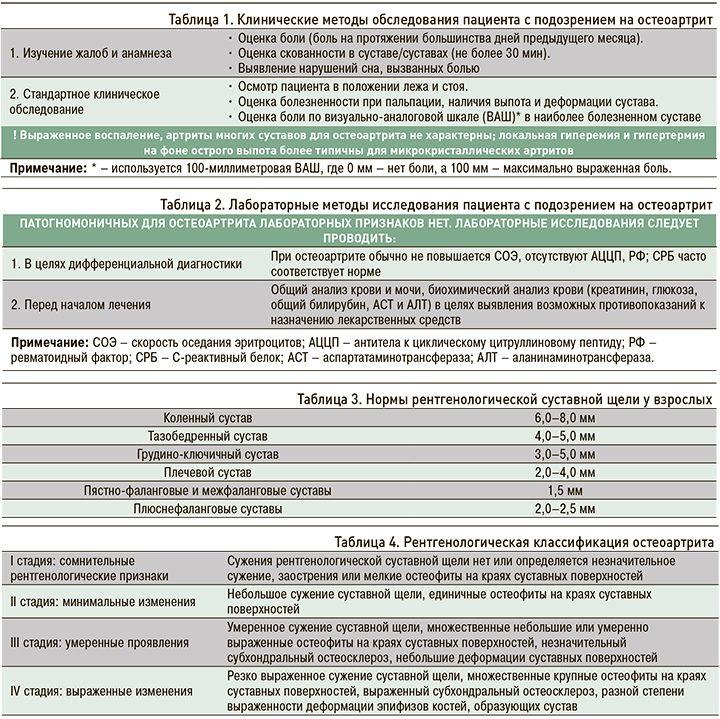
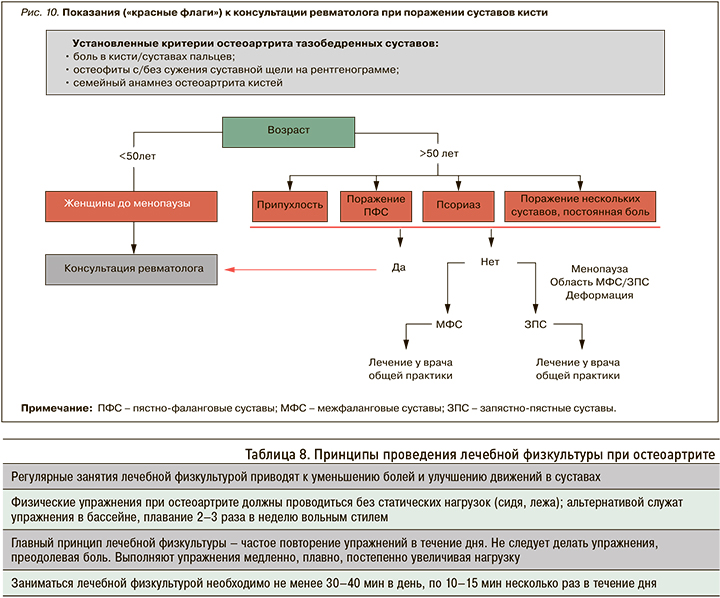
Для определения рентгенологической стадии ОА используют классификацию Kellgren–Lawrence (1957) [4], в соответствии с которой выделяют четыре стадии ОА (табл. 4).
ОСТЕОАРТРИТ КОЛЕННЫХ СУСТАВОВ
Клиническая картина
Характеристика боли при ОА коленных суставов:
- усиливается при ходьбе вниз по лестнице или по пересеченной местности;
- обычно ограничивается передней и медиальной областью коленного сустава и верхней частью голени.
При предполагаемом ОА коленных суставов обязательна оценка оси сустава. В случае выявления нарушенной биомеханики сустава необходимо рекомендовать ортопедические приспособления.
Коррекция нарушений биомеханики суставов проводится с помощью супинаторов и ортезов. Так, при поражении медиального отдела коленного сустава, наличии варусной деформации (рис. 2) могут применяться коленные ортезы, разгружающие медиальные отделы сустава, и ортопедические стельки с приподнятым латеральным краем, при поражении латерального отдела коленного сустава, наличии вальгусной деформации – коленные ортезы, разгружающие латеральные отделы сустава, и также ортопедические стельки.
Диагностика
Для диагностики ОА коленных суставов необходимо руководствоваться классификационными критериями ACR (табл. 5). Соответствующий диагноз возможно установить на основании клинической картины, а также комбинации клинических и рентгенологических критериев.

Визуализационная диагностика
Для рентгенологической диагностики ОА коленных суставов (рис. 3) выполняется рентгенография двух коленных суставов в прямой проекции (в положении стоя с полусогнутыми коленными суставами) и дополнительно в боковой проекции.
У лиц старше 40 лет с болью в коленном суставе, возникающей при нагрузке, c непродолжительной утренней скованностью и одним или несколькими типичными симптомами, выявляемыми при осмотре (крепитация, ограничение движений, костные разрастания), диагноз ОА может быть установлен без рентгенологического исследования или при отсутствии изменений на рентгенограммах.
Алгоритм ведения пациента с остеоартритом коленных суставов в реальной клинической практике
Согласно представленному алгоритму (рис. 4), при обращении пациента с болью в коленном суставе в случае наличия «красных флагов» необходимо направить его на консультацию к ревматологу; в их отсутствие лечение может осуществлять врач общей практики в соответствии с актуальными клиническими рекомендациями [6, 7].
ОСТЕОАРТРИТ ТАЗОБЕДРЕННЫХ СУСТАВОВ
Клиническая картина
При ОА тазобедренных суставов боль часто локализуется в паховой области, усиливаясь при внутренней ротации сустава. В то же время боль может отмечаться в коленном суставе, по наружной поверхности бедра, ягодице, поясничной области, что затрудняет диагностику.
При болях в коленных суставах необходимо обязательно определять внутреннюю ротацию в тазобедренных суставах для исключения отраженных болей при ОА тазобедренных суставов.
Диагностика
Для диагностики ОА тазобедренных суставов необходимо руководствоваться классификационными критериями ACR, включающих комбинацию клинических и рентгенологических признаков (табл. 6).
Визуализационная диагностика
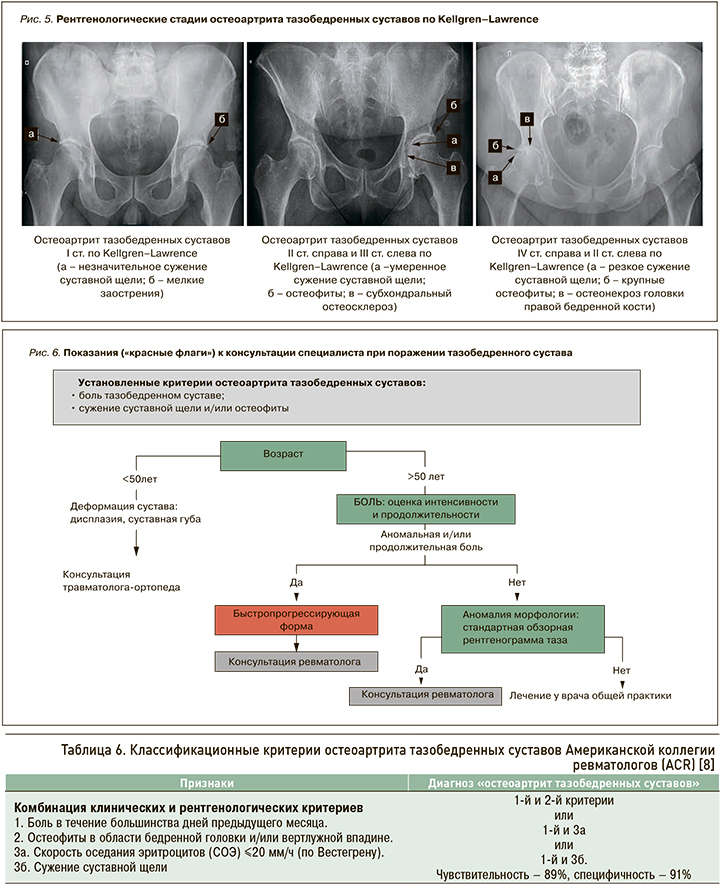
При подозрении на ОА тазобедренных суставов всем пациентам необходимо проводить обзорную рентгенографию таза (рис. 5) с внутренней ротацией стоп под углом 20° с захватом обоих тазобедренных суставов и проксимальных отделов бедренных костей.
Алгоритм ведения пациента с остеоартритом тазобедренных суставов в реальной клинической практике
Согласно представленному ниже алгоритму (рис. 6), при обращении пациента с болью в тазобедренном суставе в случае наличия «красных флагов» необходимо направить его на консультацию к ревматологу; в их отсутствие лечение может осуществлять врач общей практики в соответствии с актуальными клиническими рекомендациями [6, 7].
ОСТЕОАРТРИТ СУСТАВОВ КИСТЕЙ
Клиническая картина
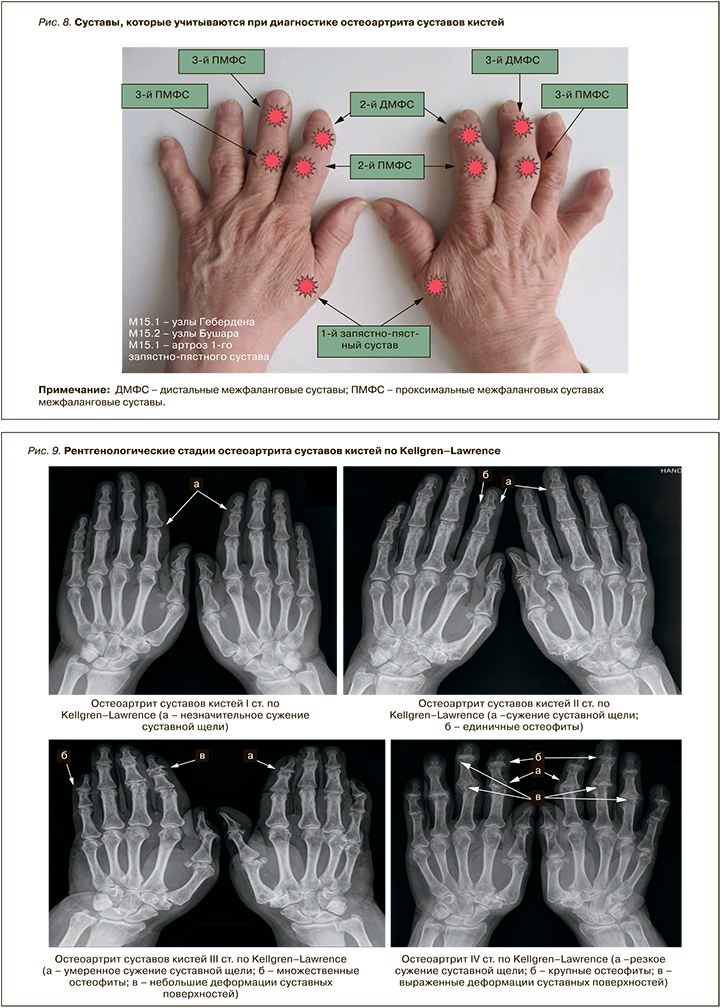
К типичным симптомам ОА суставов кистей относятся боль при движении и незначительная утренняя скованность или тугоподвижность в одном или нескольких суставах в любое время суток на протяжении большинства дней предыдущего месяца. Симптомы обычно имеют интермиттирующее течение и возникают в дистальных межфаланговых (ДМФС) и проксимальных межфаланговых суставах (ПМФС).
Типичные клинические признаки ОА суставов кистей — узелки Гебердена (костные разрастания в области ДМФС) и Бушара (костные разрастания в области ПМФС; рис. 7).
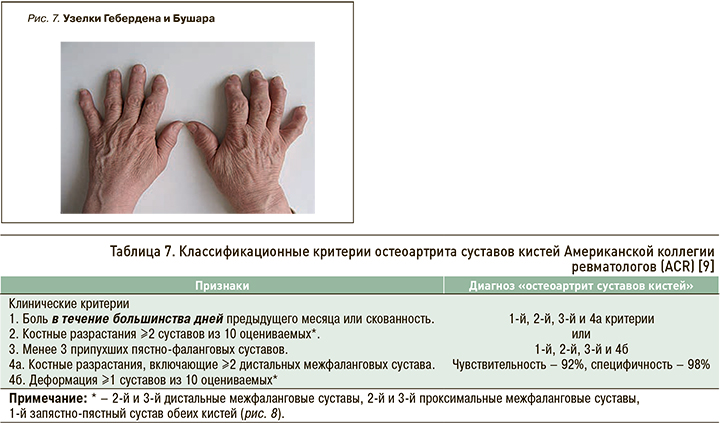
У больных с узелковой формой ОА повышается риск развития ОА коленных, тазобедренных и других суставов (генерализованная форма).
Диагностика
Для диагностики ОА суставов кистей необходимо руководствоваться классификационными критериями ACR (табл. 7). Соответствующий диагноз возможно установить, основываясь только на клинической картине заболевания.
Визуализационная диагностика
При ОА суставов кистей проводится обзорная рентгенография двух кистей в прямой проекции на одном снимке (рис. 9). Рентгенографию рекомендуется выполнять только при проведении дифференциальной диагностики. У части пациентов с ОА суставов кистей встречается эрозивная форма заболевания, когда в межфаланговых суставах определяются деформации по типу «крыльев чайки» или «зубьев пилы». При выявлении суставных эрозий необходима дифференциальная диагностика ОА суставов кистей с ревматоидным артритом.
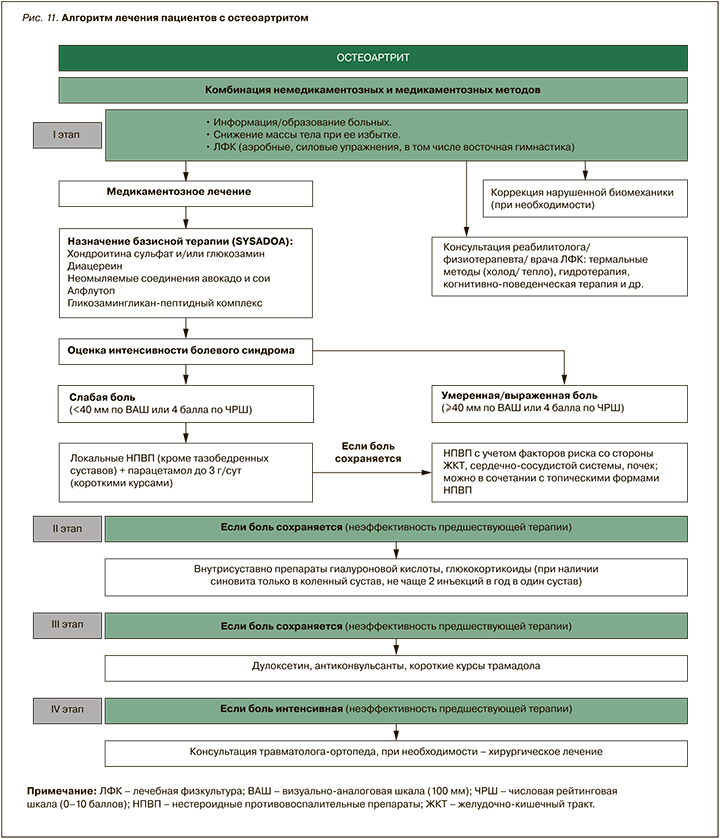
Алгоритм ведения пациента с остеоартритом суставов кистей в реальной клинической практике
Согласно представленному ниже алгоритму (рис. 10), при обращении пациента с болью в кисти/суставах кистей в случае наличия «красных флагов» необходимо направить его на консультацию к ревматологу; в их отсутствие лечение может осуществлять врач общей практики в соответствии с актуальными клиническими рекомендациями [6, 7].
ПРАВИЛА ФОРМУЛИРОВКИ ДИАГНОЗА
- Диагноз ОА устанавливается на основании классификационных критериев ACR.
- Необходимо указывать локализацию процесса: коленные и тазобедренные суставы, суставы кистей, иные суставы. Если речь идет о поражении не менее 3 групп суставов, следует использовать термин «генерализованный остеоартрит».
- При формулировке диагноза необходимо указывать рентгенологическую стадию по Kellgren–Lаwrenсe. Хотя тяжесть рентгенологических изменений не всегда коррелирует с выраженностью боли и функциональными нарушениями, рентгенологическая картина может быть полезна при проведении дифференциальной диагностики, выявлении осложнений (например, развития остеонекроза) и формулировки показаний для эндопротезирования крупных суставов.
- Следует вносить в диагноз осложнения ОА и сопутствующую патологию околосуставных мягких тканей (например, синовит, энтезит), наличие деформации.
Примеры формулировки диагноза
- Остеоартрит коленных суставов 3 ст., синовит правого коленного сустава. Варусная деформация коленных суставов. Поперечное плоскостопие. ФН 2.
- Остеоартрит генерализованный: с вовлечением суставов позвоночника, узелковая форма (узелки Гебердена, Бушара), двусторонний остеоартрит тазобедренных суставов 2 ст., двусторонний остеоартрит коленных суставов 3 ст. справа и 2 ст. слева. ФН 2.
АЛГОРИТМ ЛЕЧЕНИЯ ПАЦИЕНТОВ С ОСТЕОАРТРИТОМ
В представленном алгоритме (рис. 11) еще раз подчеркивается необходимость назначения комбинации фармакологических и нефармакологических методов лечения сразу же после установления диагноза ОА. Так, обязательным компонентом всех терапевтических программ является образование пациентов, которое проводится с учетом индивидуальных особенностей больного и включает информацию о заболевании, рекомендации по изменению образа жизни, снижению массы тела и необходимости выполнения физических упражнений. Основная цель программ обучения – повышение эффективности выполняемой терапии путем активного вовлечения пациента в лечебный процесс. Такие программы должны быть организованы на постоянной основе с привлечением волонтерского движения. В частности, действующая в настоящее время Всероссийская социально-профилактическая программа «Здоровье суставов в надежных руках», разработанная при поддержке НИИР им. В.А. Насоновой, Ассоциации ревматологов России, Российского научного медицинского общества терапевтов и компании «Биотехнос» с участием волонтерских организаций, способствует не только образованию пациентов, что оказывает положительное влияние на симптомы заболевания, функцию суставов и качество жизни, но и уменьшению числа визитов к врачу и повышению комплаентности лечения.
В последних опубликованных систематических метаанализах было показано, что снижение веса, особенно в сочетании с лечебной физкультурой (табл. 8), вызывает уменьшение боли, улучшение функционального состояния суставов, позитивно влияет на структурные изменения в хряще и биохимические маркеры обмена хряща и кости. Недавние результаты крупномасштабного исследования убедительно продемонстрировали, что потеря веса на 1% снижает риски тотального эндопротезирования коленного сустава на 2% [10].
С первых шагов при отсутствии противопоказаний пациентам с ОА рекомендовано физиотерапевтическое лечение. При этом выбор того или иного метода физиотерапии должен носить индивидуализированный характер с учетом показаний и противопоказаний (например, при наличии признаков воспаления в суставе предпочтительнее криотерапия и т.д.) и мультиморбидности.
При обращении пациента в медицинское учреждение, в том числе к врачу общей практики, необходимо определить нарушения биомеханики конечностей (варусная или вальгусная деформация, плоскостопие и др.) и рекомендовать ортезы, супинаторы. Для разгрузки суставов при продвинутых стадиях ОА рекомендуется хождение с тростью в руке (противоположной пораженной конечности), использование костылей или других вспомогательных приспособлений.
Основу медикаментозного лечения ОА составляют симптоматические препараты замедленного действия (SYSADOA), которые назначаются сразу после установления диагноза (табл. 9). Выбор инъекционной или пероральной формы препарата зависит от клинической ситуации, пожеланий пациента и решения врача. По результатам международных исследований, симптоматический эффект SYSADOA при приеме пероральных средств проявляется на 4–12-й неделе. По данным российских исследований, значимый анальгетический эффект при парентеральном применении SYSADOA наступает через 20 дней. В настоящее время есть серьезные доказательства симптоматического и противовоспалительного действия этих препаратов и их способности замедлять прогрессирование ОА при длительном их применении.
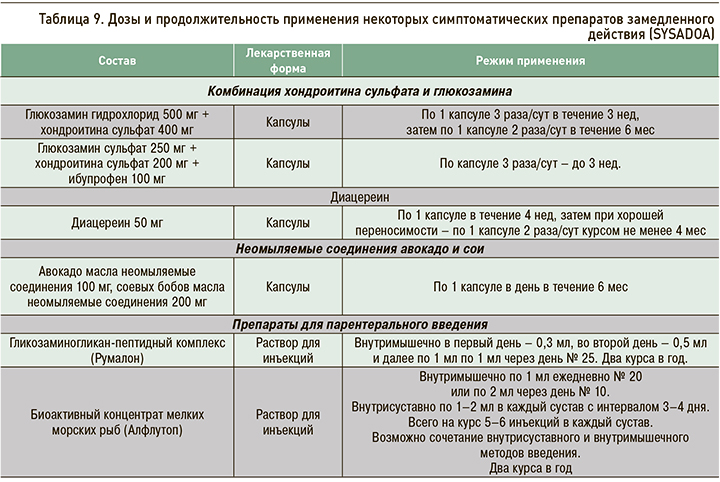
Важное преимущество SYSADOA – возможность на фоне их применения снижения дозы или полной отмены нестероидных противовоспалительных препаратов (НПВП). Это приводит к уменьшению частоты неблагоприятных явлений (НЯ), связанных с использованием НПВП.
Применение SYSADOA должно быть длительным. Симптоматический эффект от применения пероральных препаратов развивается через 4–12 нед после начала применения. Для реализации структурно-модифицирующего действия препаратов продолжительность лечения должна составлять не менее 2 лет.
Для определения дальнейшей тактики лечения ОА врачу необходимо оценить интенсивность боли в наиболее болезненном суставе. Если боль слабая (до 40 мм по ВАШ), то назначаются локальные формы НПВП или парацетамол. У больных с умеренной или сильной болью в суставах целесообразно использование системных НПВП (при отсутствии противопоказаний).
Локальные формы НПВП обладают хорошим обезболивающим эффектом. Согласно данным систематического обзора и метаанализа 2021 г., НПВП для наружного применения при ОА коленного сустава имеют значимое превосходство над плацебо по анальгетическому действию (стандартизированная разность средних (SMD)=0,365; 95% ДИ: 0,24–0,49) и способствуют улучшению функциональной способности (SMD=0,354; 95% ДИ: 0,268–0,493) [11]. Препараты этой группы следует применять в течение 2 нед с кратностью не менее 3–4 раза/сут. Необходимо соблюдать и рекомендации по дозировке локальных средств (табл. 10). При поражении тазобедренных суставов топические НПВП использовать нецелесообразно.

Локальные формы НПВП, благодаря низкой системной абсорбции, характеризуются высоким профилем безопасности. Эти препараты не увеличивают риск развития класс-специфических нежелательных явлений со стороны желудочно-кишечного тракта, сердечно-сосудистой системы и почек, что дает возможность назначать их пациентам с выраженной мультиморбидностью.
Парацетамол может назначаться пациентам со слабым болевым синдромом, а также при наличии противопоказаний к пероральным НПВП, но не более 3 г/сут (непродолжительными курсами). В последние годы появилась информация о недостаточной эффективности препарата. Представленные в 2017 г. в журнале Lancet [12] результаты сетевого метаанализа свидетельствуют о том, что эффективность парацетамола в дозах 3900–4000 мг/сут незначительно выше плацебо (размер эффекта (ES)=-0,16; 95% ДИ: от -0,27 до -0,06). В связи с этим авторы высказали мнение, что монотерапия ОА парацетамолом не оправдана. Кроме того, на фоне его приема отмечена высокая частота развития НЯ со стороны сердечно-сосудистой системы, желудочно-кишечного тракта (ЖКТ), печени и почек, особенно на фоне высоких суточных доз. В 2019 г. Conaghan P.G. et al. [13] представили обзор литературы, где подтвердились опасения по поводу профиля безопасности парацетамола, причем риски развития НЯ возрастали при увеличении дозы и длительности приема препарата. В то же время последний Кокрановский систематический обзор (n=3541) не выявил увеличения риска НЯ на фоне приема парацетамола, однако подтвердил незначительный симптоматический эффект этого анальгетика (абсолютное снижение боли составило всего 3%; 95% ДИ: 1–5%) [14].
Системные формы НПВП занимают центральное место в фармакотерапии болевого синдрома при ОА, обладая хорошим анальгетическим потенциалом [15]. Систематический обзор и метаанализ (2020), включивший 72 рандомизированных контролируемых исследований (n=26 424), еще раз подтвердил значимое обезболивающее действие этих препаратов (SMD=-0,43; 95% ДИ: от -0,48 до -0,38), достигающее максимума к 10–14-му дням лечения [16]. Вместе с тем было обращено внимание на то, что эффективность НПВП снижается при длительном приеме (3–6 мес). Идентичная закономерность была отмечена и при оценке функции суставов: максимальное улучшение функциональной способности наблюдалось через 2 нед лечения (SMD=-0,45; 95% ДИ: от -0,52 до -0,38) со значительным снижением эффекта к 26-й неделе (SMD=-0,19; 95% ДИ: -0,32 до 0,07). Кроме того, авторы еще раз продемонстрировали, что применение НПВП ассоциируется с увеличением НЯ со стороны ЖКТ (относительный риск (ОР) 1,36; 95% ДИ: 1,25–1,49) и сердечно-сосудистой системы (ОР 1,37; 95% ДИ: 1,05–1,77). Большинство желудочно-кишечных и сердечно-сосудистых НЯ было преходящим и легкой степени тяжести; наиболее часто развивались диспепсия, диарея, периферические отеки, повышение артериального давления. Таким образом, назначая НПВП, врач всегда должен учитывать наличие факторов риска НЯ (прежде всего при мультиморбидности) и выбирать препараты с наилучшим профилем безопасности.
В рутинной клинической практике назначение НПВП сопряжено с рядом сложностей, в частности с отсутствием мониторинга НЯ и учета мультиморбидных состояний, неоправданно длительными курсами лечения, одновременным назначением пациенту нескольких препаратов этой группы, что приводит к значимому увеличению риска осложнений без увеличения эффективности. При лечении пациентов с ОА целесообразно ограничивать прием НПВП не только в плане дозировки, но и продолжительности приема.
Важнейшее значение при выборе НПВП имеет сопутствующая патология: артериальная гипертензия, ишемическая болезнь сердца, сахарный диабет, метаболический синдром, заболевания ЖКТ, депрессия и др. В связи с этим при подборе НПВП следует руководствоваться клиническими рекомендациями «Рациональное использование нестероидных противовоспалительных препаратов» [17], где представлен алгоритм назначения лекарственных средств этого класса с учетом сопутствующей патологии (табл. 11).

Важно знать:
- эффективность как селективных, так и неселективных НПВП сопоставима и зависит от дозы;
- необходим дифференцированный подход к выбору НПВП в зависимости от наличия у пациента сопутствующих заболеваний;
- у пациентов при наличии факторов риска развития НПВП-гастропатии необходимо сочетать назначение селективных НПВП с ингибиторами протонной помпы;
- при наличии сердечно-сосудистых заболеваний НПВП применяются в минимальной эффективной дозе на короткие сроки. НЯ со стороны сердечно-сосудистой системы свойственны всем препаратам НПВП. Риск их развития зависит от индивидуальных характеристик препарата и используемой дозы, но не от селективности в отношении циклооксигеназы-2 (ЦОГ-2). Противопоказанием для назначения любых НПВП является очень высокий риск кардиоваскулярных осложнений (инфаркт миокарда, острый коронарный синдром, ишемический инсульт, декомпенсированная хроническая сердечная недостаточность и др.), прием двойной/тройной антикоагулянтной терапии;
- прием любых НПВП может спровоцировать развитие острой почечной недостаточности, особенно в первый месяц лечения. Этот риск снижен у пациентов с нормальной функцией почек. Пациентам со скоростью клубочковой фильтрации менее 30 мл/мин прием НПВП не рекомендован;
- при назначении НПВП следует учитывать возможность лекарственных взаимодействий. Не рекомендован одновременный прием НПВП из различных групп, так как при этом значимо повышается риск развития НЯ;
- принимать решение об изменении НПВП-терапии рекомендуется через 10–14 дней от начала лечения препаратами этой группы.
II–IV этапы лечения остеоартрита
Следующие этапы лечения (II–IV) ОА необходимо проводить при неэффективности I шага терапии. Они подразумевают консультацию пациентов врачами-ревматологами, а при необходимости – травматологами-ортопедами.
При наличии противопоказаний к применению НПВП или недостаточного ответа на проводившуюся ранее терапию (нефармакологические методы, SYSADOA, локальные и/или системные НПВП) врачу первичного звена необходимо направить пациента на консультацию к специалисту (ревматологу).
Эффективность проводимой терапии оценивается по ВАШ. Под недостаточным ответом на проводимую терапию понимается сохранение боли в анализируемом суставе (наиболее болезненном) более 40 мм.



