АКТУАЛЬНОСТЬ
Увеличение продолжительности жизни и постарение населения привели к более высокой распространенности хронических неинфекционных заболеваний, в том числе патологий опорно-двигательного аппарата. После сердечно-сосудистых заболеваний, злокачественных новообразований и хронических болезней органов дыхания нарушения опорно-двигательного аппарата – четвертая по значимости причина заболеваемости пожилых людей.
Наиболее распространенным заболеванием суставов является остеоартрит (ОА). По статистическим данным Минздрава России, в 2017 г. ОА болели свыше 4,3 млн человек при устойчивой тенденции ежегодного прироста новых случаев заболевания [1]. Однако эти данные существенно ниже, чем реальное количество больных, поскольку учитываются только зарегистрированные случаи болезни. Результаты крупномасштабного эпидемиологического исследования, проведенного Институтом ревматологии, выявили ОА коленных и(или) тазобедренных суставов у 13% взрослого населения России [2]. Следовательно, истинное количество пациентов с ОА в нашей стране может достигать 14–16 млн человек. По оценке глобального исследования бремени болезней за 2019 г., ОА имеет место у 7% населения земного шара, что превышает 500 млн человек; при этом прогнозируется дальнейшее возрастание числа больных за счет увеличения продолжительности жизни и пандемии ожирения [3].
ОА оказывает существенную финансовую нагрузку на общество в целом за счет инвалидизации пациентов и повышенной летальности. Недавно опубликованный обзор метаанализов (2020) еще раз подтвердил, что при ОА, независимо от локализации поражения, значимо увеличивается коэффициент риска (КР) как общей летальности (КР 1,18–1,23), так и смертности, связанной с кардиоваскулярными катастрофами (КР 1,21–1,53) [4].
За последние десятилетия представления об ОА претерпели значительную эволюцию – от дегенеративного процесса до «воспалительной» болезни, где центральная роль принадлежит низкоинтенсивному воспалению (low-grade inflammation). В 2015 г. Международное общество по изучению ОА (Osteoarthritis Research Society International, OARSI) представило новое определение этой патологии: «ОА – заболевание суставов, характеризующееся клеточным стрессом и деградацией экстрацеллюлярного матрикса, возникающими при макро- или микроповреждениях, которые активируют ненормальные адаптивные восстановительные процессы, включая провоспалительные пути иммунной системы». На первых этапах изменения происходят на молекулярном уровне (нарушение метаболизма тканей сустава) с последующими анатомическими и физиологическими нарушениями (деградация хряща, костное ремоделирование, образование остеофитов, воспаление и т.д.) [5]. Новое понимание патогенеза способствовало инициации большого количества исследований, изучающих перспективные молекулы и лекарственные средства, которые потенциально могли бы модифицировать течение ОА и/или оказывать протективный эффект на хрящ. В настоящее время лечение ОА с применением комплексного воздействия нефармакологических и фармакологических методов направлено не только на купирование/уменьшение болевого синдрома, но и на улучшение функционального состояния суставов, физической, профессиональной и социальной активности пациента, а также на замедление прогрессирования заболевания.
Вместе с тем рекомендованные методы ведения пациентов с ОА не всегда в полной мере используются в клинической практике. Около 40% больных не удовлетворены проводимым лечением, диагностические процедуры часто непоследовательны, а поведенческие и реабилитационные методы лечения ОА, как правило, используются недостаточно [6]. Кокрановский систематический обзор показал, что обучение врачей общей практики (ВОП) по ведению больных ОА в соответствии с существующими рекомендациями может улучшить результаты лечения пациентов. Тем более что врач первичного звена курирует 64% пациентов с легким, 50,5% – со средним и 44,5% – с тяжелым течением ОА. Для сравнения: по данным, приведенным на конгрессе EULAR в 2020 г., в случае травматологов-ортопедов аналогичные показатели составляют 20,4, 25,4 и 35,5%, а в случае ревматологов – 15,7, 24,1 и 20%. Таким образом, роль терапевта/ВОП в улучшении непосредственных и отдаленных исходов этого потенциально инвалидизирующего заболевания очевидна.
Действительно ОА – мультидисциплинарная проблема, и ведение пациентов с этим заболеванием осуществляют специалисты различного профиля. В нашей стране в сентябре 2021 г. были утверждены клинические рекомендации Минздрава России по диагностике и лечению ОА коленных и тазобедренных суставов, в создании которых принимали участие специалисты трех ассоциаций: травматологи-ортопеды, ревматологи и реабилитологи. Однако в этих руководствах недостаточно освещены вопросы диагностики и консервативных методов терапии, хотя и представлены основные группы лекарственных средств, применяемых в настоящее время. Остаются вопросы о последовательности назначения таких препаратов, основных показаниях и противопоказаниях к их использованию и др. Кроме этого, в данных руководствах не сделан акцент на маршрутизацию пациентов, т.е. не рассмотрено подробно, в каких случаях целесообразно направить больного на консультацию к ревматологу, реабилитологу или травматологу-ортопеду.
В 2018 г. международной группой экспертов из Канады, Франции, России, Марокко, Португалии и Бельгии были созданы простые алгоритмы ведения пациентов с ОА, предназначенные преимущественно для врачей первичного звена здравоохранения. Они включают критерии диагностики, варианты оказания медицинской помощи, а также ситуации («красные флаги»), требующие направления больного к специалисту, в первую очередь к ревматологу [7]. Эти алгоритмы разработаны для трех основных локализаций ОА – коленных, тазобедренных суставов и суставов кистей. Согласно им, если при первичном обращении у пациента с болью в суставах имеются «красные флаги», необходимо сразу направить больного на консультацию к ревматологу, если же таковых нет, то лечение может осуществлять ВОП согласно национальным клиническим рекомендациям.
Эксперты данного консенсуса после внесения незначительных правок, которые помогут упростить работу врачей в реальной клинической практике нашей страны, единогласно одобрили эти алгоритмы (рис. 1–3).
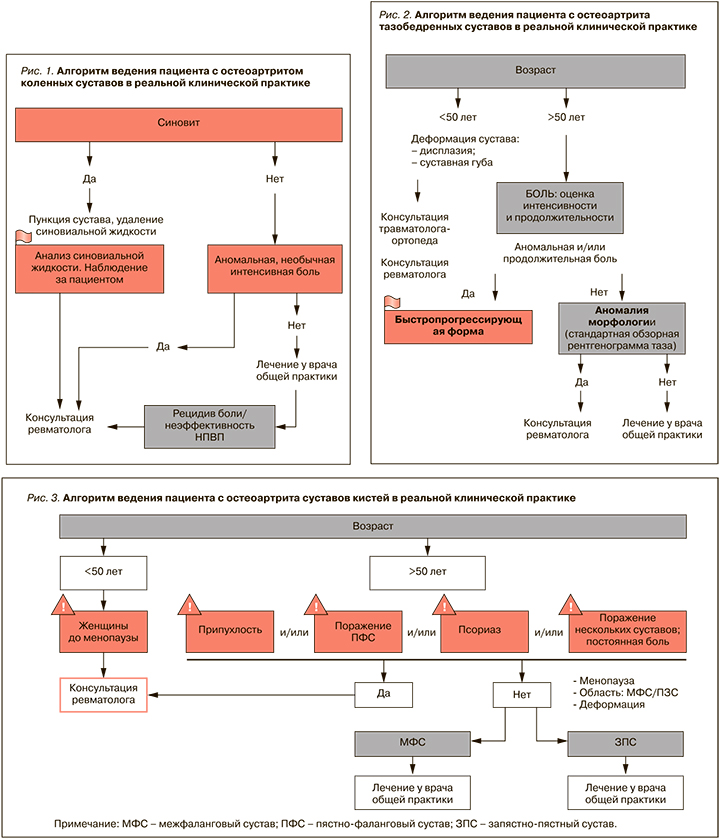
Критерии диагностики ОА коленного сустава:
- боль в коленном суставе;
- возраст старше 50 лет;
- остеофиты и/или сужение суставной щели на рентгенограмме (давностью <6 мес).
Критерии диагностики ОА тазобедренных суставов:
- боль в тазобедренных суставов;
- сужение суставной щели и/или наличие остеофитов.
Критерии диагностики ОА суставов кистей:
- боль в кисти/суставах пальцев;
- остеофиты с/без сужения суставной щели на рентгенограмме;
- семейный анамнез ОА кистей.
Группой российских специалистов был разработан свой – простой и последовательный четырехэтапный алгоритм лечения пациентов с ОА. Этот алгоритм (рис. 4) поддержан всеми экспертами и согласуется с имеющимися рекомендациями Европейского общества по клиническим и экономическим аспектам остеопороза, остеоартрита и мышечно-скелетных заболеваний 2019 г. (European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases, ESCEO) по лечению ОА коленного сустава [8], но в то же время имеет незначительные отличия, позволяющие использовать его при терапии ОА любой локализации.
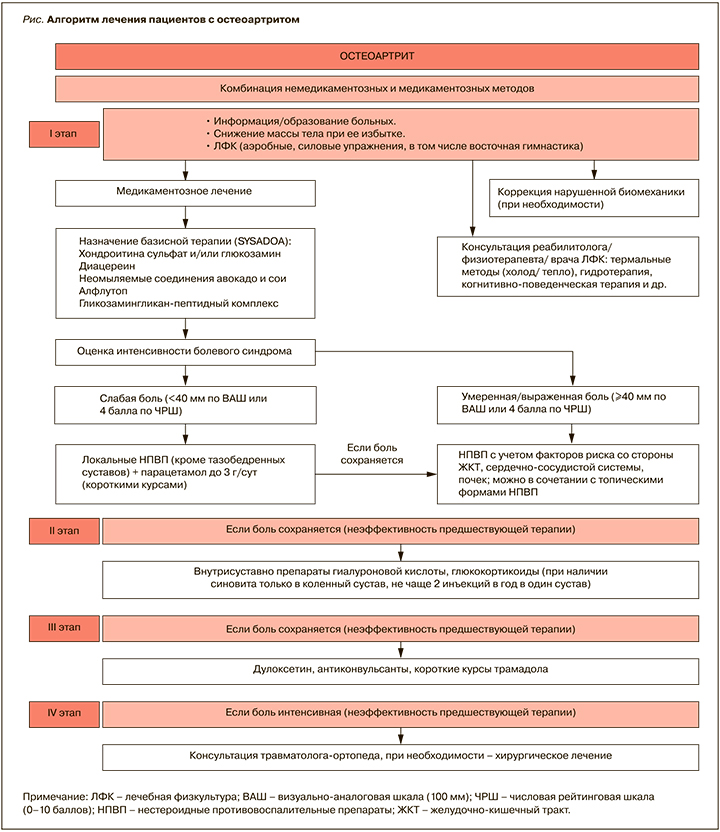
В данном алгоритме терапия ОА включает комбинацию немедикаментозных методов (образовательные программы, лечебная гимнастика, кинезиотерапия, коррекция нарушенной биомеханики суставов, физиотерапевтические методы, когнитивно-поведенческая терапия и др.), применение лекарственных препаратов с обязательным учетом мультиморбидности, а также при необходимости различные хирургические вмешательства. Такой комплексный подход дает возможность улучшить состояние пациента, а именно снизить или купировать болевой синдром, улучшить функциональную и профессиональную активность, психологическое состояние и качество жизни в целом [9].
В представленном алгоритме еще раз подчеркивается необходимость назначения комбинации фармакологических и нефармакологических методов лечения сразу же после установления диагноза ОА. Так, обязательным компонентом всех терапевтических программ служит образование пациентов, которое проводится с учетом индивидуальных особенностей больного и включает информацию о заболевании, рекомендации по изменению образа жизни, снижению массы тела и необходимости выполнения физических упражнений. Основная цель программ обучения – повышение эффективности проводимой терапии путем активного вовлечения пациента в лечебный процесс. Такие программы должны быть организованы на постоянной основе с привлечением волонтерского движения. В частности, действующая в настоящее время Всероссийская социально-профилактическая программа «Здоровье суставов в надежных руках», разработанная при поддержке НИИР им. В.А. Насоновой, Ассоциации ревматологов России, Российского научного медицинского общества терапевтов и компании «Биотехнос» с участием волонтерских организаций, способствует не только образованию пациентов, что оказывает положительное влияние на симптомы заболевания, функцию суставов и качество жизни, но также уменьшению числа визитов к врачу и повышению комплаентности лечения.
В последних опубликованных систематических метаанализах было показано, что снижение веса, особенно в сочетании с лечебной физкультурой (табл. 1), вызывает уменьшение боли, улучшение функционального состояния суставов, позитивно влияет на структурные изменения в хряще и биохимические маркеры обмена хряща и кости. Недавние результаты крупномасштабного исследования убедительно продемонстрировали, что потеря веса на 1% снижает риски тотального эндопротезирования коленного сустава на 2% [10].

С первых шагов при отсутствии противопоказаний пациентам с ОА рекомендовано физиотерапевтическое лечение. При этом выбор того или иного метода физиотерапии должен носить индивидуализированный характер с учетом показаний и противопоказаний (например, при наличии признаков воспаления в суставе предпочтительнее криотерапия и т.д.) и мультиморбидности.
При первичном обращении пациента в медицинское учреждение, в том числе к ВОП, необходимо определить нарушения биомеханики конечностей (варусная или вальгусная деформация, плоскостопие и др.) и рекомендовать ортезы, супинаторы. Для разгрузки суставов при продвинутых стадиях ОА рекомендуется хождение с тростью в руке (противоположной пораженной конечности), использование костылей или других вспомогательных приспособлений.
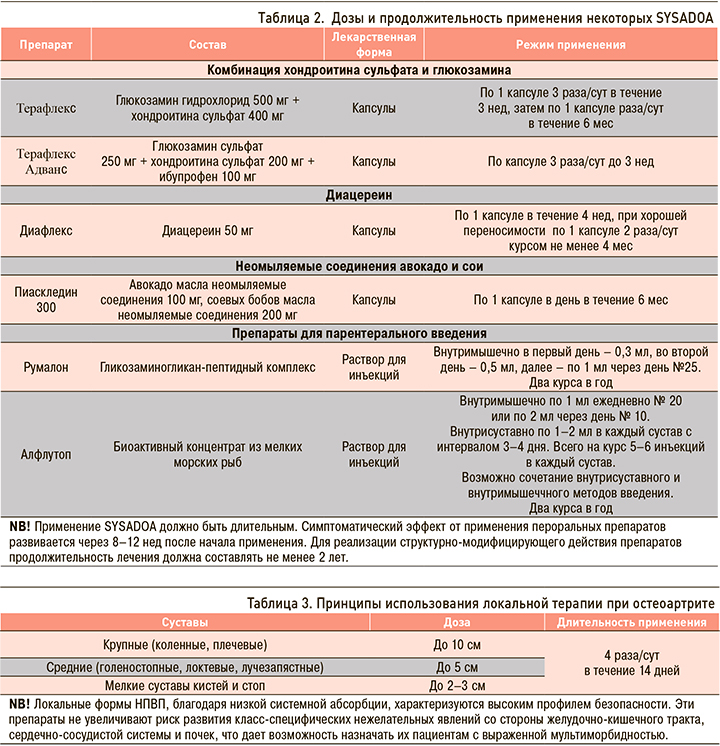
Основу медикаментозного лечения ОА составляют симптоматические препараты замедленного действия (SYSADOA), которые назначаются сразу после установления диагноза (табл. 2). Выбор инъекционной или пероральной формы препарата зависит от клинической ситуации, желания пациента и решения врача. По результатам международных исследований, симптоматический эффект SYSADOA при приеме пероральных средств проявляется на 4–12 нед. По данным российских исследований, значимый анальгетический эффект при парентеральном применении SYSADOA наступает через 20 дней. В настоящее время есть серьезные доказательства симптоматического и противовоспалительного действия этих препаратов и их способности замедлять прогрессирование ОА при длительном применении.
Важное преимущество SYSADOA – возможность на фоне их приема снижения дозы или полной отмены нестероидных противовоспалительных препаратов (НПВП). Это приводит к уменьшению частоты неблагоприятных явлений (НЯ), связанных с использованием НПВП.
Для определения дальнейшей тактики лечения ОА врачу необходимо оценить интенсивность боли в наиболее болезненном суставе. Если боль слабая (до 40 мм по визуально-аналоговой шкале, ВАШ), то назначаются локальные формы НПВП или парацетамол. У больных с умеренной или сильной болью в суставах целесообразно использование системных НПВП (при отсутствии противопоказаний).
Локальные формы НПВП обладают хорошим обезболивающим эффектом. Согласно данным систематического обзора и метаанализа 2021 г., НПВП для наружного применения при ОА коленного сустава имеют значимое превосходство над плацебо по анальгетическому действию (SMD=0,365; 95% ДИ: 0,24–0,49) и способствуют улучшению функциональной способности (SMD=0,354; 95% ДИ: 0,268–0,493) [11]. Препараты этой группы следует применять в течение 2 нед с кратностью не менее 4 раз/сут. Необходимо соблюдать и рекомендации по дозировке локальных средств: до 10 см мази/геля на крупные суставы (плечевые, коленные), до 5 см – на средние (голеностопные, локтевые, лучезапястные) и до 2–3 см – на мелкие (суставы кистей и стоп; табл. 3). Топические НПВП нецелесообразно использовать при поражении тазобедренных суставов.
Парацетамол может назначаться пациентам со слабым болевым синдромом, а также при наличии противопоказаний к пероральным НПВП, но не более 3 г/сут (непродолжительными курсами). В последние годы появилась информация о недостаточной эффективности препарата. Представленные в 2017 г. в журнале Lancet [12] результаты сетевого метаанализа свидетельствуют, что парацетамол в дозах 3900–4000 мг незначительно лучше плацебо (размер эффекта (ES) =-0,16; 95% ДИ: от -0,27 до -0,06). В связи с этим авторы высказали мнение, что монотерапия ОА парацетамолом не оправдана. Кроме того, на фоне его приема отмечена высокая частота развития НЯ со стороны сердечно-сосудистой системы, желудочно-кишечного тракта (ЖКТ), печени и почек, особенно на фоне высоких суточных доз. В 2019 г. Conaghan P.G. и соавт. [13] представили обзор литературы, где подтвердились опасения по поводу профиля безопасности парацетамола, причем риски развития НЯ возрастали при увеличении дозы и длительности приема препарата. В то же время последний Кокрановский систематический обзор (n=3541) не выявил увеличения риска НЯ, однако подтвердил незначительный симптоматический эффект парацетамола (абсолютное снижение боли на 3%; 95% ДИ: 1–5%) [14].
НПВП занимают центральное место в фармакотерапии болевого синдрома при ОА, обладая хорошим анальгетическим потенциалом [15]. Систематический обзор и метаанализ (2020), включивший 72 рандомизированных контролируемых исследования (n=26 424), еще раз подтвердил значимое обезболивающее действие этих препаратов (SMD=-0,43; 95% ДИ: от -0,48 до -0,38), достигающее максимума к 10–14-му дням лечения [16]. Вместе с тем было обращено внимание на то, что эффективность НПВП снижается при длительном приеме (3–6 мес). Идентичная закономерность была отмечена и при оценке функции суставов: максимальное улучшение функциональной способности выявлялось через 2 нед лечения (SMD=- 0,45; 95% ДИ: от -0,52 до -0,38) со значительным снижением эффекта к 26-й неделе (SMD=-0,19; 95% ДИ: -0,32 до 0,07). Кроме того, авторы еще раз продемонстрировали, что применение НПВП ассоциируется с увеличением НЯ со стороны ЖКТ (относительный риск (ОР) 1,36; 95% ДИ: 1,25–1,49) и сердечно-сосудистой системы (ОР 1,37; 95% ДИ: 1,05–1,77). Большинство желудочно-кишечных и сердечно-сосудистых НЯ было преходящим и легкой степени тяжести; наиболее часто развивались диспепсия, диарея, периферические отеки, повышение артериального давления. Таким образом, назначая НПВП, врач всегда должен учитывать наличие факторов риска НЯ (прежде всего при мультиморбидности) и выбирать препараты с наилучшим профилем безопасности.
В рутинной клинической практике назначение НПВП сопряжено с рядом сложностей, в частности с отсутствием мониторинга НЯ и учета мультиморбидных состояний, неоправданно длительными курсами лечения, одновременным назначением пациенту нескольких препаратов этой группы, что приводит к значимому увеличению риска осложнений, без увеличения эффективности. При лечении пациентов с ОА целесообразно ограничивать прием НПВП не только в плане дозировки, но и продолжительности приема.
Важнейшее значение при выборе НПВП имеет сопутствующая патология: артериальная гипертензия, ишемическая болезнь сердца, сахарный диабет, метаболический синдром, заболевания ЖКТ, депрессия и др. В связи с этим, выбирая НПВП, следует руководствоваться клиническими рекомендациями «Рациональное использование нестероидных противовоспалительных препаратов» [17], где представлен алгоритм назначения лекарственных средств этого класса с учетом сопутствующей патологии (табл. 4).

Важно знать:
- эффективность как селективных (сНПВП), так и неселективных НПВП (нНПВП) сопоставима и зависит от дозы;
- необходим дифференцированный подход к выбору НПВП в зависимости от наличия у пациента сопутствующих заболеваний;
- у пациентов при наличии факторов риска развития НПВП-гастропатии необходимо сочетать назначение сНПВП с ингибиторами протонной помпы;
- при наличии сердечно-сосудистых заболеваний НПВП применяются в минимальной эффективной дозе на короткие сроки. НЯ со стороны сердечно-сосудистой системы свойственны всем препаратам НПВП. Риск их развития зависит от индивидуальных характеристик препарата и используемой дозы, но не от селективности в отношении циклооксигеназы-2 (ЦОГ-2). Противопоказания для назначения любых НПВП – очень высокий риск кардиоваскулярных осложнений (инфаркт миокарда, острый коронарный синдром, ишемический инсульт, декомпенсированная хроническая сердечная недостаточность и пр.), прием двойной/тройной антикоагулянтной терапии;
- прием любых НПВП может вызвать острую почечную недостаточность, особенно в первый месяц лечения. Этот риск снижен у пациентов с нормальной функцией почек. Пациентам со скоростью клубочковой фильтрации менее 30 мл/мин прием НПВП не рекомендован;
- при назначении НПВП следует учитывать возможность лекарственных взаимодействий. Не рекомендован одновременный прием НПВП из различных групп, так как при этом значимо повышается риск развития НЯ;
- принимать решение об изменении НПВП-терапии рекомендуется через 10–14 сут от начала лечения препаратами этой группы.
Следующие этапы лечения (II–IV) ОА необходимо проводить при неэффективности I шага терапии. Они подразумевают консультацию/ведение пациентов врачами-ревматологами, при необходимости травматологами-ортопедами.
NB! При наличии противопоказаний к применению НПВП или недостаточного ответа на проводившуюся ранее терапию (нефармакологические методы, SYSADOA, локальные и/или системные НПВП) врачу первичного звена необходимо направить пациента на консультацию к специалисту (к ревматологу).
NB! Эффективность проводимой терапии оценивается по ВАШ. Под недостаточным ответом на проводимую терапию понимается сохранение боли в анализируемом суставе (наиболее болезненном) более 40 мм.
РЕЗЮМЕ
В своем заключительном слове председатели Совета экспертов подчеркнули актуальность рассмотренных вопросов и плодотворный характер обсуждения. После обсуждения и подведения итогов группой экспертов различных специальностей (ревматология, терапия, неврология, реабилитология и травматология-ортопедия) были одобрены простые алгоритмы ведения и лечения пациентов с ОА, предназначенные для врачей общей практики.
В ходе дискуссии был выработан ряд рекомендаций, с которыми согласились все участники.
1. Ведение больных с ОА осуществляет врач первичного звена здравоохранения при отсутствии «красных флагов». При их наличии больного необходимо направить к специалисту (при возможности к ревматологу).
2. Лечение ОА в реальной клинической практике должно быть основано на индивидуальной оценке пациента с учетом его потребностей, предпочтений и наличия мультиморбидности.
3. Терапия пациентов с ОА на основании принципов доказательной медицины включает комбинацию немедикаментозных и фармакологических методов лечения.
4. При лечении пациентов с ОА необходимо руководствоваться простым и пошаговым алгоритмом, подержанным всеми экспертами.
5. Немедикаментозное лечение должно включать рекомендации по изменению образа жизни, диете и необходимости физической активности.
6. При первичном обращении пациента в медицинское учреждение необходимо определить нарушения биомеханики сустава и рекомендовать ортопедические приспособления.
7. SYSADOA являются препаратами первой линии, которые назначаются сразу после установления диагноза ОА.
8. Длительное назначение SYSADOA (хондроитина сульфат, глюкозамин или их комбинация (Терафлекс, Терафлекс Адванс), неомыляемые соединения авокадо/сои (Пиаскледин 300), диацереин, гликозаминогликан-пептидный комплекс (Румалон), Алфлутоп и др.) обеспечивает анальгетическое, противовоспалительное и структурно-модифицирующее действия.
9. Парацетамол может назначаться пациентам со слабой болью, а также при наличии противопоказаний к применению НПВП, но не более 3 г/сут (непродолжительными курсами) и только на фоне SYSADOA.
10. Топические формы НПВП должны быть рекомендованы всем пациентам с ОА при наличии боли (исключение – ОА тазобедренных суставов).
11. При выборе НПВП для лечения ОА необходимо учитывать индивидуальные особенности пациента и наличие сопутствующих состояний.
12. При лечении пациентов с ОА целесообразно ограничивать использование НПВП не только в плане дозировки, но и длительности приема.
13. При неэффективности I шага терапии (сохранение боли более 40 мм по ВАШ) пациента необходимо направить на консультацию к ревматологу.
14. Учитывая высокую социальную значимость ОА, необходимо планировать образовательную деятельность в рамках международных и национальных образовательных программ и расширить состав их участников с привлечением терапевтов, семейных врачей, хирургов поликлиник, физиотерапевтов, специалистов по медицинской реабилитации и восстановительной медицине.



