ВВЕДЕНИЕ
ВИЧ-инфекция остается одной из глобальных проблем мирового здравоохранения. За все время существования пандемии ВИЧ-инфекции от нее и ее осложнений в мире скончалось около 33 млн человек (по состоянию на 20 ноября 2020 г.) [1]. Всего в мире проживает 37,7 млн человек с ВИЧ- инфекцией (по данным ЮНЭЙДС на 2020 г.), а к наиболее пораженным регионам относятся страны Африки (25,7 млн человек) [1]. По данным справки Федерального научно-методического центра по профилактике и борьбе со СПИД (ФНМЦ СПИД) на 30 июня 2021 г., среди граждан России зарегистрировано 1 122 879 человек с подтвержденным диагнозом «ВИЧ-инфекция».
С помощью современных антиретровирусных препаратов (АРП), направленных на ингибирование различных ферментов вируса, удается быстро подавить репликацию ВИЧ и улучшить состояние пациентов, но сложная структурная организация вируса позволяет ему быстро адаптироваться к действию противовирусных средств. В последние 10 лет отмечается рост устойчивости ВИЧ к химиопрепаратам. Передача устойчивых к лекарственным препаратам штаммов ВИЧ-1 пациентам, ранее не получавшим антиретровирусную терапию (АРТ), приводит к неэффективности проводимой им линии терапии и прогрессированию заболевания [2, 3]. В соответствии с данными Всемирной организации здравоохранения (ВОЗ), в странах Западной Европы и США уровень первичной резистентности ВИЧ составляет 12–23%, в частности, в США 19–23%, Франции и Великобритании – 14%, Нидерландах – 13%, Испании 12% [4].
Распространенность лекарственной устойчивости у пациентов без опыта приема АРП в России (по данным ФНМЦ СПИД) следующая: в Дальневосточном федеральном округе – 7,6%, в Сибирском – 7,0%, Уральском – 1,7%, Северо-Западном – 3,9%, Центральном – 5,7%, Приволжском – 2,8%, Южном – 5,1%. Наиболее часто встречающиеся мутации к препаратам из класса ингибиторов протеазы – M46I/L, I58V, к нуклеозидным ингибиторам обратной транскриптазы (НИОТ) – M184V/I, M41L, к ненуклеозидным ингибиторам обратной транскриптазы (ННИОТ) – K103N, G190S, K103S [5,6,7].
Своевременное выявление вариантов ВИЧ, устойчивых к АРП, и коррекция линии терапии позволяют предотвратить формирование мутаций. Установлено, что новые мутации увеличивают степень резистентности и формируют перекрестную лекарственную устойчивость к другим препаратам этого же класса [3, 8]. Учитывая увеличение охвата ВИЧ-инфицированных диспансерным наблюдением и АРТ, все большее число впервые выявленных больных оказываются инфицированными резистентными штаммами. В связи с этим целью нашего исследования стало изучение распространенности первичной резистентности ВИЧ-1 к АРП у больных с ВИЧ-инфекцией в Новосибирской области в 2021 г.
МАТЕРИАЛ И МЕТОДЫ
Выполнено обследование 119 больных с впервые установленным диагнозом «ВИЧ-инфекция» в возрасте от 22 до 66 лет, наблюдавшихся в период с мая по декабрь 2021 г. в ГБУЗ НСО «Городская инфекционная клиническая больница № 1» г. Новосибирска. В исследование включались пациенты в возрасте 18 лет и старше на любой стадии ВИЧ-инфекции без опыта АРТ.
У всех больных оценивались эпидемиологические данные: путь инфицирования, показания к обследованию, группа риска.
На базе ФБУН ГНЦ ВБ «Вектор» проводилось выделение РНК ВИЧ-1 из 250 мкл плазмы крови с использованием набора «ДельтаМаг ВГВ/ВГС/ВИЧ» (С-8893, «Вектор-Бест», Россия) в соответствии с инструкцией производителя. Для получения вирус-специфического фрагмента, кодирующего область протеазы-ревертазы вируса (PR-RT, протяженностью 1300 нт), применяли схему гнездовой полимеразной цепной реакции (ПЦР) с использованием лабораторного набора праймеров. Первый раунд амплификации проводили с применением лиофилизированного набора «РеалБест Мастер микс ОТ» («Вектор-Бест», Россия), а второй – с БиоМастер HS-Taq ПЦР-Color (2×) («БиоЛабМикс», Россия). Последовательность нуклеотидов полученных фрагментов определяли методом прямого секвенирования по обеим цепям с помощью автоматического генетического анализатора ABI PRISM 3130xl DNA Analyzer (Applied Biosystems, США). Расшифрованные нуклеотидные последовательности ВИЧ-1 собирали и редактировали в программе Sequencher 4.1 Software (GeneCodesCorporation, AnnArbor, MI, USA) и сравнивали с соответствующими референс-последовательностями различных субтипов и рекомбинантных форм ВИЧ-1 из международной базы данных (LosAlamosHIV-1 database) с применением программ ClustalW Multiple alignment и BioEdit software 7.2.5 [9]. Филогенетический анализ выполняли с помощью MEGA 6.0.6, используя метод объединения ближайших соседей (neighboroiningmethod, NJ) на основе двухпараметрической модели Кимуры [10]. Статистическую значимость топологии филогенетического дерева оценивали через анализ бутстрепов. С использованием интернет-ресурса jpHMM (http:// jphmm.gobics. de/submission_hiv.html) были исследованы возможные мозаичные последовательности и выявлены уникальные рекомбинантные (URF) вирусы. Анализ наличия мутаций, связанных с лекарственной устойчивостью ВИЧ-1, проводили с помощью специализированного интернет-ресурса (https://hivdb.stanford.edu). Анализ мутаций, связанных с резистентностью ВИЧ-1 к лекарственным препаратам, осуществляли на основе рекомендаций ВОЗ по эпиднадзору за перечнем мутаций лекарственной устойчивости [11, 12].
Статистический анализ данных проводился посредством программы STATISTICA 10. Различия частотных характеристик качественных переменных оценивали с использованием критерия χ2 Пирсона. Различия средних значений количественных показателей определяли с помощью критерия Манна–Уитни. Значимыми считали различия при p <0,05. Для количественной оценки статистического изучения связи между явлениями применялся коэффициент корреляции Спирмена.
РЕЗУЛЬТАТЫ
Среди 119 обследованных пациентов преобладали мужчины – 68,1% (n=81). Возраст пациентов составил в среднем 39,4±2,95 лет. По результатам эпидемиологического расследования установлено, что у 119 больных доминировал половой гетеросексуальный путь передачи ВИЧ-инфекции – 61,3%. На долю парентерального пути инфицирования (внутривенное введение наркотиков) пришлось 32,7% случаев, полового гомосексуального пути – 0,8%, неуточненного пути – 5,2% (рис. 1).
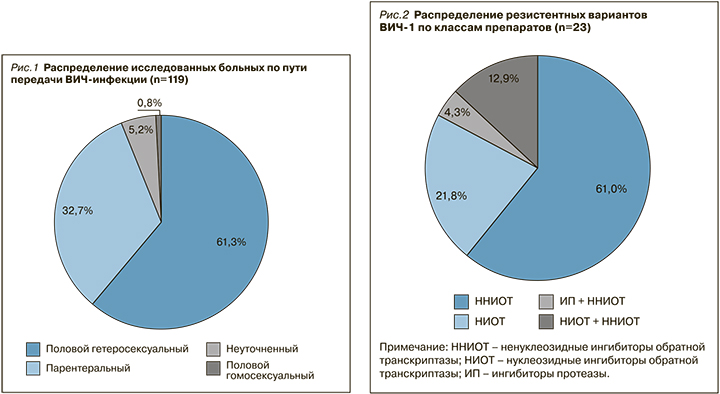
Интересно отметить, что у мужчин достоверно чаще регистрировался парентеральный путь передачи ВИЧ-инфекции – в 40,7% случаев (n=33 из 81) против 15,8% (n=6 из 38) у женщин (p <0,05; точный критерий Фишера (двусторонний)).
У 110 больных было выполнено генотипирование ВИЧ-1 и выявлено 6 генетических вариантов ВИЧ: субтип A6 (12,7%), субтип B (1,8%), CRF63_02A6 (80,9%), CRF01_AE (1,8%), CRF02_AGFSU (0,9%) и два варианта уникальных рекомбинантных ВИЧ (URF), образованных с участием субтипа А6 и CRF63_02A6 (по 0,9%). Лица, у которых были выделены URF ВИЧ-1, являлись потребителями инъекционных наркотических препаратов (ЛУИН). Вариант ВИЧ-1 CRF01_AE, близкий к вирусам из Китая и обладающий высоким уровнем резистентности к эфавирензу, невирапину и средним к доравирину, был обнаружен у мужчины 23 лет, который посещал Среднюю Азию. ВИЧ-1 CRF01_AE, кластеризующийся с вирусами из Таиланда и Вьетнама, был выявлен у мужчины 62 лет, инфицированного при гетеросексуальных контактах, но не выезжавшего за рубеж.
Среднеазиатский ВИЧ-1 CRF02_AGFSU был найден у женщины 56 лет, инфицированной половым путем.
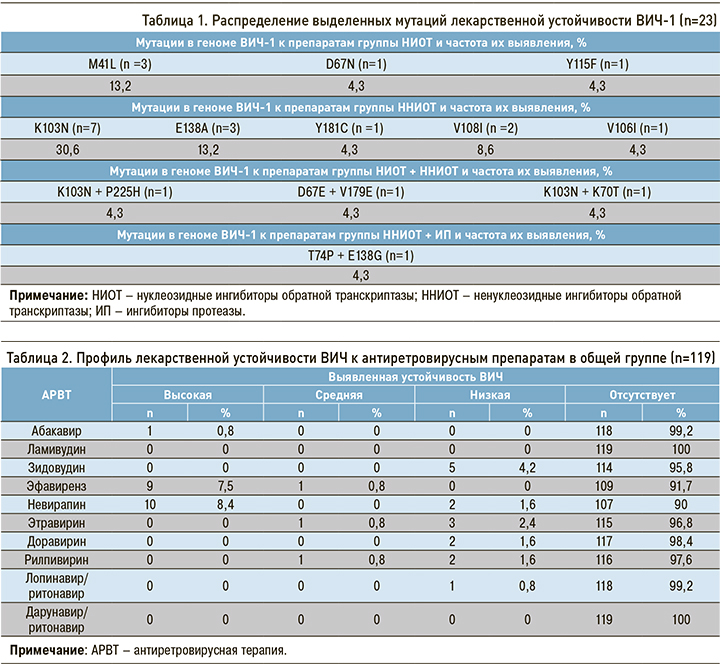
Согласно основному перечню мутаций, подлежащих надзору за первичной резистентностью ВИЧ-1 (МР «Надзор за распространением штаммов ВИЧ, резистентных к антиретровирусным препаратам от 20.08.2013»), обнаружено 16 резистентных вариантов ВИЧ-1, т.е. 13,4% от всей исследуемой группы больных. По совокупности всех выявленных мутаций (в том числе подлежащих надзору) первично резистентные варианты ВИЧ-1 были выявлены в 19,3% случаев (n=23 из 119). Чаще других регистрировались изолированные мутации к препаратам из группы ННИОТ – в 61,0% (n=14 из 23). Изолированные мутации к НИОТ встречались в 21,8% (n=5 из 23 абс.), сочетание мутаций резистентности к НИОТ + ННИОТ – в 12,9% (n=3 из 23), к ингибиторам протеазы (ИП) + ННИОТ – в 4,3% (n=1 из 23) случаев (рис. 2).
Достоверной разницы между частотой встречаемости мутаций для вирусов субтипа А6 и CRF63_02A6 не выявлено, однако стоит отметить, что для ВИЧ-1 субтипа А6 был зарегистрирован только один вариант мутации – V179E (n=2 из 15).
Установлено, что среди резистентных ВИЧ (n=23) наиболее часто встречалась мутация К103N – одна (30,6%) и в сочетании с P225H и K70T (по 4,3%). Зарегистрированы единичные мутации – Y181C, V106I, Y115F и D67N. Среди комбинаций мутаций выявлены D67E + V179E и T74P + E138G (табл. 1).
Большинство больных с резистентными вариантами ВИЧ-1 были инфицированы парентеральным путем – 69,5% (n=16 из 23), на долю полового пути пришлось 26,2% (n=6 из 23), неуточненного пути – 4,3%.
Важно отметить, что вариант ВИЧ-1 CRF01_AE, близкий к вирусам из Китая и обладающий высоким уровнем резистентности к эфавирензу, невирапину и средним – к дораверину, был обнаружен у посещавшего Среднюю Азию мужчины 23 лет, инфицированного, с его слов, при гетеросексуальных контактах.
На основании выявленных мутаций ВИЧ-1 был составлен профиль резистентности вируса для каждого пациента относительно препаратов групп НИОТ, ННИОТ и ИП (табл. 2). Наиболее часто высокий уровень устойчивости выявлялся к препаратам группы ННИОТ – эфавирензу (7,5%) и невирапину (8,4%). Средний уровень устойчивости в единичных случаях был зарегистрирован к препаратам этравирин, рилпивирин и эфавиренз (по 0,8%). В группе ИП выявлена низкая устойчивость к препарату лопинавир/ритонавир.
ОБСУЖДЕНИЕ
Передача первично-резистентных штаммов ВИЧ-1 в Новосибирской области увеличилась по сравнению с периодом 2017–2019 гг. с 5,3 до 13,4%. По результатам анализа профиля лекарственной устойчивости установлено, что наиболее часто высокий уровень резистентности выявлялся к препаратам эфавиренз (7,5%) и невирапин (8,4%); в первую очередь это обусловлено широким распространением мутации K103N (30,6% от выявленных мутаций).
Рост распространения первичной резистентности ВИЧ-1 главным образом связан с расширением охвата АРТ пациентов с ВИЧ-инфекцией. Анализ эпидемиологических данных у этих больных позволил определить факторы, негативно влияющие на прогноз дальнейшего развития эпидемии ВИЧ-инфекции в регионе: это широкая распространенность практик рискованного поведения, способствующих передаче резистентных ВИЧ-1, особенно среди потребителей инъекционных наркотиков. Впервые был зарегистрирован завоз из Средней Азии ВИЧ-1, обладающего высоким уровнем резистентности к препаратам первой схемы АРТ.
ЗАКЛЮЧЕНИЕ
Выполненное в 2021 г. исследование выявило, что среди наивных ВИЧ-инфицированных жителей Новосибирской области распространенность первичной лекарственной устойчивости ВИЧ-1 к АРТ соответствует среднему уровню для территорий России– 13,4%. Среди резистентных ВИЧ (n=23) наиболее часто встречалась мутация К103N – одна (30,6%) и в сочетании с P225H и K70T (по 4,3%).
Результаты, полученные в рамках этого исследования, указывают на то, что на территории Новосибирской области с 2010 г. сохраняется распределение основных циркулирующих генетических вариантов ВИЧ-1: преобладает CRF63_02A6 (80,9%), на втором месте по распространенности находится ВИЧ-1 субтипа А6, который обнаруживается в 12,7%. В отличие от соседних регионов Сибири (Кемеровской, Томской, Омской областей, Красноярского края) [14, 15], в Новосибирской области регистрируется лишь незначительный рост гетерогенности циркулирующих вариантов ВИЧ-1 как за счет появления новых рекомбинантных вирусов, так и благодаря завозу ВИЧ-1 из других стран. Впервые выявлены генетические варианты ВИЧ-1, специфические для Юго-Восточной Азии.
По данным наших коллег, в ряде стран Средней Азии уровень первичной резистентности ВИЧ варьирует от 2,8 до 16,5% [13]. Активные миграционные потоки людей между странами СНГ могут создавать взаимные угрозы по распространению ВИЧ-1, имеющих сниженную чувствительность к АРВП. В связи с этим повышение эффективности проводимой АРТ, усиление эпидемического надзора за возникновением и распространением резистентных к АРВП ВИЧ-1 является крайне актуальной задачей.



