ВВЕДЕНИЕ
Многие годы для длительной и непрерывной антикоагулянтной терапии и профилактики тромбоэмболических состояний используются препараты группы антагонистов витамина К (АВК) [1–5]. Пути совершенствования и оптимизации варфаринотерапии, профилактики возникновения венозного тромбоэмболизма/тромбоэмболических осложнений (ВТЭ/ТЭО) включают изучение факторов, определяющих индивидуальную чувствительность пациентов к АВК, использование фармакогенетического алгоритма дозирования варфарина, контроль за антикоагулянтным действием этого лекарственного средства [10–15]. Персонифицированный подход к продленной терапии АВК ассоциирован с улучшением гемостазиологических маркеров тромбинемии и клинических исходов у пациентов с ВТЭ и фибрилляцией предсердий (ФП) [3, 9].
Деятельность сети антикоагулянтных кабинетов в Архангельской области регламентирована приказом местного Минздрава от 2015 г. В 2019 г. его распоряжением состоялось официальное открытие Регионального центра антитромботической терапии (РЦАТТ) Архангельской области, где проводятся обследование, лечение и последующее динамическое наблюдение за пациентами с различной патологией системы гемостаза [2]. Основными направлениями работы РЦАТТ являются консультации пациентов и врачей, в том числе при инфекции COVID-19, подбор дозы АВК, мониторинг международного нормализированного отношения (МНО), выполнение фармакогенетического тестирования, контроль лечения пероральными антикоагулянтами, антитромбоцитарной терапии, определение остаточной реактивности тромбоцитов по методике Verify Now. Отдельный вектор в деятельности Центра – образование пациентов (обучение в школах по продленному приему антикоагулянтов) для формирования приверженности к лечению, образование врачей путем проведения циклов тематического усовершенствования по антитромботической терапии (36 ч). Школа для пациентов, принимающих АВК, функционирует с апреля 2007 г. на базе ГБУЗ Архангельской области «Первая городская клиническая больница им. Е.Е. Волосевич». Это первая в России Школа по варфаринотерапии. На базе РЦАТТ функционирует WEB-сервер – автоматизированное рабочее место Cobas IT 1000 с базой данных пациентов, длительно принимающим АВК. Врач-координатор отслеживает эффективность и безопасность терапии АВК (анализ МНО в единой базе данных), формирует рекомендации по их дозировке, консультирует врачей других антикоагулянтных кабинетов, осуществляет централизованный контроль за анализаторами, лотами, реагентами, персоналом, выполняющим измерения. В локальных антикоагулянтных кабинетах медицинских организаций проводится определение МНО на портативном коагулометре – коагучеке, выполняется коррекция дозы АВК. Обучающая информация для пациента, получающего антикоагулянты, размещена на сайте Первой городской клинической больницы им. Е.Е. Волосевич по адресу: www.1gkb. ru в разделе консультативные центры → РЦАТТ → онлайн-школы (тел.: 8 (8182) 632-910). Обучение пациентов, принимающих АВК и пероральные антикоагулянты, идет непрерывно.
Цель нашего исследования – оценить эффективность и безопасность персонифицированного подхода в терапии АВК с использованием фармакогенетического тестирования у пациентов, наблюдающихся в РЦАТТ г. Архангельска.
МАТЕРИАЛ И МЕТОДЫ
Проведено проспективное клинико-лабораторное исследование на базе РЦАТТ ГБУЗ Архангельской области «Первая городская клиническая больница им. Е.Е. Волосевич» (г. Архангельск).
Методом сплошной выборки в исследование были включены пациенты (n=107) с ВТЭ и ФП, обратившиеся в антикоагулянтный кабинет для прохождения школы варфаринотерапии в период с марта 2012 по март 2013 г. Оценивались следующие параметры варфаринотерапии: препарат АВК; показания для варфаринотерапии; уровень медикаментозной гипокоагуляции; кровотечения и тромботические осложнения; мониторинг показателя МНО; факторы риска развития кровотечений, коморбидный фон с оценкой факторов риска ТЭО у пациентов с ФП по шкале CHA2DS2-VASc, риск кровотечений по шкале HAS-BLED [16], качество жизни [17]. Определялось значение Time in theraupeutical range (TTR), отражающее время нахождения показателя МНО в пределах терапевтических границ.
Участникам было выполнено фармакогенетическое тестирование с определением следующих генотипов: VKORC1: 1639 G>A − субъединица 1 витамин К-эпоксид-редуктазного комплекса; CYP2C9: 430 C>T (Arg144Cys) – цитохром P450, семейство 2, подсемейство С, полипептид 9; CYP2C9: 1075 A>C (Ile359Leu) – цитохром P 450, семейство 2, подсемейство С, полипептид 9; CYP4F2: C>T (V433M) – цитохром P 450, семейство 4, подсемейство F, полипептид 2. Рассчитывались индивидуальные дозы варфарина с использованием онлайн-калькулятора Gage (www.warfarindosing.org) [18].
Методом простой рандомизации были сформированы 2 группы пациентов:
- в стандартной группе (СГ, n=57) использовался традиционный подход к дозированию АВК;
- в фармакогенетической группе (ФГ, n=50) применялся фармакогенетический подход к дозированию АВК.
Критерии включения в исследование: использование оригинального препарата варфарина натрия; обязательное обучение в школе варфаринотерапии (антикоагулянтный кабинет – РЦАТТ); последующий контроль МНО и других показателей системы гемостаза в условиях РЦАТТ; наличие информированного согласия пациента на проведение фармакогенетического тестирования.
Критерии исключения из исследования: прием пациентом некумариновых производных или других антикоагулянтов; отсутствие информированного согласия на участие в исследовании и проведение фармакогенетического тестирования.
Наблюдение за пациентами продолжалось в течение 6 мес с момента их обращения в антикоагулянтный кабинет. В начале терапии АВК и спустя 6 мес проводилось анкетирование пациентов с использованием шкалыSF-36 Medcare (4 General Health – GH), США [17, 19], шкалы приверженности к варфаринотерапии в модификации А.В. Шапошникова [6], индексов качества жизни Karnovski, госпитальной шкалы психического состояния HADS, Zigmond A.S. и Snaith R.P. [20].
Пациенты в группах исследования были сопоставимы по возрасту и полу (табл. 1).
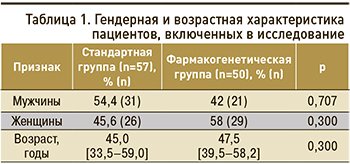
Основными показаниями для назначения АВК являлись тромбоз глубоких вен (ТГВ) и ФП без статистически значимых различий в группах (рис. 1). В СГ пациенты с ТГВ составили 65,0% [52,0–76,0] (n=37), в ФГ – 68,0% [58,3–82,5] (n=34; p=0,298).
Математическая обработка результатов осуществлялась с помощью программы SPSS (версия 20,0) и калькулятора расчета доверительного интервала (ДИ) MedCalc. Ввиду отличного от нормального распределения большинства количественных данных они были представлены как медиана (Me) и квартили [Q1–Q3]. Номинальные данные, отражающие распределение изучаемого признака, были представлены в виде доли и его 95% ДИ. Количественные переменные сравнивались с применением непараметрических тестов – критерия Вилкоксона для сравнения парных групп. Для проведения корреляционного анализа использовался коэффициент ранговой корреляции Спирмена (rs). Статистическая значимость различиям присваивалась при значении p <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Пациентов старше 65 лет с ФП в исследовании было значимо больше в сравнении с пациентами, имеющими ВТЭ (p=0,049). Артериальная гипертензия наблюдалась среди пациентов с ВТЭ и ФП без статистически значимых различий. В то же время среди пациентов с ФП значимо чаще встречались острое нарушение мозгового кровообращения (p=0,005), транзиторная ишемическая атака (p=0,03), ишемическая болезнь сердца (р=0,01). В 20,0% [12,5–30,4] случаев пациентам с ВТЭ был установлен кава-фильтр (р=0,01; табл. 2).
После выполнения корреляционного анализа в ФГ была выявлена корреляция между возрастом и начальной дозой варфарина (rs=-0,4; p=0,030), что означало необходимость уменьшения дозы АВК с возрастом, а также с поддерживающей дозой варфарина (rs=-0,3; p=0,057). В СГ корреляционная связь возраста с начальной (rs=-0,2; р=0,108) и поддерживающей дозами АВК была статистически незначимой (rs=-0,1; р=0,521).
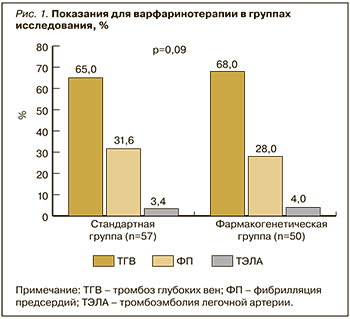
По результатам фармакогенетического тестирования в исследуемых группах наиболее распространенным был первый аллельный вариант CYP2C9*1/*1 («дикий» тип), отвечающий за нормальный метаболизм варфарина: в СГ – 51,0% [38,2–63,4], в ФГ – 67,3% [54,1–79,3]. Аллельные варианты CYP2C9*1/*2 и CYP2C9*1/*3, требующие снижения дозы АВК, были выявлены в СГ у 15,2% [7,0–26,0] пациентов по каждому из этих аллелей. В ФГ аналогичные показатели составили 19,2% [9,5–31,0] и 13,4% [5,2–24,2] соответственно. Статистически значимых различий в группах по выявленным аллелям обнаружено не было (рис. 2).
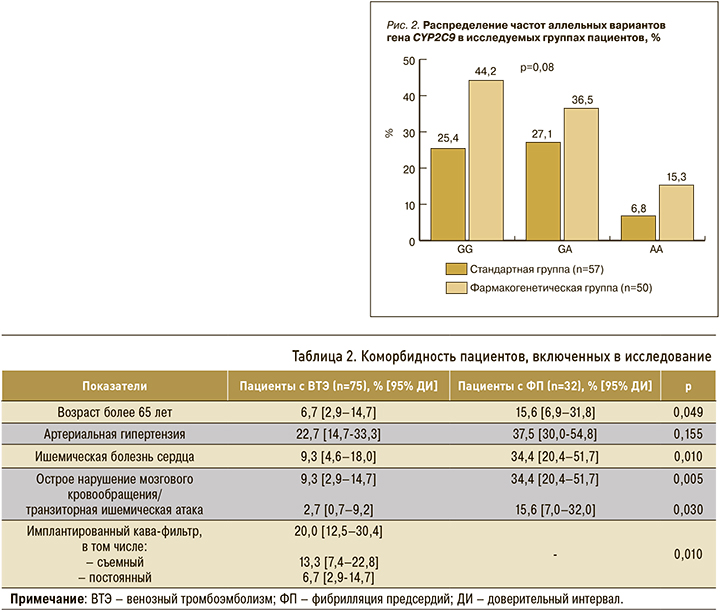
В СГ полиморфизм VKORC1 GG встречался у 25,4% [15,1–37,2] пациентов, в ФГ – у 44,2% [31,1–57,7]. Патологический аллель А, отвечающий за развитие избыточной гипокоагуляции, наблюдался в 32,2% [21,0–44,5] случаев. Гетерозиготное носительство (GA) в СГ было отмечено у 27,1% [16,5–39,0] пациентов, гомозиготное носительство (AA) – у 6,8% [1,2–15,0]. У пациентов в ФГ гетерозиготное носительство аллеля (GA) гена VКORC1 было выявлено в 36,5% [24,1–50,0], гомозиготное носительство (AA) – в 15,3% [6,6–26,5] случаев (рис. 3).
Распределение частот аллельных вариантов CYP4F2 в исследуемых группах пациентов представлено на рисунке 4. В гене CYP4F2 преобладал нормальный генотип (СС): в СГ – у 68,4% [55,5–79,0], в ФГ – у 68,0% [54,2–80,0] пациентов. Гетерозиготное носительство (СТ) встречалось в 31,6% [21,0–44,5] случаев в СГ и в 22,0% [13,0–35,2] – в ФГ. При этом гомозиготное носительство (ТТ) наблюдалось только у пациентов в ФГ – в 10,0% [3,2–19,0] случаев.
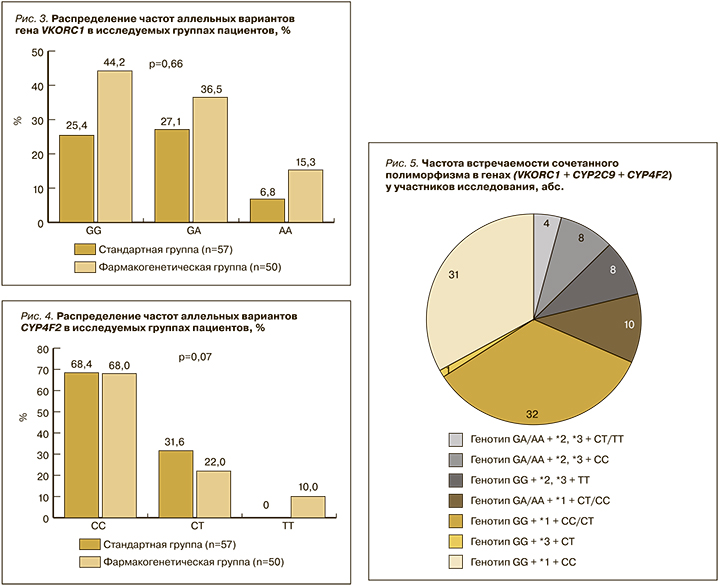
Также мы оценили мультигенное носительство полиморфизма сразу в трех генах, отвечающих за метаболизм варфарина (рис. 5). Неблагоприятные или потенциально опасные комбинации (генотип VKORC1 GA/AA c CYP2C9*2/*3 при любом варианте CYP4F2) были обнаружены у 11,2% [6,5–18,6] пациентов. У 1 пациента в СГ наблюдалась неблагоприятная комбинация полиморфизма в генах VKORC1 и CYP2C9 − 1,8% [0,3−9,3]. Также 1 одного пациента в ФГ было выявлено одновременно 3 полиморфизма в генах VKORC1, CYP2C9, CYP4F2 − 2,0% [0,4−10,5].
Далее мы оценили уровень наведенной медикаментозной гипокоагуляции (динамику показателя МНО). В обеих группах пациентов в первую неделю подбора дозы варфарина не было зарегистрировано терапевтического диапазона гипокоагуляции по уровню МНО.
На 9-е сутки варфаринотерапии 22,3% пациентов в СГ и 23,0% в ФГ достигли оптимальной гипокоагуляции, к 15-м суткам терапии число пациентов с оптимальным значением МНО увеличилось до 40,6% СГ и до 38,5% в ФГ без статистически значимых различий (р=0,439). К 6-му месяцу варфаринотерапии количество пациентов, находящихся в терапевтическом диапазоне показателя МНО, составило 84,2% в СГ и 92,0% в ФГ (p=0,076). Среднее значение времени нахождения показателя МНО в терапевтическом диапазоне (TTR) составило около 70% в обеих группах, что соответствовало оптимальному уровню варфаринотерапии (табл. 3) [10]. Более быстрое достижение TTR наблюдалось у пациентов в СГ – 11,3±3,6 против 14,7±2,2 дней (р=0,06) у пациентов в ФГ.
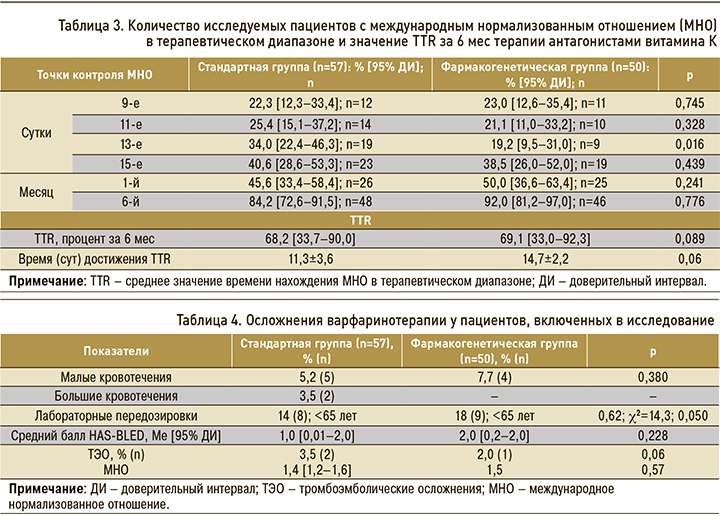
Следующим этапом исследования стал анализ осложнений терапии АВК и риска развития кровотечений по шкале HAS-BLED (табл. 4). В СГ этот риск оказался низким, составив 1,0 [0,01–2,0] балл; в ФГ он был умеренным – 2,0 [0,2–2,0] балла (U=303,5; р=0,228).
Геморрагический синдром отмечался у 10,3% [6,0–17,5] пациентов и в основном был представлен малыми кровотечениями: в СГ – в 5,2% [1,8–14,1], в ФГ – в 7,7% [1,4–16,8] случаев (р=0,380). У 3,5% [1,0–12,0] пациентов в СГ были зарегистрированы большие кровотечения, потребовавшие госпитализации в стационар и проведение заместительной терапии. В обеих группах наблюдались эпизоды избыточной медикаментозной гипокоагуляции (МНО >3,0). В СГ было отмечено 8 случаев, или 14,0% [7,3–25,3] передозировок АВК, в ФГ – 9 случаев, или 18,0% [9,8–30,8] (р=0,620); большинство соответствующих пациентов было моложе 65 лет (7 пациентов в СГ, 4 – в ФГ). Нами была выявлена статистически значимая взаимосвязь между возрастом пациента (моложе 65 лет) и избыточной гипокоагуляцией (c2=14,3; р=0,050).
Повторный тромбоз в СГ развился у 2 пациентов с одним летальным исходом, при этом уровень МНО составил Ме 1,4 [1,2–1,6]. В ФГ повторный тромбоз имел место у 1 пациента с МНО 1,5 (р=0,574).
Динамика параметров качества жизни у исследуемых пациентов до и после проведения школы варфаринотерапии, которая определялась с использованием шкалы приверженности к варфаринотерапии в модификации А.В. Шапошникова (оценка предстоящей социальной и медицинской адаптации), опросника SF-36 Medcare (4 GH) (субъективная оценка здоровья пациентов), шкалы индексов Karnovski (физическая активность в процентах) и госпитальной шкалы HADS (оценка психического состояния), приведена в таблице 5. Большинство пациентов (81,0%) с началом варфаринотерапии ожидала частичная социальная и медицинская реадаптация. Через 6 мес такой терапии отмечалось увеличение количества пациентов с полной медицинской и социальной адаптацией с 12,0 до 15,4% (р >0,05). Также уменьшилось количество пациентов, имеющих ухудшение в состоянии здоровья и социальном статусе, с 7,0 до 3,3% (p <0,05). Треть пациентов (34,1%) в начале терапии АВК оценивали свое здоровье как удовлетворительное. В дальнейшем увеличилось число пациентов, оценивающих свое состояние как превосходное: с 1,4 до 20,3% (p <0,05). Доля пациентов, чувствующих себя очень хорошо, также возросла с 21,0 до 40,7% (p <0,05). Значительно меньше стало пациентов, оценивающих свое здоровье как удовлетворительное: 10,6% (p <0,05).
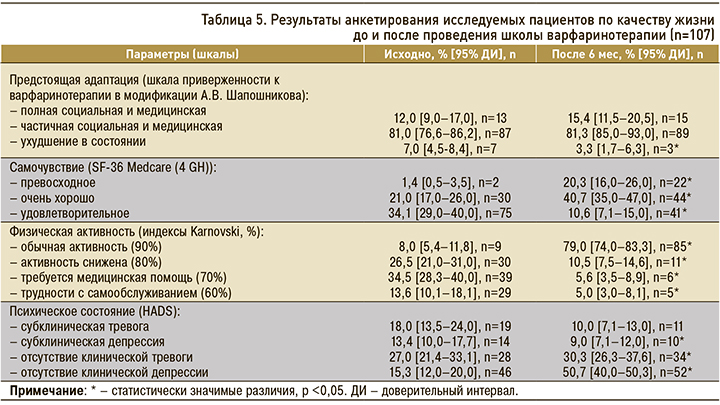
Исходно 34,5% [28,3–40,0] пациентов оценивали свою повседневную активность как требующую периодической медицинской помощи (70% индекс), спустя 6 мес этот показатель составил 5,6% (р <0,05). В динамике возросло количество пациентов с обычной активностью и минимальной симптоматикой (90% индекс) – до 79,0% (р <0,05). У 41,0% пациентов, принимающих АВК, мы обнаружили признаки клинической тревоги, у 36,3% – выраженной клинической депрессии.
После 6-месячной терапии АВК психическое состояние участников исследования улучшилось: депрессии не было выявлено у 50,7% пациентов (р <0,05), однако оставались пациенты с субклиническими признаками депрессии – 9% (р <0,05).
ЗАКЛЮЧЕНИЕ
1. Выявлена статистически значимая корреляция между уровнем наведенной избыточной гипокоагуляции и возрастом пациента менее 65 лет (c2=14,3; p=0,050) в обеих группах исследования. В ФГ обнаружена отрицательная корреляция начальной дозы варфарина с возрастом пациента (rs=-0,4; р=0,030).
2. Осложнения варфаринотерапии развились вне зависимости от присутствия генотипа (СУР2С9, CYP4F2, VKORC1) и алгоритма дозирования варфарина в условиях наблюдения в антикоагулянтном кабинете.
3. В условиях наблюдения в антикоагулянтном кабинете фармакогенетический алгоритм выбора дозы АВК для пациентов с ВТЭ и неклапанной ФП является дополнительным методом исследования, который показан больным с геморрагическим анамнезом, частыми малыми кровотечениями при целевых значениях МНО и наличии сопутствующей терапии ингибиторами цитохромов Р450.
4. Оценка качества жизни при наличии приверженности к терапии АВК показала увеличение числа пациентов с полной медицинской и социальной адаптацией, 90%-ным индексом сохранности Karnovski, а также психически здоровых по уровню тревоги и депрессии.
Таким образом, продленная терапия АВК у пациентов с неклапанной ФП и ВТЭО не оказывает значимого негативного влияния на качество жизни в условиях наблюдения в антикоагулянтном кабинете. Для оптимизации продленной терапии АВК необходимо формирование приверженности к такой терапии врачей стационарного и амбулаторного звена с использованием образовательных обучающих программ в системе непрерывного медицинского образования на основе опыта работы антикоагулянтных кабинетов.



