ВВЕДЕНИЕ
Железо играет в организме важнейшую роль, участвуя в регуляции обмена веществ, процессах переноса кислорода, тканевом дыхании. По статистике, до 20% населения земного шара страдает скрытым дефицитом железа и/или железодефицитной анемией (ЖДА). Анемия у пожилых людей часто остается не диагностированным заболеванием, о котором не сообщают пациенту, поскольку в большинстве случаев оно воспринимается как простое следствие старения или признак заболевания [1].
В настоящее время диагностика основной причины анемии в общей практике очень сложна. Наиболее распространенная форма анемии – ЖДА, частота которой в среднем по России достигает 12% у женщин детородного возраста и пожилых людей [2, 3]. Важность диагностики и своевременного лечения анемии обусловлена тем фактом, что в противном случае у пациентов может ухудшаться умственная и физическая активность, возрастает риск инфекционных заболеваний и др. [4].
Анемия нередко сопутствует хроническим заболеваниям у пациентов терапевтического профиля, в основном имеющим сердечно-сосудистую патологию [5]. На первом месте по распространенности стоит железодефицитная анемия, при этом у пациентов отмечается повышение средней величины Red Cell Distribution Width (распределения эритроцитов по величине) и снижение скорости клубочковой фильтрации (СКФ) менее 60 мл/мин/1,73 м2 [6]. Анемия признана независимым фактором риска неблагоприятного исхода при сердечно-сосудистых заболеваниях (ССЗ) и может рассматриваться не только как предиктор, но и маркер неблагоприятного прогноза. Согласно литературным данным, она диагностируется у трети пациентов с хронической сердечной недостаточностью (ХСН) и у 10–20% пациентов с ишемической болезнью сердца (ИБС). Процесс развития анемии при кардиоваскулярной патологии является многофакторным. Среди причин, лежащих в его основе, исследователи называют хроническое воспаление, сидеропению, гемодилюцию, снижение выработки и недостаточную активность эритропоэтина [7, 8].
С учетом вышеизложенного ранняя диагностика анемии – актуальная проблема профилактики, лечения и улучшения прогноза при ИБС, а ее коррекция – очень важное дополнение к комплексной терапии кардиоваскулярных заболеваний, способствующих развитию ХСН [9].
Цель исследования – изучить влияние коррекции уровня гемоглобина на течение ИБС (стабильной стенокардии напряжения) у пациентов в амбулаторно-поликлинической практике.
МАТЕРИАЛ И МЕТОДЫ
В исследование были включены 1210 пациентов (309 мужчин и 901 женщина) с ИБС среднего возраста 67,57±9,35 лет, которые находились на диспансерном учете с ИБС у терапевтов участковых или врачей общей практики в БУЗ ВО «Рамонская районная больница» и БУЗ ВО «Верхнехавская районная больница». Все пациенты подписали информированное добровольное согласие на участие в научном исследовании. Форма добровольного информированного согласия была одобрена на заседании локального этического комитета ФГБОУ ВО «Волгоградский государственный медицинский университет им. Н.Н. Бурденко» (протокол заседания № 8 от 16.11.2020).
С помощью разработанной нами компьютерной программы «Система мониторинга лечебно-диагностического процесса у больных анемией» на первом этапе исследования был проведен анализ медицинских карт пациентов двух случайно выбранных участков врачей первичного звена. Находившиеся в регистре сведения о пациентах включали персональные данные (в том числе паспортную часть), сведения об анамнезе, заключения выполненных лабораторно-инструментальных исследований. Данные, имеющие прямое отношение к анемии, коморбидной патологии, предшествующему лечению, составляли основную часть показателей статистического учета. В соответствующих разделах программы хранились сведения о пройденных исследованиях и консультациях специалистов. Достоверность сведений обеспечивалась протоколами исследований и лекарственной терапии нозологий, которые сопровождались анемическим синдромом (утверждены Минздравом России на основании требований справочника МКБ-10). Из группы заболеваний крови и кроветворных органов учитывались следующие коды: D50–D53. Внесение в регистр сведений о пациентах из медицинских карт производилось лицами, имеющими доступ к персональным данным, с помощью индивидуального логина и пароля [10].
На первом этапе исследования было проведено исследование следующих параметров анализа крови: уровень гемоглобина (Hb, г/л), гематокрит (Ht, %), количество эритроцитов, средний объем эритроцитов (MCV, фл), среднее содержание гемоглобина в эритроците (МСН, пг), средняя концентрация гемоглобина в эритроцитах (МСНС, г/л), лейкоцитарная формула, уровень тромбоцитов, уровень железа в сыворотке крови (мкмоль/л), морфологические изменения эритроцитов (анизоцитоз, пойкилоцитоз) [11].
Применялись следующие критерии анемии Всемирной организации здравоохранения (ВОЗ): для мужчин – гемоглобин менее 130 г/л, эритроциты – менее 4×1012/л; для женщин – гемоглобин менее 120 г/л, эритроциты – менее 3,8×1012/л [12].
За критерии ЖДА были приняты следующие показатели: MCV <80 фл, МСН <26 пг, МСНС <320 г/л, сывороточный уровень железа <9 мкмоль/л, морфологические изменения эритроцитов – анизоцитоз и пойкилоцитоз [13].
По степени тяжести анемии делились следующим образом: ≥90 г/л – анемия легкой степени тяжести; от 90 до 70 г/л – анемия средней степени тяжести; <70 г/л – анемия тяжелой степени тяжести [14].
Диагноз ИБС включал стабильную стенокардию напряжения II–IV функциональных классов. Диагноз устанавливался на основании типичной клинической картины заболевания, данных электрокардиографии (ЭКГ) или эхокардиографии (ЭхоКГ), коронарографии и теста 6-минутной ходьбы. Функциональный класс (ФК) стенокардии оценивался по классификации Канадского кардиологического общества [15].
Для определения ФК стенокардии напряжения у пациентов выполнялся тест 6-минутной ходьбы. Описание метода: измерение расстояния в метрах, пройденного пациентом за 6 мин в максимально возможном для него темпе. Нормативные параметры теста на 6-минутную ходьбу для различных ФК стенокардии напряжения [15]:
- I ФК – 426–550 м;
- II ФК – 301–425 м;
- III ФК – 151–300 м;
- IV ФК – менее 150 м.
Второй этап исследования состоял из проведения стандартной терапии, рекомендованной при ИБС (бета-блокаторы, нитраты, антитромбоцитарные препараты). В дополнение к вышеупомянутым лекарственным средствам в основной группе пациентов для лечения ЖДА применялся пероральный препарат, содержащий железа (III) гидроксид полимальтозат.
Доза железосодержащего препарата (мг) рассчитывалась индивидуально для каждого пациента в соответствии с общим дефицитом железа в организме, определяемым по формуле: масса тела (кг) × (150 – Нb больного (г/л)) × 0,24 + 500 мг, где коэффициент 0,24 = 0,0034 × 0,07 × 1000 (0,0034 или 0,34% – содержание железа в Нb, 0,07 или 7% – объем крови от массы тела, 1000 – коэффициент пересчета «г» в «мг»); 500 мг – количество депонированного железа в норме для пациентов с массой тела более 35 кг.
Лечение анемии осуществлялось в течение 18–24 нед, а средняя продолжительность терапии в группе пациентов с ЖДА составила в среднем 160,1±8,4 дня.
Математическая и статистическая обработка данных выполнялась с использованием программного пакета STATGRAPHICS 18.1.08 для Windows. Нормальность распределения данных оценивалась с использованием нормализованных коэффициентов эксцесса и асимметрии. Количественные данные с нормальным распределением представлены в форме M±σ, где M – выборочное среднее, σ – стандартное отклонение. Сравнение несвязанных выборок по количественным показателям в случае нормального распределения проводилось с использованием однофакторного дисперсионного анализа (ANOVA), для связанных выборок – однофакторного дисперсионного анализа с повторными измерениями. Для анализа взаимосвязей между изучаемыми признаками применялся параметрический критерий Пирсона. Различия считались статистически значимыми при уровне p <0,05 [16].
РЕЗУЛЬТАТЫ
Полученные нами данные свидетельствуют, что среди 1210 исследованных пациентов с ИБС ЖДА встречалась у 500 пациентов (41,3%), в том числе у 385 женщин (77%) и 115 мужчин (23%). Анемия легкой степени наблюдалась у 410 пациентов (8,2%), умеренной тяжести – у 75 пациентов (15%), тяжелая – у 15 (3%). Средний возраст обследуемых, у которых была выявлена ЖДА, составил 65,34±6,37 лет у мужчин и 63,49±7,05 лет у женщин. В группе пациентов с ИБС без анемии среднее значение гемоглобина равнялось 135,1±3,5 г/л у мужчин и 125,4±4,1 г/л у женщин, что превышало аналогичные показатели в группе пациентов с ИБС и анемией, где средняя величина гемоглобина у мужчин составляла 88,8±5,4 г/л, у женщин – 81,2±4,4 г/л (р <0,05).
Таким образом, пациенты были разделены на две группы:
- основная группа (n=500) – пациенты с ИБС и ЖДА;
- группа сравнения (n=710) – пациенты с ИБС без анемического синдрома.
В основной группе дополнительно были выделены две подгруппы:
- первая подгруппа (n=410) – пациенты с ИБС и ЖДА, получавшие терапию железосодержащим препаратом;
- вторая подгруппа (n=90) – пациенты с ИБС и ЖДА, не получавшие терапию железосодержащим препаратом в связи с отказом от лечения или ввиду противопоказаний (повышенная чувствительность к компонентам препарата).
Основная группа (включая подгруппы) и группа сравнения достоверно не различались по используемым для лечения основного заболевания группам препаратов.
Обе подгруппы основной группы были сопоставимы по возрасту, полу, тяжести анемии, ФК стенокардии напряжения.
В первой подгруппе основной группы пациентов с ИБС в сочетании с анемией после комбинированной терапии наблюдались рост сывороточного железа на 112,8%, возрастание насыщения трансферрина железом на 50%, увеличение уровня гемоглобина на 11,7% и гематокрита на 13,4%. Также в этой группе отмечалось статистически достоверное увеличение объема эритроцитов на 6,6% и шестикратный рост концентрации ретикулоцитов (р <0,05). Повышение уровня показателей общего анализа крови сопровождалось статистически достоверным улучшением фракции выброса левого желудочка (ФВ ЛЖ) на 27,4% и увеличением толерантности к физической нагрузке на 112,6% (р <0,05). При этом во второй подгруппе основной группы пациентов с ИБС в сочетании с анемией, не получавших железосодержащий препарат, равно как и в группе сравнения, не отмечалось статически значимых изменений изучаемых параметров.
Динамика основных показателей общего анализа крови, ФВ ЛЖ и толерантности к физической нагрузке в основной группе исследования и группе сравнения на первом и втором этапах исследования показана в таблице 1.
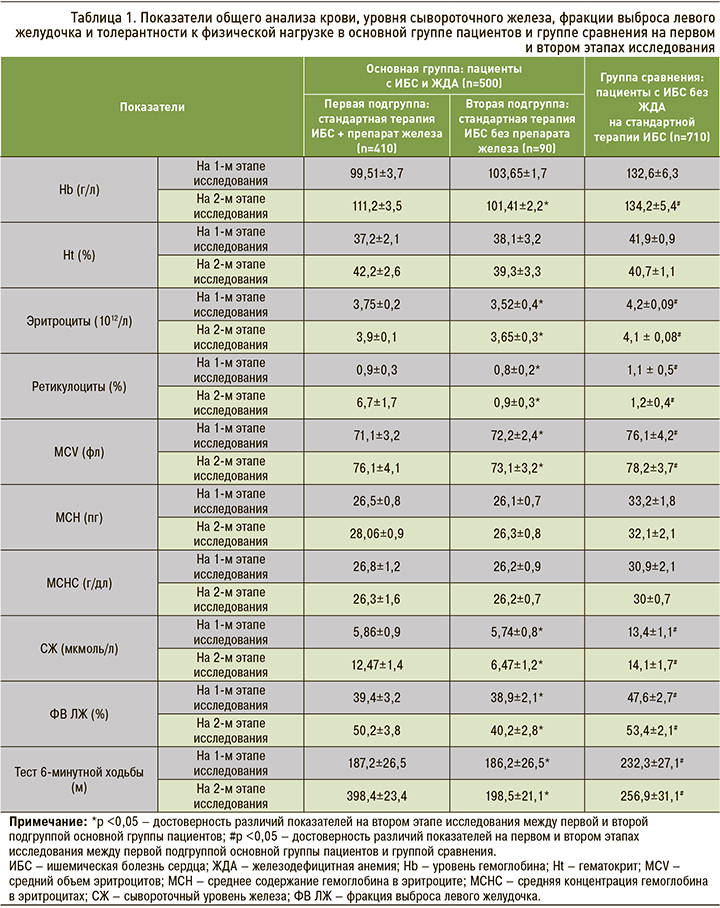
При холтеровском мониторировании ЭКГ в первой подгруппе основной группы пациентов после терапии за счет улучшения показателей общего анализа крови и насосной функции сердца наблюдалось статистически значимое снижение частоты ишемических эпизодов на 79,2% (с 12,5±1,3 до 2,6±0,9; p <0,05).
После окончания лечения, согласно результатам теста на толерантность к физической нагрузке, в первой подгруппе пациентов основной группы, получавших терапию железосодержащим препаратом, не было зафиксировано IV ФК стенокардии напряжения, который до лечения присутствовал в 13,2% случаев. Также в первой подгруппе основной группы в 35,5% случаев был зафиксирован I ФК стенокардии, чего не наблюдалось до начала терапии. В целом в первой подгруппе пациентов основной группы I–II ФК стенокардии после лечения составил 90,3%. При этом во второй подгруппе основной группы (пациентов с ИБС в сочетании с анемией, не получавшие железосодержащий препарат) и группе сравнения (пациенты с ИБС без анемии) не наблюдалось статически значимых изменений со стороны ФК стенокардии напряжения (табл. 2).
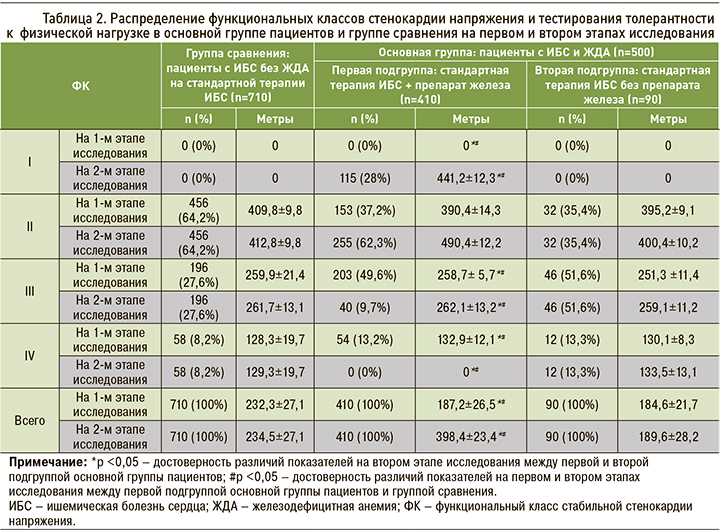
Изменение ФК стабильной стенокардии напряжения напрямую коррелировало с уровнем сывороточного железа, что подтверждается расчетным статистически достоверным коэффициентом корреляции – rFе-ФK = 0,74 (р <0,05).
ОБСУЖДЕНИЕ
Анемия – достаточно распространенная патология как у лиц трудоспособного возраста, так и пожилых людей с коморбидной патологией. С этой патологией в первую очередь приходится сталкиваться врачам первичного звена. Многие современные исследования обращают внимание на проблему ранней диагностики и профилактики анемии, особенно у пациентов с ССЗ. Необходимо также подчеркнуть, что в системе оказания первичной медико-санитарной помощи врачи-терапевты участковые и врачи общей практики имеют не всегда верное представление о влиянии анемии на течение основных заболеваний у пациентов пожилого возраста, необходимости в каждом случае обсуждать назначение терапии [17, 18].
Для того чтобы рассмотреть, как анемия влияет на повышение риска ССЗ, нужно понять механизм адаптация организма к низкому уровню гемоглобина. Количество кислорода, доставляемое к органам и тканям, определяется следующими факторами: кислородной емкостью крови, напрямую связанной с концентрацией гемоглобина, интенсивностью кровотока и его распределением, способностью эритроцитов к отдаче кислорода в ткани. Для компенсации патологических эффектов анемии задействуются негемодинамические и гемодинамические механизмы. Негемодинамические механизмы включают повышение продукции эритропоэтина и, как следствие, эритропоэза и усиление способности эритроцитов отдавать кислород. Главным гемодинамическим компенсаторным механизмом при анемии служит увеличение сердечного выброса, что достигается снижением постнагрузки, увеличением преднагрузки, положительным инотропным и хронотропным эффектами [19, 20].
Современные лабораторные методы позволяют эффективно диагностировать гипохромные состояния, но во многих странах, где проблема анемии стоит особенно остро из-за низкого уровня жизни, дорогостоящие лабораторные инструменты недоступны [21]. Кроме того, правильный диагноз ЖДА имеет важное значение для обеспечения пациента необходимым лечением. При этом прием препаратов железа должен быть обоснованным, и такая терапия должна быть начата лишь при установлении соответствующего диагноза; в противном случае это приведет к перегрузке организма железом, которое, в свою очередь, будет провоцировать множественные поражения органов и повышать риск смерти [22].
Ишемия миокарда – это дисбаланс между потребностью миокарда в кислороде и его доставкой коронарными артериями. К факторам, определяющим поступление кислорода в миокард, относятся частота сердечных сокращений и сократимость миокарда левого желудочка. Факторами, способствующими доставке кислорода, являются насыщение крови кислородом и уровень кровенаполнения в коронарных сосудах. Повышенная доставка кислорода к миокарду при повышенной потребности происходит благодаря снижению периферического сопротивления коронарных сосудов [23]. Даже значительное уменьшение уровня кислорода в коронарном русле может быть компенсировано расширением периферических кровеносных сосудов у лиц без коронарной патологии. При сужении коронарных сосудов этот механизм адаптации имеет ограниченные возможности. Было доказано, что при остром коронарном синдроме у лиц с анемией увеличивалась зона акинезии по данным ЭхоКГ, уменьшалась ФВ ЛЖ и снижались выживаемость. Переливание крови пациенту, повышающее уровень гемоглобина до 100 г/л, уменьшало площадь некроза миокарда и восстанавливало сократительную способность миокарда левого желудочка [24].
Создание компьютерных программ мониторинга анемического синдрома может способствовать повышению эффективности контроля лечебно-диагностического процесса и преемственности на каждом этапе оказания медицинской помощи, избеганию необоснованных затрат на ведение пациентов этой группы, снижению рисков по основной патологии, увеличению положительных прогностических результатов. Компьютерные регистры и программы мониторинга уже доказали свою эффективность в повышении ранней диагностики патологий бронхолегочной системы, желудочно-кишечного тракта, мочевыделительной системы.
На основе электронной базы данных проведен мониторинг заболевания и медицинской помощи больным анемическим синдромом и ИБС в реальной клинической практике, позволивший установить низкий уровень диагностики анемического синдрома, неполное обследование и несвоевременное назначение терапии пациентам с анемией и ИБС. Показано, что в 40% и более случаев ИБС протекает на фоне анемии, которая оказывает существенное влияние на течение и тяжесть ФК ИБС со снижением толерантности к физической нагрузке, и в 70% сопровождается снижением сывороточного железа.
Результаты исследований указывают на перспективность применения препаратов железа и гемотрансфузий у пациентов с ИБС и анемией. Такая терапия, направленная на восстановление нормального уровня гемоглобина при ИБС даже с легкой анемией, эффективна по ряду параметров. Коррекция анемии препаратами железа с достижением референсных значений уровня гемоглобина на фоне неизменной терапии основного заболевания приводила к увеличению ФВ ЛЖ и улучшению толерантности к физической нагрузке, сопровождалась уменьшением потребности в диуретиках и снижению частоты госпитализаций [25].
Ряд исследований показал эффективность раннего (на этапе бессимптомных изменений) терапевтического вмешательства, а именно лечения анемии препаратами железа и нормализации уровня гемоглобина, в предотвращении развития необратимых изменений сердечной мышцы, улучшении переносимости физической нагрузки и предотвращении формирования фатальной ХСН под влиянием анемии [26].
Включение железосодержащих препаратов в программу лечения ИБС, сочетающуюся с различной степенью тяжести анемии, является обязательным условием и оказывает более выраженный положительный клинический эффект на восстановление насосной функции сердца у больных с коронарной патологией.
ЗАКЛЮЧЕНИЕ
1. Анемия способствует более тяжелому течению ИБС (стабильной стенокардии напряжения), что подтверждается снижением ФВ ЛЖ, толерантности к физической нагрузке и более высокой частотой встречаемости IV ФК стенокардии напряжения.
2. Коррекция анемии способствует улучшению результатов лечения ИБС: наблюдалось увеличение фракции выброса левого желудочка, толерантности к физической нагрузке.
3. Коррекция анемии (в том числе увеличение сывороточного железа) в основной группе исследования (больные ИБС в сочетании с анемическим синдромом) приводила к снижению ФК стабильной стенокардии напряжения, а также способствовала снижению частоты ишемических эпизодов.



