ВВЕДЕНИЕ
Формирование и прогрессирование атеросклеротического процесса остается одной из актуальных и приоритетных проблем современного здравоохранения вследствие его высокой медико-социальной значимости [1]. Атеросклероз – заболевание воспалительного характера, которое поражает в основном артерии эластического (аорта, легочной ствол) и мышечно-эластического типа (общая сонная, бедренная, подвздошная артерии), что способствует развитию таких осложнений, как тромбообразование и последующая окклюзия просвета сосудов крупного и среднего калибров с развитием ишемии кровоснабжаемых органов [2]. В настоящее время атеросклеротическое повреждение и последующее ремоделирование сосудов крупного диаметра служат ведущей причиной заболеваемости и смертности в мире [3]. Воспалительная активация эндотелиальных клеток и эндотелиальная дисфункция являются ключевыми событиями в инициации атеросклероза, что было продемонстрировано в ряде работ [4, 5].
Последние десятилетия стали этапом изучения процессов ремоделирования сосудистой стенки и влияния его на формирование и развитие артериальной гипертензии (АГ). Этому посвящены работы многих отечественных и зарубежных исследователей, кроме того, в обновленных европейских и российских рекомендациях по ведению пациентов с АГ отмечено, что повышение аортальной жесткости относится к значимым прогностическим факторам в развитии сердечно-сосудистых событий [6, 7]. Вместе с тем в ряде исследований отмечено, что центральное аортальное давление (ЦАД) по сравнению с артериальным давлением (АД), измеренным на плечевой артерии, является более значимым предиктором развития патологии сердечно-сосудистой системы и более точно отражает степень поражения органов-мишеней [8].
В научных исследованиях последних лет достаточное внимание уделяется особенностям центрального аортального давления у пациентов с атеросклерозом различной локализации, в том числе с аневризмами брюшного отдела аорты и другими патологическими состояниями [9, 10]. При этом недостаточно изученными остаются показатели центрального аортального давления у пациентов с сочетанием АГ и атеросклероза артерий нижних конечностей разной степени выраженности.
Цель исследования – оценка основных параметров ЦАД у пациентов с АГ и атеросклерозом артерий нижних конечностей (ААНК).
МАТЕРИАЛ И МЕТОДЫ
Работа была выполнена на базе Ростовской областной клинической больницы г. Ростова-на-Дону. Протокол исследования одобрен локальным независимым этическим комитетом ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, все участники дали письменное добровольное информированное согласие на участие в исследовании.
В исследование было включено 120 пациентов с АГ, средний возраст которых составил 62,1±3,12 лет.
Критериями исключения являлись наличие острого коронарного синдрома (ОКС), транзиторной ишемической атаки (ТИА) или острого нарушения мозгового кровообращения (ОНМК) в течение последних шести месяцев, вторичные формы АГ, постоянная форма фибрилляции или трепетания предсердий, гемодинамически значимые пороки сердца, декомпенсация сердечной, почечной или печеночной недостаточности.
Все участники, включенные в исследование, были разделены на 3 группы в зависимости от наличия и клинических проявлений ААНК:
- 1-я группа – 46 пациентов с АГ и клинически манифестированным ААНК (средний возраст 61,7±5,5 лет);
- 2-я группа – 39 пациентов с АГ и бессимптомным ААНК (средний возраст 63,8±8,1 лет);
- 3-я группа – 35 пациентов с АГ без ААНК (средний возраст 60,8±8 лет).
Группы больных были сопоставимы по длительности АГ (р >0,05). Все пациенты получали антигипертензивную терапию с учетом клинических рекомендаций [7]. Несмотря на проводимую антигипертензивную терапию, у пациентов всех групп значения АД превышали целевые уровни. Достигнутая степень АГ при офисном измерении значимо не отличалась между группами: в 1-й группе в 22% случаев значения АД соответствовали 1-й степени, в 39% – 2-й степени и в тех же 39% – 3-й степени АГ; во 2-й группе 1-я степень АГ наблюдалась в 31% случаев, 2-я степень – в 36%, 3-я степень – в 33%; у пациентов с АГ без ААНК в 34% случаев регистрировались показатели АД, соответствующие 1-й степени, в 34% – 2-й степени и в 32% – 3-й степени АГ.
Все пациенты с АГ и клинически манифестированным ААНК имели III стадию гипертонической болезни (ГБ), что было значимо больше чем во 2-й (р=0,027) и 3-й (р <0,001) группах. У большинства пациентов 2-й группы была III стадия ГБ (90%). В группе пациентов с АГ без сопутствующего ААНК в 37% случаев диагностировали II стадию и в 63% – III стадию ГБ. Отличия между группами были статистически значимы (p=0,007).
Степень атеросклеротического поражения артерий нижних конечностей оценивали при помощи ультразвукового триплексного сканирования (УЗТС) артерий нижних конечностей. Согласно клинической классификации Фонтэна–Покровского [11], у 50% пациентов 1-й группы определялась II стадия хронической ишемии нижних конечностей (ХИНК), у 28,2% – III стадия и у 21,8% – IV стадия. У всех пациентов 2-й группы была установлена I стадия ХИНК.
Среди больных АГ и ААНК разной степени выраженности было значимо больше пациентов мужского пола (р <0,001). В 1-й группе пациентов, имеющих АГ и клинически манифестированные ААНК, курильщики встречались чаще (61%) в сравнении с участниками 2-й (31%; р=0,006) и 3-й (26%; р=0,002) групп.
Частота встречаемости кардиоваскулярных событий в анамнезе (острый коронарный синдром, транзиторная ишемическая атака или острое нарушение мозгового кровообращения) значимо не отличалась между группами.
Всем пациентам были проведены общеклинические, лабораторные и инструментальные методы исследования, включающие электрокардиографию, эхокардиографию, УЗТС артерий нижних конечностей, суточное мониторирование артериального давления (СМАД) с определением показателей систолического (САД), диастолического (ДАД), пульсового АД (ПАД) и их вариабельности, степени ночного снижения АД и индексов гипертонической нагрузки. Параметры ЦАД измерялись на приборе для СМАД BP Lab («Петр Телегин», г. Нижний Новгород) с использованием программного обеспечения Vasotens, при этом оценивались следующие показатели: центральное САД (цСАД), центральное ДАД (цДАД), центральное ПАД (цПАД), индекс аугментации в аорте (augmentation index, AIXao), амплификация пульсового давления (pulse pressure amplification, PPA), длительность периода изгнания левого желудочка (ejection duration, ED), индекс эффективности субэндокардиального кровотока (subendocardial viability ratio, SEVR).
Статистическая обработка данных осуществлялась при помощи программ Microsoft Office Excel 16 (2015, Microsoft, США), STATISTICA 10.0 (StatSoft, США) и IBM SPSS STATISTICA 26.0 (IBM, США). Сравнительный анализ для определения статистически значимых различий количественных данных проводился с использованием параметрических (t-критерий Стьюдента, метода ANOVA) и непараметрических (Манна–Уитни, Краскела–Уолиса) критериев. Для выборок, которые подчиняются нормальному закону распределения (НЗР), данные представлены в форме доверительного интервала M ± SD, где М – среднее значение (математическое ожидание), SD – стандартное отклонение, а для выборок, не подчиняющихся НЗР, описательные данные приведены в виде медианы и квартилей 25 и 75% Me [Q1; Q3]. При межгрупповом сравнении апостериорный анализ проводился с поправкой Бонферрони. Статистически значимыми признавались различия величин при уровне р <0,017 в случае сравнения трех групп. Корреляционный анализ был выполнен с применением коэффициента ранговой корреляции Спирмена.
РЕЗУЛЬТАТЫ
Сравнительная характеристика параметров цСАД, цДАД и цПАД у пациентов, включенных в исследование, отражена на рисунке 1.
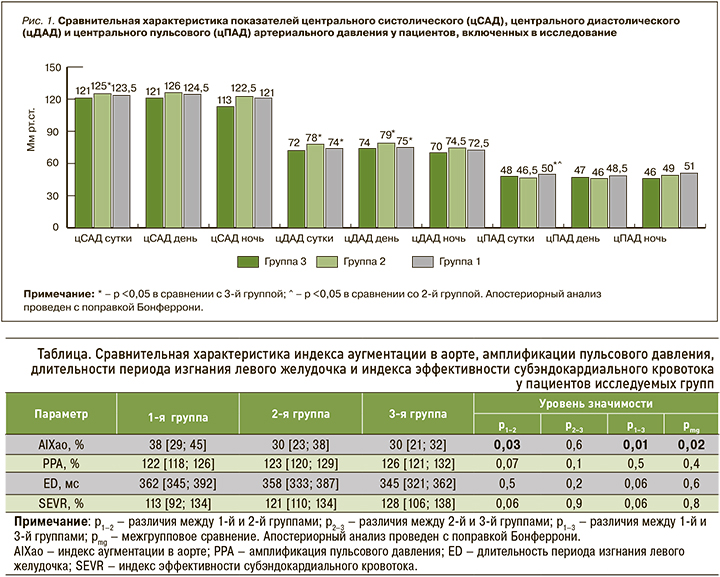
Анализ полученных данных свидетельствует о статистически значимо более высоких среднесуточных показателях цСАД у пациентов 2-й группы (125 [115; 137] мм рт.ст.) в сравнении с 3-й группой (121 [113; 127] мм рт.ст.; р=0,04). При оценке дневного цСАД не было выявлено статистически значимых отличий между группами, однако отмечалась отчетливая тенденция к регистрации более высоких значений в группе пациентов с АГ и бессимптомным атеросклеротическим поражением артерий нижних конечностей в сравнении с пациентами 3-й группы с АГ без сопутствующего ААНК (р=0,08).
Следует обратить внимание, что полученные величины цСАД у пациентов всех групп находились в пределах референсных значений, впервые предложенных в 2014 г. [12]. Однако, согласно данным некоторым исследованиям, увеличение среднесуточного цСАД уже более 111 мм рт.ст. ассоциировано с бессимптомным поражением органов-мишеней [13]. В настоящем исследовании уровни среднесуточного цСАД во всех группах превышали данные показатели.
Анализ среднесуточных и дневных показателей цДАД (мм рт.ст.) выявил статистически значимо более высокие их величины у пациентов 2-й группы (78 [74; 85] и 79 [73; 86] мм рт.ст. соответственно) в сравнении с 1-й (74 [70; 80]) и 75 [71; 81] мм рт.ст. соответственно) и 3-й (72 [68; 79] мм рт.ст. и 74 [69; 81] мм рт.ст. соответственно) группами (р <0,05).
Анализ значений цПАД (мм рт.ст.) продемонстрировал значимо более высокие среднесуточные показатели цПАД у больных с АГ и клинически манифестированным ААНК (50 [40; 56] мм рт.ст.) в сравнении с пациентами 2-й (46,5 [39 ;52] мм рт.ст., р=0,03) и 3-й (48 [38; 57] мм рт.ст., р=0,04) групп. При этом значимых отличий между группами по цПАД в дневные и ночные часы обнаружено не было (р >0,05).
Сравнительная характеристика AIXao, PPA, ED и SEVR у пациентов исследуемых групп приведена в таблице.
Анализ полученных данных позволил установить статистически значимо более высокие показатели AIXao (%) у пациентов 1-й группы в сравнении со 2-й (р=0,03) и 3-й (р=0,01) группами.
При оценке PPA (%) не было выявлено значимых отличий между группами, однако отчетливая тенденция к регистрации более низких значений у пациентов 1-й группы в сравнении со 2-й группой (р=0,07) может свидетельствовать о большей сосудистой жесткости у пациентов, имеющих АГ и выраженный ААНК.
Статистический анализ ED (мс) не обнаружил значимых отличий между группами, однако наблюдалась тенденция к регистрации более высоких показателей у пациентов 1-й группы в сравнении с 3-й группой (р=0,06); это может опосредованно свидетельствовать о более выраженном нарушении функции левого желудочка (ЛЖ) у пациентов с АГ и клинически манифестированным ААНК.
При анализе значений SEVR (%) не было найдено статистически значимых отличий между группами (р >0,05). Вместе с тем выявленная тенденция к регистрации более низких показателей у пациентов 1-й группы в сравнении со 2-й и 3-й группами (р=0,06) может косвенно указывать на наличие систолической дисфункции у больных АГ в сочетании с выраженным ААНК.
Особое внимание было уделено оценке взаимосвязи степени стенозирования (%) артерий нижних конечностей, определяемой по данным УЗТС у пациентов с АГ и сопутствующим ААНК разной степени выраженности, с центральным индексом аугментации. Проведенный корреляционный анализ показал прямую связь умеренной силы (r=0,319, р=0,003) между AIXao и процентом стеноза у пациентов с АГ и ААНК (рис. 2). Так, при увеличении степени стенозирования на 1% значение AIXao возрастало на 0,237%.
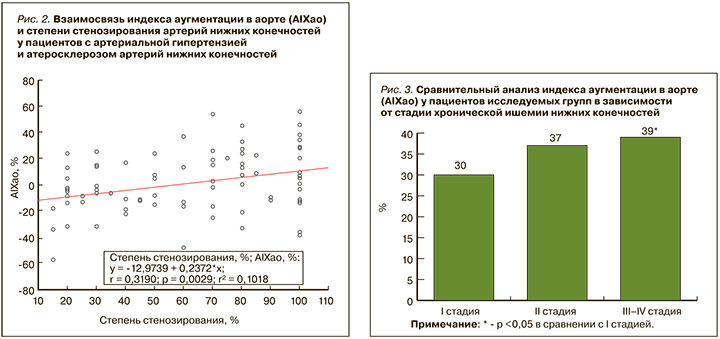
Не меньший интерес представляет анализ параметров центральной гемодинамики у пациентов с АГ и сопутствующим ААНК с учетом стадийности хронической ишемии нижних конечностей (ХИНК). Нами были выявлены более высокие значения цДАД (78 [74; 86] мм рт.ст.) у больных с I стадией ХИНК относительно пациентов со II стадией (73 [70; 77] мм рт.ст., р=0,021). Кроме того, отмечалась тенденция к регистрации более высоких показателей цПАД у больных с критической ишемией нижних конечностей (III–IV стадия) по сравнению с пациентами с I (р=0,09) и II (р=0,07) стадиями ХИНК.
Анализ показателя AIXao (рис. 3) свидетельствует о существенно более высоких его значениях у пациентов с критической ишемией нижних конечностей (39% [29; 46]), которые значимо превосходили аналогичные величины у пациентов с бессимптомным течением ААНК (р=0,014).
Не было установлено статистически значимых отличий между показателями PPA, ED и SEVR у участников исследования с АГ и сопутствующим ААНК с учетом стадий ХИНК, однако наблюдалась тенденция к более высоким значениям SEVR у пациентов с бессимптомным течением ААНК в сравнении с больными АГ и II стадией ХИНК (р=0,09).
ОБСУЖДЕНИЕ
Увеличение жесткости сосудистой стенки выступает фактором, влияющим на показатели не только периферического, но и центрального АД. Повышение артериальной ригидности способствует изменению показателей цСАД, цДАД и цПАД, что является предиктором развития сердечно-сосудистых осложнений [14]. Согласно данным литературы, увеличение жесткости сосудистой стенки приводит к нарушению поглощения отраженной волны в аорте, тем самым повышая скорость ее распространения. Это, в свою очередь, способствует повышению цСАД, цПАД и снижению цДАД [15].
Известно, что повышение АД, наличие эндотелиальной дисфункции на фоне атеросклеротического поражения ассоциировано с увеличением сосудистой жесткости периферических артерий у пациентов с АГ [16–18]. В настоящем исследовании, посвященном оценке показателей ЦАД, выявлено, что больные с АГ и ААНК разной степени выраженности имеют более высокие среднесуточные значения цСАД относительно пациентов с АГ без сопутствующего ААНК; это, по всей видимости, обусловлено меньшей эластичностью магистральных артерий при наличии периферического атеросклероза.
Следует отметить, что возрастание среднесуточных и дневных значений цДАД у пациентов с АГ при сопутствующем бессимптомном течении ААНК в сравнении с больными АГ без периферического атеросклероза, возможно, обусловлено кратковременным увеличением растяжимости аортальной стенки на начальных стадиях развития атеросклероза в результате инфильтрации интимы липопротеидов низкой плотности (ЛПНП). Вместе с тем более низкие среднесуточные и дневные показатели цДАД у пациентов с АГ и клинически манифестированным ААНК, в сравнении с больными АГ и бессимптомным ААНК, свидетельствуют о более выраженном нарушении эластических свойств магистральных артерий.
Наиболее высокие значения среднесуточного цПАД, зарегистрированные у пациентов с АГ и клинически манифестированным ААНК, указывают на наличие выраженного ремоделирования артерий крупного и среднего калибра, большей нагрузки на миокард ЛЖ и ассоциированы с высоким кардиоваскулярным риском.
Проведенный анализ AIXaо продемонстрировал, что для пациентов с АГ и сопутствующим ААНК, особенно больных с критической ишемией нижних конечностей, характерно значимое увеличение этого показателя, что может быть обусловлено прогрессивным увеличением аортальной жесткости в результате выраженных процессов атеросклероза и артериосклероза у данной категории больных.
Выявленные особенности позволяют сделать вывод, что у пациентов, имеющих АГ и сопутствующий ААНК, вне зависимости от клинических проявлений отмечаются более выраженные в сравнении с больными АГ без ААНК патологические изменения параметров суточного профиля центрального АД и, следовательно, более выраженное ремоделирование магистральных сосудов, более значимое поражение органов-мишеней. Все это является фактором риска развития фатальных и нефатальных кардиоваскулярных событий.
ЗАКЛЮЧЕНИЕ
Статистически значимо более высокие показатели цПАД, AIXао и более низкие цДАД у пациентов с АГ и манифестированным ААНК свидетельствуют о более выраженном нарушении у них упруго-эластических свойств магистральных артерий. Полученные данные позволяют судить о большей постнагрузке на ЛЖ и снижении коронарной перфузии на фоне уменьшения диастолического наполнения ЛЖ у больных этой группы.
Также в проведенном исследовании выявлена зависимость аортальной жесткости от степени стеноза артерий нижних конечностей.



