ВВЕДЕНИЕ
Пандемия COVID-19 нанесла серьезный урон человечеству, в том числе с точки зрения ухудшения исходов сердечно-сосудистых заболеваний (ССЗ). Еще год назад сообщалось, что, по данным американских ученых, с марта 2020 г. по январь 2021 г. в США общий прирост смертности составил 23%, причем смертность от ССЗ увеличилась на 4,8% [1]. В России наблюдается аналогичная тенденция. Из-за усугубления уже имеющейся кардиальной патологии (артериальной гипертензии, ишемической болезни сердца, нарушений в системе гемостаза и др.) происходит рост смертности пациентов с новой коронавирусной инфекцией, кроме того, прямое воздействие вируса SARS-CoV-2 приводит к развитию различных сердечно-сосудистых осложнений (сердечной недостаточности, миокардита, аритмий, повреждений миокарда, тромбоэмболий, инфаркта миокарда и др.). Так, увеличение уровня тропонина как признак повреждения миокарда имеют до 30% госпитализированных пациентов с острым COVID-19, что ассоциировано с повышением общей смертности в 3 раза [2].
Наличие коморбидной сердечно-сосудистой патологии, сахарного диабета, ожирения определяет неблагоприятный прогноз в течении инфекции COVID-19 и высокий риск ухудшения функциональных возможностей соответствующих пациентов после выздоровления [3].
У госпитализированных пациентов с COVID-19 в более чем 20% случаев наблюдается повреждение миокарда, включая миокардит со снижением систолической функции и появлением аритмий [4]. Развивающиеся повреждения могут развиваться вторично по отношению к тяжелому повреждению легочной ткани вследствие «цитокинового шторма» или на фоне острого гипоксического повреждения. Вместе с тем частым сценарием заболевания является и прямая инфекция сердца, особенно у пациентов с сопутствующими патологиями.
Ключевым механизмом проникновения SARS- CoV-2 в клетки выступает его связывание с рецептором ангиотензинпревращающего фермента 2 (АПФ 2) [4]. Для определения роли АПФ 2 в сердце Tucker N.R. et al. оценили уровень экспрессии АПФ 2 в образцах клеток миокарда человека путем РНК-секвенирования [5]. Анализ выявил значительное повышение уровня АПФ 2 в кардиомиоцитах у пациентов с сердечной патологией. Эти данные свидетельствуют в пользу большей подверженности пациентов развитию COVID-19 при патологии сердца.
Исследователи Oudit G.Y. et al. в 2000-х гг. обнаружили у пациентов, которые перенесли в 2003 г. так называемую атипичную пневмонию, вызванную SARS-CoV, дисбаланс ренин-ангиотензин- альдостероновой системы (РААС) [6]. Высокий уровень циркулирующего ангиотензина II приводит к повреждению кардиомиоцитов, вызывая цитопатический эффект [7]. SARS-CoV-2 гомологичен бета-коронавирусу SARS-CoV человека на 82% и имеет одинаковые с ним механизмы заражения, вызывая подобные патологические эффекты [8]. Sharma A. et al. показали рост клеточной гибели путем апоптоза при заражении вирусом SARS-CoV-2 индуцибельных плюрипотентных стволовых клеток кардиомиоцитов (hiPSC-CM) [9]. Совокупность вышеперечисленных данных свидетельствует об особой тяжести течения COVID-19 при наличии кардиальной патологии.
Результаты многих исследований демонстрируют значимость артериальной гипертензии и ишемической болезни сердца (ИБС) как факторов риска неблагоприятного исхода у пациентов с COVID-19 [10–12]. При этом связь между COVID-19 и ССЗ имеет двунаправленный характер. Пациенты с ИБС имеют стойкую эндотелиальную дисфункцию и больше восприимчивы к инфекции SARS-CoV-2. [13]. С другой стороны, на фоне тяжелого воспаления наблюдается повреждение эндотелия [14].
Развитие эндотелиальной дисфункции при инфекции COVID 19 приводит к полиорганности поражения [15]. Это подтверждается результатами посмертных исследований, которые указывают на высокую распространенность тромбоэмболических осложнений при новой коронавирусной инфекции [16, 17]. Повреждение эндотелия активирует свертывающую систему через воздействие тканевого фактора и др., что сопровождается развитием гиперкоагуляционного синдрома [18].
Таким образом, наличие сопутствующей сердечно-сосудистой патологии предполагает высокий риск кардиоваскулярных осложнений и высокую вероятность тяжелого течения COVID-19. Эндотелиальная дисфункция, гипоксемия, системная воспалительная реакция, активация системы гемостаза протромботического характера вызывают ухудшение течения ИБС как в острой фазе COVID-19, так и в постковидном периоде [19].
Изучение связи и вклада инфекции COVID-19 в развитие или течение ИБС в настоящее время является очень актуальной задачей. Даже после перенесенной инфекции COVID-19 сохраняющееся длительное воспаление сопровождается повышением С-реактивного белка (СРБ), интерлейкина 6 и способствует развитию атеросклероза [20–22].
Цель исследования – изучить особенности клинической картины, результатов лабораторных и инструментальных исследований у пациентов с новой коронавирусной инфекцией COVID-19 и сопутствующей ИБС, а также сравнить эту группу с пациентами с другими сопутствующими коморбидными патологиями, составляющими обычную популяцию многопрофильного стационара.
МАТЕРИАЛ И МЕТОДЫ
В одноцентровое открытое исследование были включены пациенты, проходившие лечение в перепрофилированном под оказание помощи при COVID-19 эндокринном отделении ГБУЗ «Республиканская больница им. В.А. Баранова» г. Петрозаводска, с декабря 2020 г. по февраль 2021 г. Все пациенты изначально поступали в стационар в связи развитием острой или декомпенсацией соматической патологии. Во время лечения в терапевтическом или хирургическом отделении у них был диагностирован COVID-19. Для продолжения лечения они переводились в специализированное отделение для оказания помощи пациентам с новой коронавирусной инфекцией.
Критерии включения: клинически, лабораторно подтвержденный диагноз COVID-19 (положительный результат тестирования ПЦР), наличие характерных изменений по данным спиральной компьютерной томографии органов грудной клетки, возраст >18 лет, подтвержденный диагноз ИБС, подписанное информированное согласие. Диагноз ИБС верифицировался в соответствии с рекомендациями Европейского общества кардиологов 2019 г. по диагностике и лечению хронических коронарных синдромов [22].
Критерии исключения: отсутствие подписанного информированного согласия, возраст до 18 лет.
При переводе пациентов в профильное отделение для лечения COVID-19 у них был выполнен подробный сбор анамнеза, оценка физикального статуса, спиральная КТ органов грудной полости, стандартные общеклинические и биохимические исследования крови. У всех пациентов получено информированное согласие на обработку их данных.
Статистическая обработка данных включала методы описательной статистики, в частности расчет средних значений, стандартных отклонений, медиан и интерквартильных размахов для показателей числового типа, а также определение абсолютных и относительных (%) частот для показателей бинарного и категориального типа. Для проверки гипотезы о статистической значимости различия выборочного распределения и нормального закона использовался критерий Шапиро–Уилка. Проверка гипотезы о статистической достоверности различия средних значений числовых показателей между основной и контрольной группами проводилась с помощью критерия Стьюдента. В случае статистически значимого отклонения выборочного распределения числовых показателей от нормального применялся непараметрический критерий Манна–Уитни. Статистическая достоверность различия частот между двумя группами оценивалась точным критерием Фишера или критерием χ2. Уровень значимости для отклонения нулевой гипотезы был принят равным 0,05.
Статистические расчеты и графическое отображение результатов исследования выполнялись средствами программного пакета STATISTICA 12.0, а также в программной среде R. Результаты представлены как среднее значение (стандартное отклонение) или медиана [первый квартиль; третий квартиль] для числовых показателей и n (%) для переменных категориального и бинарного типа.
РЕЗУЛЬТАТЫ
Объем общей выборки составил 147 человек, включая 71 (48,3%) пациента мужского пола. Средний возраст всех участников исследования равнялся 60,1±15,2 лет.
Все исследованные пациенты перенесли COVID- 19, диагностированный после поступления в многопрофильный стационар, в связи с чем были переведены в специализированное отделение, организованное на базе указанного стационара. Средняя длительность госпитализации в специализированном отделении COVID-19 составила 11,0±6,7 сут. Половина пациентов выборки находилась в этом отделении от 8 до 15 сут, минимальное пребывание составило 2 сут, максимальное – 58.
Для целей сравнительного исследования вся выборка была стратифицирована по признаку наличия/отсутствия ИБС как первичной причины поступления в стационар. В основную группу пациентов с наличием ИБС (далее – «Группа ИБС») вошли 35 человек. В контрольную группу (далее – «Группа К») были включены все пациенты выборки, поступившие в стационар по другим причинам (n=112). Необходимо отметить следующую особенность изучаемой популяции – все участники исследования поступили в стационар для прохождения терапевтического или хирургического лечения патологий, отличных от COVID-19. Таким образом, исследуемая популяция характеризовалась увеличенной коморбидностью по сравнению с популяцией обычных ковидных стационаров, где первичным диагнозом при поступлении является исключительно COVID-19.
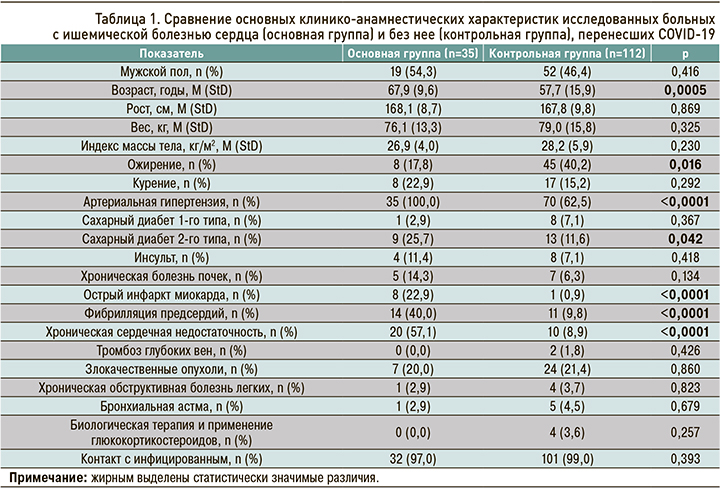
В таблице 1 приведены клинико-анамнестические характеристики больных с ИБС и без нее, которые перенесли COVID-19. Возраст пациентов с ИБС был достоверно выше в сравнении с контролем: 67,9±9,6 против 57,7±15,9 лет. Процент случаев ожирения (ИМТ ≥30 кг/м2) был значимо ниже в Группе ИБС по сравнению Группой К (17,8 против 40,2%). У всех пациентов Группы ИБС отмечалась артериальная гипертензия (АГ), тогда как в Группе К была она встречалась только у 62,5% человек (различие статистически значимо). Также существенное и статистически значимое различие между группами наблюдалось по частоте встречаемости сахарного диабета 2-го типа, острого инфаркта миокарда, фибрилляции предсердий и хронической сердечной недостаточности. Частота этих сопутствующих патологий была значительно выше в Группе ИБС по сравнению с Группой К. На рисунке 1 представлены показатели частоты сопутствующих патологий в группах исследования, которые имели статистически значимое различие.
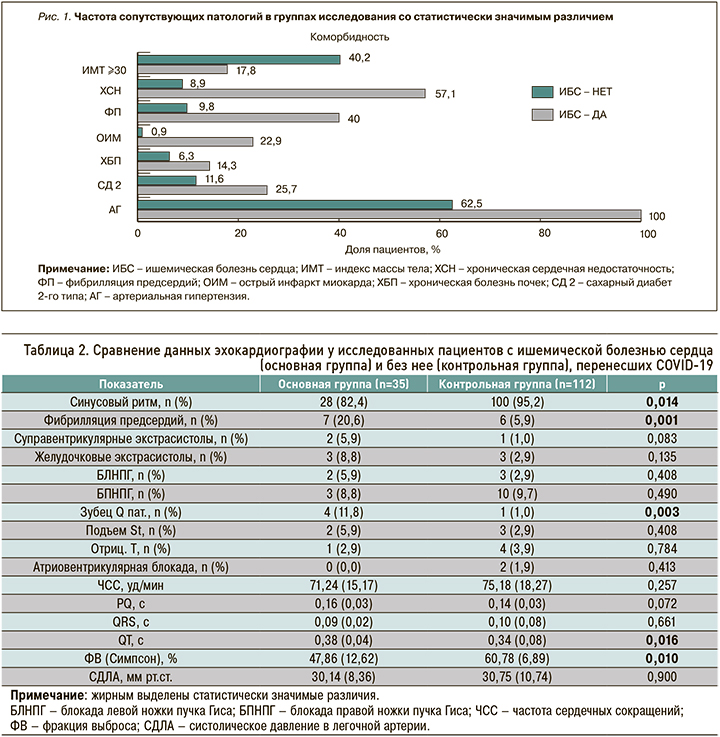
Сравнение результатов электрокардиографии (ЭКГ) и эхокардиографии (ЭхоКГ) у пациентов Группы ИБС и Группы К (табл. 2) позволило отметить статистически достоверное различие между ними по частоте синусового ритма (82,4 против 95,2%), фибрилляции предсердий (20,6 против 5,9%) и патологии зубца Q (11,8 против 1,0%). Интересно, что частота суправентрикулярных экстрасистол в группах исследования тоже отличалась, однако имеющегося объема выборки для убедительного заключения на этот счет недостаточно. Также в Группе ИБС интервал QT был значимо больше (0,38±0,04 против 0,34±0,08 с), а фракция выброса (Симпсон) достоверно ниже (47,86±12,62 против 60,78±6,89%) по сравнению с Группой К. Обращает на себя внимание и различие между группами в среднем значении интервала PQ, хотя оно и не достигло статистической значимости, а имеющийся объем выборки не позволяет сделать достоверное заключение об этом результате сравнения.
Частотное распределение пациентов по тяжести состояния при поступлении в специализированное отделение было приблизительно одинаковым в обеих группах (табл. 3). Доля пациентов, поступивших в тяжелом состоянии, была примерно в 2 раза выше в Группе ИБС по сравнению с группой К, однако это различие не достигло статистической значимости в имевшейся выборке и требует проверки на массиве данных большего объема.
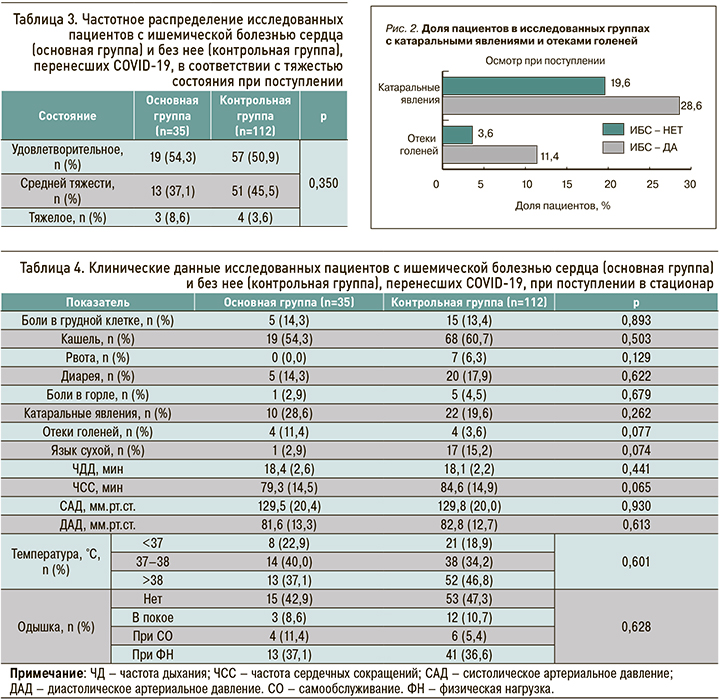
В исследовании не было выявлено статистически значимых различий между группами по зарегистрированным жалобам и клиническим данным пациентов при поступлении в специализированное отделение (табл. 4). Вместе с тем наблюдалось клинически существенное различие встречаемости катаральных явлений и отеков голеней (рис. 2): частота этих симптомов оказалась выше в Группе ИБС по сравнению с Группой К (28,6 против 19,6% и 11,4 против 3,6% соответственно). Стоит также отметить, что в Группе ИБС отмечались более редкая распространенность такого клинического признака, как сухость языка (2,9 против 15,2% в Группе К), и более низкое среднее значение ЧСС при поступлении (79,3±14,5 против 84,6±14,9 уд./ мин в контроле). Последнее может объясняться приемом бета-блокаторов у этой категории больных. Все отмеченные различия не достигли статистической значимости в данной выборке и также требуют проверки на массиве большего объема.
Что касается различных степеней тяжести COVID- 19 у пациентов при поступлении, то статистически значимых различий по частоте их встречаемости между группами обнаружено не было (табл. 5). Степень поражения легочной ткани, как и результаты спиральной КТ органов грудной полости, были примерно одинаковыми в обеих группах. В то же время доля пациентов с низким уровнем сатурации кислорода в крови (<90%) при поступлении была существенно (в более чем 2 раза) выше в Группе ИБС, чем в Группе К (17,1 против 8,0%).
Пациенты с ИБС имеют более тяжелое течение заболевания. Полученные результаты по снижению SpО2 в этой группе нельзя расценивать результатом поражения легких вирусной пневмонией в сочетании с легочным застоем вследствие острой декомпенсации ХСН, так как пациенты оценивались в дебюте инфекции COVID-19 и, как правило, ИБС стояла сопутствующим диагнозом при поступлении в многопрофильный стационар ГБУЗ «Республиканская больница им. В.А. Баранова».
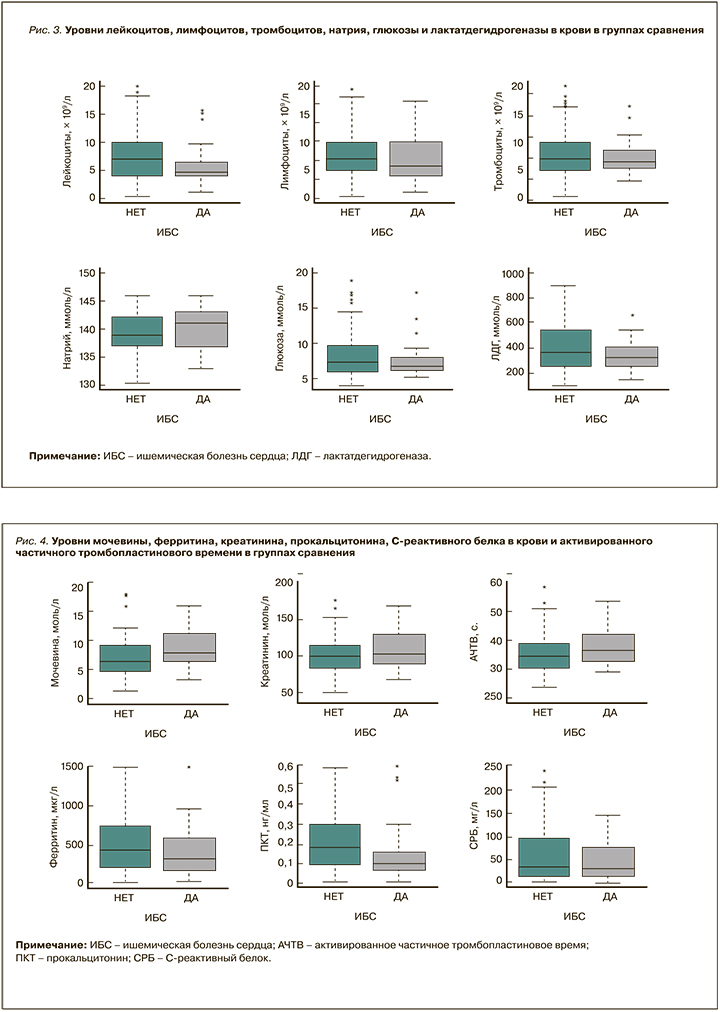
Сравнение результатов лабораторных исследований (табл. 6, рис. 3, 4) показало, что в группе ИБС по сравнению с Группой К были статистически значимо более низкие средние значения уровня лейкоцитов (5,85±3,40 против 7,65 × 109/л ±4,82), более высокий средний уровень натрия (140,56±3,83 против 138,68±4,34 ммоль/л) и активированного частичного тромбопластинового времени (44,28 ±27,71 против 35,72 ±6,45 с). Также в группе ИБС отмечались более высокие значения мочевины, хотя это различие не достигло статистической значимости на представленной выборке. Средние уровни и интервалы значений прокальцитонина и СРБ в группе ИБС оказались несколько ниже относительно группы К.
Длительность госпитализации в специализированном отделении в среднем была несколько больше в группе ИБС по сравнению с контролем (табл. 7), однако данное различие статистически незначимо. Наряду с этим среди пациентов с ИБС наблюдалась более высокая доля летальных исходов (5,7 против 1,8% в контроле), но крайне малый объем данных не позволяет сделать точные выводы о различии в частоте летальности между группами.

ЗАКЛЮЧЕНИЕ
Полученные в нашем исследовании результаты дают основание рассматривать пациентов с ИБС как группу риска более тяжелого течения инфекции COVID-19, что должно определять своевременность госпитализации таких больных и назначение им упреждающей патогенетической терапии. Также наши результаты подтверждают важность оптимизации своевременной диагностики и лечебных мероприятий в этой группе пациентов.
Дальнейшее наблюдение пациентов с COVID-19 и ИБС, выявление сердечно-сосудистых осложнений в последующем периоде, определение сроков и характера осложнений после перенесенной инфекции представляют несомненный интерес и должны стать темой для новых исследований.
Ограничения исследования
Основным ограничением выполненного исследования стал небольшой объем выборки. Для более надежной аргументации выводов, подтвержденной статистической значимостью на заданном уровне, требуется проведение более масштабного клинико-эпидемиологического исследования. Полученные различия между группами больных COVID-19 с ИБС и без ИБС требуют дальнейшего изучения и анализа.



