Комплекс мембранных гликопротеинов (ГП) IIb—IIIa (αIIbβ3-интегрин) обеспечивает способность тромбоцитов к агрегации в местах повреждения сосудов. При активации тромбоцитов протромбогенными агонистами (тромбин, аденозиндифосфат — АДФ, коллаген, тромбоксан А2 — ТХА2 и др.) этот рецептор меняет свою конформацию и в активированном состоянии взаимодействует с фибриногеном, который образует молекулярные связи между активированными тромбоцитами, что и приводит к их «склеиванию» и образованию агрегатов. Врожденный дефицит ГП IIb—IIIa (тромбастения Гланцманна) приводит к полной потере тромбоцитами способности к образованию агрегатов, а лекарственные препараты, блокирующие рецепторную функцию ГП IIb—IIIа, являются наиболее мощными антиагрегантами в современной клинической практике [1, 2].
Исследования фармакодинамики антагонистов ГП IIb—IIIa, созданных на основе моноклональных антител, показали, что при их внутривенном введении агрегационная активность тромбоцитов напрямую коррелирует с количеством свободных, не оккупированных препаратами рецепторов [3, 4]. Однако влияние индивидуальных вариаций содержания ГП IIb—IIIa на агрегацию тромбоцитов остается практически неизученным. Ранее в группе здоровых доноров мы показали, что количество этого рецептора на поверхности тромбоцитов коррелирует с их способностью к агрегации. Эта корреляция была продемонстрирована как при исследовании необработанных, нативных тромбоцитов, так и при добавлении к ним в условиях in vitro ненасыщающих концентраций антагонистов ГП IIb—IIIIa или ацетилсалициловой кислоты (АСК) — антиагрегантного препарата, ингибирующего синтез ТХА2 [5, 6].
В настоящей работе мы исследовали взаимосвязь между содержанием ГП IIb—IIIa и агрегационной активностью тромбоцитов у больных с острым коронарным синдромом (ОКС), которые в качестве стандартной антиагрегантной терапии получали АСК и клопидогрел — антагонист P2Y12 рецептора АДФ.
Материал и методы
Больные. В исследование были включены 89 больных с ОКС, находящихся на лечении в отделе неотложной кардиологии Российского кардиологического научно-производственного комплекса Минздравсоцразвития: 69 больных с острым инфарктом миокарда с подъемом сегмента ST (ОКС с подъемом сегмента ST — ОКСПST), 3 с инфарктом миокарда без подъема сегмента ST и 17 с нестабильной стенокардией (ОКС без подъема сегмента ST — ОКСБПST). ОКСПST диагностировали у больных с типичным ангинозным приступом, сопровождающимся стойким (не менее 20 мин) подъемом сегмента ST в сочетании с повышением уровня маркеров некроза миокарда. Диагноз ОКСБПST выставляли на основании как минимум 2 из следующих критериев: 1) ангинозная боль продолжительностью не менее 20 мин; 2) положительная реакция на тропонин; 3) признаки ишемии миокарда (снижение сегмента ST ≥1 мм или инверсия Т >3 мм в 2 последовательных отведениях.
42 больным с ОКСПST проводили тромболитическую терапию. Чрезкожная транлюминальная коронарная ангиопластика в первые сутки после поступления выполнена 27 больным. В качестве антиагрегантной терапии все больные принимали АСК (в 1-е сутки — нагрузочная доза 300 мг для больных, которые еще не получали АСК, затем 100 мг/сут) и клопидогрел (1-е сутки — нагрузочная доза 300—600 мг, затем 75 мг/сут). Часть больных, которым проводили коронарную ангиопластику, получала внутривенный антагонист ГП IIb—IIIa монафрам. Кроме антиагрегантов, всем больным назначали стандартную терапию, включающую антикоагулянты, β-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента, статины.
Отбор крови. Первый отбор крови для исследования тромбоцитов обычно проводили в течение первого часа после поступления больных в блок интенсивной терапии. По возможности кровь собирали после того как больные получали нагрузочную дозу АСК (обычно на догоспитальном этапе), но до приема нагрузочной дозы клопидогрела. Второй отбор крови проводили на 3—5-е сутки, а третий — на 8—12-й день после поступления (перед выпиской). У отдельных больных не были проведены отборы крови во второй и третьей временны`х точках, в связи тем, что при проведении коронарной ангиопластики, они получали внутривенно антагонист ГП IIb—IIIa монафрам (n=24). У этих больных кровь собирали не раньше чем через 6 дней после введения препарата, т.е. после окончания его действия на тромбоциты [7]. Кроме того, у некоторых больных не были проведены анализы во всех точках в связи со смертью в стационаре (n=2), острым кровотечением (n=2), отказом от участия в исследовании (n=4), ранней выпиской (n=15).
Тромбоциты. Кровь собирали, используя в качестве антикоагулянта 3,8% цитрат натрия в соотношении кровь/антикоагулянт = 9 мл/1 мл. Обогащенную тромбоцитами плазму (ОТП) получали, центрифугируя кровь при 150 g в течение 10 мин при комнатной температуре. После отбора ОТП оставшуюся кровь центрифугировали при 1000 g, 20 мин для получения плазмы без тромбоцитов. Концентрацию тромбоцитов в ОТП определяли в гематологическом счетчике АBACUS Junior B (АBACUS, Австрия). Агрегацию тромбоцитов регистрировали стандартным турбидиметрическим методом, анализируя изменения светопропускания суспензии (Т, %). Исследования проводили в неразведенной ОТП в анализаторе агрегации БИОЛА при температуре 37 °С и перемешивании со скоростью 800 об/мин. АДФ добавляли к ОТП в конечной концентрации 5 или 20 мкМ через 30 с после начала регистрации светопропускания и проводили измерения в течение 4,5 мин после добавления индуктора. При анализе агрегационных кривых определяли максимальный уровень агрегации (T% макс.). Количество ГП IIb—IIIa на поверхности тромбоцитов определяли по связыванию 125I-меченного антитела CRC64 (125I-CRC64) против комплекс-специфичного эпитопа в ГП IIb—IIIa [8]. Антитело метили 125I и измеряли его связывание с тромбоцитами, как описано ранее [5, 6]. 125I-CRC64 в насыщающей концентрации 10 мкг/мл инкубировали с ОТП, предварительно разведенной плазмой до концентрации тромбоцитов 2,5×108/мл, 30 мин при температуре 37 °С в отсутствие (общее связывание) или в присутствии 50-кратного избытка немеченного антитела (неспецифическое связывание). Связанную с тромбоцитами и свободную метку разделяли с помощью центрифугирования ОТП через 20% раствор сахарозы. Специфическое связывание оценивали, как общее минус неспецифическое. Содержание ГП IIb—IIIa рассчитывали, как количество молекул связавшегося антитела на 1 тромбоцит.
Статистика. Статистический анализ проводили с помощью программы Statistica 9 for Windows. Распределение переменных либо имело нормальный характер (критерий Шапиро—Вилкса), либо их количество было достаточно большим (более 50—60) для использования параметрических методов. Различия между переменными определяли с помощью критерия Стьюдента. Корреляции оценивали, используя критерий Пирсона. Различия и корреляции считали достоверными при р<0,05. Данные представляли в виде средних ± стандартные отклонения.
Результаты и обсуждение
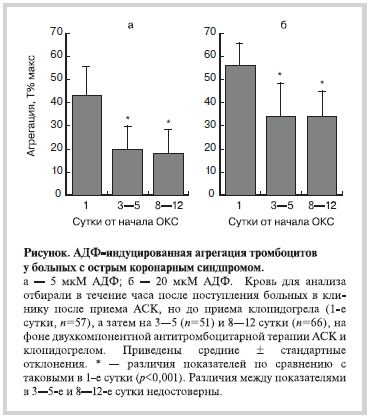
Анализ агрегации тромбоцитов в первые часы после поступления больных с ОКС в блок интенсивной терапии проводили после приема АСК (обычно на догоспитальном этапе), но до начала терапии клопидогрелом. Средний уровень агрегации составил 43,6±11,1 и 55,4±9,3 T% макс. для 5 и 20 мкМ АДФ соответственно (средние ± стандартные отклонения, n=57, см. рисунок). Показатели агрегации в этой временной точке (1-е сутки) у больных, которые успели получить нагрузочную дозу клопидогрела, статистически не анализировали. Это было обусловлено тем, что, в отличие от быстродействующего АСК, максимальный фармакологический эффект которого достигается менее чем за 30 мин [9, 10], действие клопидогрела, являющегося пролекарством (активный метаболит образуется в печени с участием цитохрома P-450), даже при использовании нагрузочной дозы развивается постепенно, в течение 3—5 ч, и крайне вариабельно в зависимости от индивидуальных особенностей фармакокинетики [11, 12]. На 3—5-е сутки, т.е. после достаточно длительного периода от начала терапии клопидогрелом, средний уровень агрегации снижался соответственно на 54 и 40% при ее стимуляции 5 и 20 мкМ АДФ и затем на 8—12-е сутки не изменялся (см. рисунок).
Содержание ГП IIb—IIIa на поверхности тромбоцитов, которое определяли как максимальное связывание 125I-меченного моноклонального антитела CRC64, варьировало от 31 100 до 73 000 на 1 тромбоцит при среднем уровне 48 500±900 (среднее ± стандартное отклонение). Мы не обнаружили различий по среднему количеству ГП IIb—IIIa в 1, 3—5 и 8—12-е сутки после развития ОКС (табл. 1). Содержание ГП IIb—IIIa также существенно не изменялось при повторных измерениях у одного и того же больного — коэффициент вариации составил 6,1% (n=188), а отклонения от среднего уровня (для отдельного больного) в 90% случаев не превысили 10%. Примеры повторных измерений у больных с разным содержанием ГП IIb—IIIa представлены в табл. 1. Эти результаты в принципе соответствуют данным, полученным нами ранее в группе здоровых добровольцев, у которых мы также зафиксировали достаточно стабильные показатели содержания ГП IIb—IIIa при проведении повторных измерений [6].
Таблица 1. Содержание ГП IIb—IIIa у больных с ОКС в разные сроки от начала заболевания
Примечание. * — различия между средними показателями недостоверны; ** — представлены примеры больных с низким, средним и высоким содержанием ГП IIb—IIIa.
Во всех временных точках мы проанализировали взаимосвязь между показателями агрегации и количеством ГП IIb—IIIa. В 1-е сутки, на фоне приема АСК, но до приема клопидогрела, были выявлены высокодостоверные положительные корреляции между максимальным уровнем агрегации и количеством ГП IIb—IIIa — коэффициенты корреляции (r) 0,425 и 0,470 для 5 и 20 мкМ АДФ (n=57; p<0,001) (табл. 2). Сходные данные были нами получены ранее в группе здоровых добровольцев при добавлении АСК к тромбоцитам в условиях in vitro [6]. Однако на 3—5-е и 8—12-е дни не было зарегистрировано даже тенденции к подобным положительным взаимосвязям— ни один из коэффициентов корреляции между количеством ГП IIb—IIIa и уровнем агрегации в этот период не имел положительного значения (см. табл. 2). В это время больные в качестве антиагрегантной терапии, кроме АСК получали клопидогрел. Хорошо известно, что эффекты клопидогрела, активный метаболит которого инактивирует P2Y12 рецептор АДФ, крайне вариабельны и зависят от особенностей его метаболических превращений, в которые вовлечены эстеразы и несколько изоформ цитохрома P-450 [11, 12]. В связи с этим можно предположить, что в таких условиях показатели АДФ-индуцированной агрегации определяются в первую очередь индивидуальными характеристиками действия этого препарата, а не какими-либо другими факторами, в том числе вариациями содержания ГП IIb—IIIa.
Таблица 2. Корреляции между содержанием ГП IIb—IIIa и агрегацией тромбоцитов у больных с ОКС в разные сроки от начала заболевания и на фоне разной антиагрегантной терапии
Примечание. ГП — гликопротеины; ОКС — острый коронарный синдром; АСК — ацетилсалициловая кислота; АДФ — аденозиндифосфат.
Заключение
Впервые обнаружена положительная взаимосвязь между содержанием гликопротеинов IIb—IIIa и показателями АДФ-индуцированной агрегации тромбоцитов у больных с острым коронарным синдромом. Положительные корреляции была выявлены в первые часы после развития заболевания на фоне приема ингибитора синтеза тромбоксана А2 ацетилсалициловой кислоты. Эти взаимосвязи не фиксировались после получения больными в дополнение к ацетилсалициловой кислоте клопидогрела — ингибитора P2Y12 АДФ-рецептора тромбоцитов, что может быть обусловлено существенной индивидуальной вариабельностью действия этого препарата.
Работа выполнена при финансовой поддержке РФФИ (грант № 09-04-00175а) и правительства Москвы (государственный контракт № 8/3-280н-10)



