Ишемическая болезнь сердца (ИБС) остается важнейшей медико-социальной проблемой в ведущих индустриально развитых странах мира [1]. Несмотря на успехи, достигнутые в лечении заболевания, прогноз для больных ИБС остается неблагоприятным: в течение одного года летальные исходы и нефатальные сердечно-сосудистые осложнения (ССО) регистрируются почти в 10% случаев [2]. Одним из факторов риска неблагоприятного развития ИБС является высокая частота сердечных сокращений (ЧСС) [3]. Известно также, что ЧСС прямо пропорциональна и частоте приступов стенокардии [4, 5]. Причины этого — снижение на фоне высокой ЧСС скорости коронарного кровотока [6] при одновременном увеличении потребности миокарда в кислороде [7]. Кроме того, в ряде исследований отмечена ассоциация высокой ЧСС с прогрессированием атеросклероза [8, 9] и нестабильностью атеросклеротической бляшки [10]. К лекарственным средствам отрицательного хронотропного действия относят β-адреноблокаторы, недигидропиридиновые антагонисты кальция и недавно введенный в клиническую практику блокатор If-каналов ивабрадин. Несмотря на имеющийся выбор препаратов из класса β-адреноблокаторов, у многих больных ИБС повседневная ЧСС превышает 80 уд/мин [4, 5, 11]. Недостаточный контроль ЧСС является результатом того, что в своей повседневной практике врачи, возможно, не ставят перед собой цель достижения определенной ЧСС, считая данный показатель недостаточно воспроизводимым и не являющимся самостоятельным фактором риска [12]. По другим данным, причиной высокой ЧСС может быть отмена β-адреноблокаторов (более чем у 40% больных ИБС в течение года), что может быть связано с недостаточной эффективностью и плохой переносимостью препаратов этого класса [4]. Кроме того, известно, что увеличение доз β-адреноблокаторов и антагонистов кальция недигидропиридинового ряда, а тем более их комбинирование может приводить к чрезмерному снижению артериального давления (АД), нарушению атриовентрикулярной проводимости, снижению сократительной способности миокарда. Не следует забывать также, что повышение дозы даже сверхселективных β-адреноблокаторов может приводить к потере их селективности, нарушению бронхиальной проводимости, периферического артериального кровообращения. Возможно, вследствие этих причин российские врачи часто назначают β-адреноблокаторы в половинных дозах [4]. Однако отмечены безопасность и высокая эффективность комбинации β-адреноблокаторов с блокатором If-каналов ивабрадином (исследование ASSOCIATE) [13]. Этот терапевтический подход позволяет увеличить продолжительность переносимости физической нагрузки до развития приступа стенокардии или появления депрессии сегмента ST [13]. Однако в широкой российской клинической практике эффективность и безопасность этой комбинации ранее не изучались.
Целью настоящего исследования явилась оценка антиангинальной эффективности и переносимости ивабрадина в комбинированной терапии с β-адреноблокаторами у пациентов со стабильной стенокардией.
Материал и методы
Исследование КОНТРОЛЬ (Кораксан в комбинированной терапии с β-адреноблокатором у пациентов
со стабиЛЬной стенокардией: антиангинальная эффективность и переносимость) было многоцентровым проспективным открытым сравнительным в параллельных группах с последовательным включением пациентов.
В исследовании приняли участие 505 врачей из 89 городов и иных населенных пунктов Российской Федерации, из них 293 (59%) кардиолога, 170 (34%) терапевтов, 37 (7%) врачей других специальностей. В 5 случаях специальность врачей указана не была. Период проведения исследования: с 20.05.2008 г. по 19.07.2009 г. В исследование включали пациентов в возрасте старше 18 лет со стенокардией напряжения II—III функционального класса (ФК), у которых длительность
анамнеза стабильной стенокардии составляла 3 мес и более, частота приступов стенокардии — ≥ 3 в неделю, имелся синусовый ритм с ЧСС ≥ 70 уд/мин, несмотря на использование в регулярной терапии стабильной стенокардии β-адреноблокаторов, с адекватным знанием языка, используемого для анкетного опроса, и подписавших информированное согласие на участие в исследовании.
В исследование не включали пациентов при наличии противопоказаний к применению ивабрадина (известная гиперчувствительность к препарату; АД <90/50 мм рт.ст., хроническая сердечная недостаточность — ХСН III—IV ФК по классификации NYHA; тяжелая печеночная недостаточность; синдром слабости синусного узла; синоатриальная блокада; атриовентрикулярная блокада II—III степени; наличие искусственного водителя ритма; одновременный прием сильных ингибиторов CYP3А4 (в том числе кетоконазола, итраконазола, кларитромицина, эритромицина, джозамицина, телитромицина, нелфинавира, ритонавира, нефазодона); непереносимость галактозы, дефицит лактазы, глюкозогалактозная недостаточность; беременность, период лактации), перенесших инфаркт миокарда (ИМ) или нарушение мозгового кровообращения ранее чем за 6 мес до включения в исследование, с сахарным диабетом (СД) в стадии декомпенсации, при наличии постоянной формы мерцательной аритмии, с заболеваниями щитовидной железы, сопровождающимися нарушением ее функции (тиреотоксикоз либо некомпенсированный гипотиреоз), женщин детородного возраста, не использующих адекватные методы контрацепции, а также больных, страдающих алкоголизмом
или психическими расстройствами.
Рисунок 1. Схема проведения исследования КОНТРОЛЬ.
Схема проведения исследования представлена на рис. 1. В соответствии с протоколом исследования
каждый больной совершал минимум 4 визита к врачу: скрининговый, для включения в группу исследования и затем через 4 и 12 нед независимо от приверженности к проводимому лечению. В группу произвольной терапии врачи включали каждого 1-го пациента, подходящего по критериям включения/исключения для участия в исследовании, последующих 4 пациентов врач включал в группу, получавших ивабрадин (кораксан,
Лаборатории Сервье, Франция). Пациенты этой группы совершали один промежуточный визит (через 2 нед со дня включения в группу для коррекции дозы препарата). В отсутствие достижения целевой ЧСС (55—60 уд/мин) врачам рекомендовалось увеличить дозу препарата до 7,5 мг 2 раза в сутки. При стойком снижении ЧСС<50 уд/мин препарат отменяли. Все визиты совершались в утренние часы, с 9:00 до 11:00 ч. В день визита пациенту рекомендовалось принимать препараты на приеме
у врача.
Всю информацию об эффективности и переносимости лечения, полученную в ходе повторных визитов, вносили в индивидуальные регистрационные карты. После включения в группу исследования, а также на последнем визите всем пациентам для самостоятельного заполнения выдавали Сиэтлский опросник для оценки качества жизни. Свое самочувствие пациенты определяли с помощью 100-миллиметровой визуальной аналоговой шкалы.
Критерии эффективности лечения:
1) изменение числа приступов стенокардии в неделю (первичная цель исследования);
2) изменение числа принятых таблеток (доз) короткодействующих нитратов;
3) частота случаев достижения целевого уровня ЧСС (55—60 уд/мин в покое при последнем визите к врачу);
4) изменение оценки качества жизни (в рамках настоящей публикации не анализируются).
Оценку антиангинальной эффективности лечения и число принятых таблеток (доз) короткодействующих нитратов проводили на основании анализа Дневника пациента и учета данных первой и последней недели исследования.
Дополнительный анализ эффективности лечения включал определение частоты летальных исходов и развития основных ССО (нефатальный ИМ или инсульт, нестабильная стенокардия (НС), экстренная реваскуляризация), обращений за медицинской помощью по экстренным показаниям (вызов бригады скорой помощи, госпитализация), получение листка временной нетрудоспособности.
Эффективность (в том числе ранее проводимого лечения) и переносимость проводимой терапии врачи оценивали по 10-балльной шкале, на которой 1 баллу соответствовала минимальная, 10 баллам — максимальная оценка. В последующем эта оценка была перекодирована таким образом, что низкая эффективность (или переносимость) соответствовала оценке ≤4 балла, удовлетворительная — 5—6 баллов, хорошая — 7—8 баллов, отличная — ≥9 баллов. Еще одним критерием переносимости лечения являлась частота нежелательных реакций, которые врачи отмечали на каждом визите. Кроме
того, исходно и при завершении исследования врачи оценивали тяжесть и стабильность состояния больного. Оценку также проводили по 10-балльной шкале: 1 балл — практически здоров, 10 баллов — тяжелое состояние, при оценке стабильности состояния оценка 1 балл соответствовала стабильному состоянию, 10 баллов — нестабильному, предынфарктному состоянию.
Статистический анализ выполнен с помощью пакета программ SPSS 15.0 (SPSS Inc., США). Количественные переменные представлены в виде среднего арифметического значения ± стандартное отклонение; при оценке различий средних — в виде среднего арифметического значения и 95% доверительного интервала (ДИ). Сравнение количественных переменных в анализируемых группах проводили с применением t-критерия Стьюдента для независимых выборок, при изучении изменения количественных показателей в ходе лечения — с помощью t-критерия Стьюдента для парных значений. В ряде случаев описание количественных признаков проводили с помощью медианы
(25-й процентиль; 75-й процентиль). Сравнение таких показателей проведено с помощью U-критерия Манна— Уитни (при сравнении независимых групп) и критерия Вилкоксона (при парных сравнениях). Сравнение дискретных признаков в независимых группах выполнено с помощью критерия Пирсона χ2 с поправкой на непрерывность по Йетсу. Изменение дискретных признаков в результате лечения определяли по МакНимару. Статистически значимыми считали различия переменных при p<0,05. Коррекция изменения количественных показателей в сравниваемых группах с учетом исходных
различий выполнена с помощью обобщенной линейной модели (Generalized Linear Models). Выделение независимых признаков, определявших исходные различия сравниваемых групп, выполнено с помощью многофакторного логистического регрессионного анализа. Проводили пошаговое исключение статистически незначимых признаков (при p<0,10). Ассоциацию независимых показателей с зависимым бинарным признаком анализировали с помощью однофакторного логистического регрессионного анализа с вычислением отношения шансов (ОШ) и соответствующего 95% ДИ. Атрибутивное значение независимых переменных оценивали по величине «объясненной» регрессионным уравнением дисперсии зависимого признака (R2), рассчитанной по Найджелкерку (диапазон возможных значений от 0 до 100%).
Результаты
Всего в исследование был включен 2421 больной, при этом критериям включения/исключения соответствовали 1777 (73,4%) пациентов. Из числа критериев включения стенокардия напряжения II—III ФК имелась у 2302 (95,1%) больных, ЧСС ≥70 уд/мин — у 2289 (94,5%), в регулярной терапии стабильной стенокардии использовали β-адреноблокаторы 2158 (89,1%). Из числа критериев исключения ХСН III—IV ФК отмечена у 209 (8,6%) больных, нарушения ритма (постоянная форма
мерцательной аритмии, синдром слабости синусового узла, атриовентрикулярная блокада II—III степени) — у 4 (0,2%).
Больные (n=644), не включенные в анализ, были сопоставимы с остальной группой по возрасту, АД,
большинству биохимических характеристик, учтенных в исследовании, а также по эффективности ранее проводимого лечения, степени тяжести и стабильности состояния, оцененных врачами. Вместе с тем у этих больных была ниже ЧСС (83±14 и 86±10 уд/мин соответственно; р<0,001), они чаще страдали атеросклерозом артерий нижних конечностей (13,5 и 8,7%; p<0,001), хронических обструктивных заболеваний легких — ХОБЛ (13,5 и 8,6%; p<0,001) и бронхиальной астмы (8,1 и 2,8%; p<0,001). Основная причина исключения данных этих больных из анализа результатов исследования — отсутствие в регулярной терапии β-адреноблокаторов (59% всех случаев невключения в исследование).
Таблица 1. Общая характеристика больных, включенных в исследование КОНТРОЛЬ.
Общая характеристика больных, включенных в исследование. Общая характеристика пациентов, включенных в исследование, представлена в табл. 1. В группу ивабрадина (5 мг 2 раза в сутки) были включены 1486 (84%) больных, в группу произвольной терапии (лечение на усмотрение врача) — 291 (16%). Сравниваемые группы были сопоставимы по большинству из учтенных клинико-анамнестических показателей. Каждый четвертый пациент был пожилого возраста, 50% — женщины (из них
82% в постменопаузе). Медиана общего числа приступов в неделю накануне исследования была равна 5, числа таблеток короткодействующих нитратов (или доз спрея) — 6. Стенокардия III ФК была определена почти у 30% включенных пациентов, у 50% больных длительность анамнеза стенокардии составила 5 лет и более. Артериальная гипертензия (АГ) была диагностирована более чем у 90%
пациентов, при этом длительность анамнеза АГ была на 4,5 года (при 95% ДИ от 4,2 до 4,8) больше длительности анамнеза стенокардии. Обращает внимание, что в группе больных без АГ в анамнезе (n=153) повышенное АД (≥140 и/или 90 мм рт.ст.) было выявлено на визите включения в 29 (19%) случаях. Среди пациентов с АГ (n=1618) нормальный уровень систолического и диастолического АД был лишь у 370 (23%). Уровень АД был выше у больных, включенных в группу произвольной
тактики лечения (149±19/90±10 мм рт. ст. по сравнению с 145±20/88±11 мм рт.ст. в группе ивабрадина; в обоих случаях p<0,01). Ранее перенесли ИМ и/или НС 49% больных в обеих группах, инсульт и/или транзиторную ишемическую атаку — каждый десятый. Хирургическая реваскуляризация миокарда выполнена у 8% пациентов в общей группе, у 19% из числа перенесших ИМ, у 55% со стенозом коронарной артерии ≥50% по данным коронарографии. У большинства больных имелась ХСН
I—II ФК. У большего числа пациентов в группе получавших ивабрадин имелись СД (1-го или 2-го типа, из них 48% с уровнем глюкозы ≥7,0 ммоль/л), атеросклероз артерий нижних конечностей и хронические заболевания легких. Относительно немного было пациентов с хроническим заболеванием почек (6%), равно как и с уровнем креатинина ≥120жен./136муж. мкмоль/л (2%) или уровнем мочевины >8,3 ммоль/л (6%). Курили 16%, имели семейный анамнез ранних ССО 41% больных, каждый третий
пациент страдал от ожирения, более 40% — от его абдоминальной формы.
Последнее из известных значений фракции выброса было указано для 73% больных и составило 57±8%. Фракция выброса <40% была отмечена лишь у 22 (2%) больных (одинаково часто в сравниваемых группах).
Гиперлипидемия (уровень общего холестерина >5,0 ммоль/л, значения известны для 97% больных) зарегистрирована в 1204 (70%) случаях, гипергликемия (глюкоза натощак > 6,1 ммоль/л, значения известны для 97% больных) — в 297 (17%), из них в 23% — у больных без СД.
Оценка врачами тяжести состояния пациентов на момент включения в исследование в группе иваб-
радина была немного выше, чем у пациентов в группе произвольного лечения: соответственно средняя оценка составила 5,8±1,5 и 5,6±1,5 балла (р=0,036). Стабильность состояния больных в сравниваемых группах, по мнению врачей, была одинаковой (р=0,706), ее оценка составила в общей группе 5,2±1,8 балла.
Терапия в начале исследования. Частота назначения отдельных β-адреноблокаторов, а также их дозы в исследуемых группах были одинаковыми. Более 50% больных применяли бисопролол, каждый третий — метопролол, каждый десятый — небиволол, частота назначения других β-адреноблокаторов не превышала 5% (табл. 2).
Таблица 2. β-Адреноблокаторы, применяемые на момент начала исследования.
Таблица 3. Терапия у пациентов со стенокардией до включения и при завершении исследования.
Помимо β-адреноблокаторов (критерий включения) в регулярной терапии сердечно-сосудистого заболевания (стабильной стенокардии и/или АГ) более 2/3 больных применяли ингибиторы ангиотензинпревращающего фермента, 14% — блокаторы кальциевых каналов, 8% — блокаторы рецепторов ангиотензина II (табл. 3). Около 80% больных принимали ацетилсалициловую кислоту или иной препарат из класса дезагрегантов, чуть более 50% — липидснижающую терапию (в основном статином), каждый пятый — препараты метаболического действия. Все эти лекарственные средства
больными в группах сравнения применялись одинаково часто. Исключение составили тиазидные/тиазидоподобные диуретики, частота применения которых была выше в группе больных произвольной терапии. Около 50% больных в регулярной терапии стабильной стенокардии принимали пролонгированные нитраты.
По мнению врачей, 781 (45%) больной был привержен к проводимой терапии сердечно-сосудистого заболевания, т.е. принимал назначенные препараты регулярно, 816 (47%) больных — нерегулярно (иногда пропускали прием по разным причинам), по разным причинам допускал значительные перерывы в приеме лекарств 151 (8%) пациент. Приверженность к проводимой терапии
больных, включенных в сравниваемые группы, была одинаковой.
С учетом того, что сравниваемые группы различались по ряду клинических характеристик, был проведен многофакторный регрессионный анализ, позволивший показать, что независимыми предикторами включения пациента в группу ивабрадина являлись следующие (указаны в порядке значимости, определенной по величине Вальда χ2):
1) более высокая ЧСС — ОШ 1,031 (1,016—1,046);
2) более низкий уровень систолического АД — ОШ 0,986 (95% ДИ 0,980 – 0,993)
3) наличие СД — ОШ 1,89 (95% ДИ 1,25 — 2,84);
4) наличие ХОБЛ — ОШ 2,54 (95% ДИ 1,31 — 4,92).
В последующем все результаты сравнения эффективности проводимого лечения были скорректированы с учетом этих факторов.

Дозирование ивабрадина в ходе исследования. В соответствии с протоколом исследования больные, включенные в группу ивабрадина, первые 2 нед получали препарат в дозе 5 мг 2 раза в сутки. Через 2 нед увеличение дозы ивабрадина до 7,5 мг 2 раза в сутки потребовалось, по мнению врачей, 659 (44,3%) больным, доза оставлена прежней (10 мг/сут) в 718 (48,3%) случаях, препарат отменен у 14 (0,9%) больных. Информация об изменении дозировки ивабрадина не была указана в 95 (6,4%) случаях. Еще через 2 нед (через 4 нед с момента рандомизации) увеличение дозы ивабрадина
до 7,5 мг 2 раза в сутки потребовалось 231 (15,5%) больному. Доза оставлена прежней (10 или 15 мг/сут) в 1047 (70,5%) случаях, препарат отменен у 27 (1,8%) больных. Информация об изменении дозировки ивабрадина не была указана в 181 (12,2%) случае. Итого, 5 мг ивабрадина 2 раза в сутки к концу исследования получали 570 (38%) больных, 7,5 мг 2 раза в сутки — 766 (52%) больных, препарат был отменен в 41 (3%) случае. Данные, которые позволили бы судить об изменении дозировки
препарата, отсутствовали у 109 (7%) больных.
Терапия при завершении исследования. β-Адреноблокаторы в ходе исследования были отменены
у 5% больных, одинаково часто в группах сравнения. Различия по частоте применения других препаратов, рекомендованных для лечения больных со стабильной стенокардией и/или АГ, в исследуемых группах остались на прежнем уровне (см. табл. 3). Исключение составили нитраты, реже применяемые для регулярной терапии в группе ивабрадина. В группе произвольного лечения, напротив, чаще применяли средства с метаболической активностью. Частота применения диуретиков, как и в начале исследования, была выше в группе произвольной терапии.
Антиангинальная эффективность ивабрадина. Антиангинальная эффективность ивабрадина оценивали на основании данных Дневника пациента. Следует отметить низкую приверженность больных, включенных в исследование, к заполнению дневника. Так, в течение первой (скрининговой) недели заполнили дневник (все поля дневника в течение 7 дней) только 796 (45%) больных, в течение последней — 316 (18%). У больных, не заполнивших дневник в течение последней недели исследования, исходное число приступов стенокардии и таблеток (или доз спрея) короткодействующих
нитратов составило 5 (2; 10) и 1 (0; 8) соответственно. У больных, полностью заполнивших дневник в течение первой и последней недель исследования, приступы стенокардии отмечались существенно чаще — 9 (5; 18) в неделю (p<0,001). Чаще эти больные использовали для купирования приступов и короткодействующие нитраты — 8 (0; 17) таблеток или доз спрея (p<0,001).
У больных, полностью заполнивших дневник, исходное число приступов стенокардии, равно как и число таблеток (или доз спрея) короткодействующих нитратов, принятых по поводу приступа стенокардии, были одинаковыми (табл. 4). Через 12 нед терапии в группе ивабрадина было отмечено существенно большее уменьшение числа приступов в неделю, так что в течение последней недели исследования у пациентов этой группы отмечалось на 4 (при 95% ДИ от 3 до 6) приступа меньше, чем в группе произвольной тактики лечения. В группе ивабрадина около 45% больных в конце исследования не отметили ни одного приступа стенокардии — ОШ такого исхода лечения в этой группе по сравнению с группой произвольного лечения составило 6,1 (при 95% ДИ от 2,6 до 13,9)1. Число больных с 1—2 и 3—4 приступами стенокардии в неделю в сравниваемых группах не различалось. Вместе с тем число больных с 5 и более приступами стенокардии в неделю было
существенно больше в группе произвольной терапии — ОШ 3,1 (при 95% ДИ от 1,5 до 6,2) (рис. 2).
Таблица 4. Число приступов стенокардии и таблеток (доз спрея) короткодействующих нитратов в неделю по результату 12 недельной терапии (по данным Дневника пациента).
Таблица 5. Изменение ЧСС в ходе исследования.
Схожий результат был получен и при анализе изменения числа таблеток (доз спрея) короткодействующих нитратов, принимаемых больными по поводу приступов стенокардии (см. табл. 4). В течение последней недели пациенты группы ивабрадина принимали на 4 (при 95% ДИ от 3 до 6) таблетки (дозы спрея) короткодействующих нитратов в неделю меньше, чем пациенты
из группы сравнения.
Снижение ЧСС. Снижение ЧСС (измеренной врачами) в результате терапии было отмечено у больных обеих групп (табл. 5). Максимальное снижение ЧСС было зафиксировано уже в течение первых 2 нед терапии. В последующем снижение ЧСС было менее выраженным, хотя и статистически значимым (p<0,001), и во всех случаях в 2 раза большим в группе больных, получавших ивабрадин. ЧСС ≤60 уд/мин на 2, 4 и 12-й неделях исследования была достигнута соответственно у каждого десятого, третьего, и второго больного из группы ивабрадина. В группе произвольной терапии этот уровень ЧСС к концу исследования был достигнут только у 6% больных (рис. 3).

Снижение пульса (измеренного больными) было сопоставимо со снижением ЧСС, измеренного врачами.
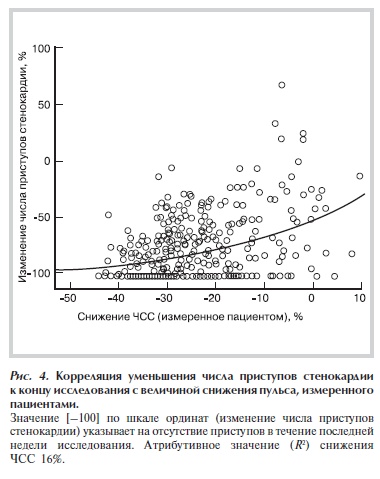
К концу исследования в группе произвольной терапии снижение пульса составило 12 уд/мин (при 95% ДИ от 9 до 15) или 13,6% от исходного, в группе с ивабрадином — 22 уд/мин (при 95% ДИ от 21 до 23) или 25,5% соответственно. Однако величина снижения пульса в большей степени коррелировала со снижением числа приступов стенокардии, чем снижение ЧСС, измеренной врачом (по Спирмену r=0,411 и 0,266 соответственно, в обоих случаях p<0,001; рис. 4).
ССО и обращения за медицинской помощью. Всего за весь период исследования были зарегистрированы 4 летальных исхода, из них 3 от сердечно-сосудистых причин — все в группе больных, получавших ивабрадин (табл. 6). Кроме того, развились 10 нефатальных ИМ и инсультов, были выполнены 6 экстренных реваскуляризаций; частота этих событий в сравниваемых группах
была одинаковой. Вместе с тем в группе ивабрадина был зарегистрирован более низкий риск возникновения НС — скорректированное с учетом исходных различий ОШ 0,29 (при 95% ДИ от 0,12 до 0,63).
Таблица 6. Частота летальных исходов и нефатальных ССО у пациентов со стабильной стенокардией за период проведения исследования.
В ходе исследования была отмечена высокая частота обращений за медицинской помощью (табл. 7). Однако в группе больных, получавших ивабрадин, уже в течение первого месяца терапии частота таких обращений была ниже, чем в группе произвольной терапии. При этом скорректированное ОШ госпитализаций больных в группе ивабрадина составило 0,48 (при 95% ДИ от 0,27 до 0,85), вызова бригады скорой помощи — 0,48 (при 95% ДИ от 0,35 до 0,67). Работающие пациенты реже обращались за получением листка нетрудоспособности — ОШ 0,42 (при 95% ДИ от 0,21 до 0,83). В период с 5-й по 12-ю неделю больные группы ивабрадина, по-прежнему, значительно реже обращались за медицинской помощью в службу скорой помощи — ОШ 0,21 (при 95% ДИ от 0,13 до 0,34). В итоге за весь период исследования больные, получавшие в дополнение к основной терапии ивабрадин, реже госпитализировались — ОШ 0,48 (при 95% ДИ от 0,30 до 0,79), вызывали «Скорую помощь» — ОШ 0,45 (при 95% ДИ 0,33 до 0,61), а работающие — оформляли листок временной нетрудоспособности — ОШ 0,46 (при 95% ДИ от 0,26 до 0,85).
Нежелательные реакции. Побочные эффекты, связанные с проводимым лечением, за весь период исследования были отмечены у 29 (10,0%) больных группы произвольной терапии и у 130 (8,7%) — группы ивабрадина (р=0,580). Эти эффекты подробно были описаны у 26 и 120 больных соответственно (табл. 8). Частота отдельных, а также суммарная частота всех нежелательных реакций в сравниваемых группах не различались. Нарушение зрительного восприятия как наиболее типичного побочного эффекта, наблюдаемого при приеме ивабрадина, было отмечено менее чем у 1% больных.
Эффективность и переносимость терапии. Эффективность лечения стабильной стенокардии, проводи-
мого до начала исследования, по 10-бальной шкале врачи оценили как среднюю в 5,5±1,7 балла у больных, включенных в группу произвольной терапии, и 5,3±1,7 балла — у больных группы ивабрадина
(р=0,061). Через 4 нед оценка эффективности проводимой терапии повысилась в обеих группах до 6,0±1,8 и 7,5±1,7 балла (p<0,001) или на 20 и 67% соответственно. Еще через 8 нед (через 12 нед после разделения на группы) оценка эффективности повысилась до 6,6±1,8 и 8,5±1,4 балла (p<0,001) или на 32 и 93% от исходного уровня соответственно (по сравнению с предыдущим показателем в обоих случаях p<0,001). В период с 4-й по 12-ю недели исследования повышение оценки эффективности проводимой терапии в сравниваемых группах было одинаковым и составило 16 и 18% соответственно (р=0,549).
Исходно «отличная» оценка (9—10 баллов по 10-бальной шкале) эффективности терапии была дана врачами не более чем у 3% больных (рис. 5). К 4-й неделе исследования в группе ивабрадина такая оценка эффективности терапии была дана в каждом четвертом, а к 12-й неделе — в каждом втором случае, что было в 4 раза чаще, чем в группе произвольной терапии.
Переносимость проводимой терапии через 4 нед исследования была оценена врачами в 7,1±1,9 и 8,4±1,7 балла в группе произвольного лечения и в группе ивабрадина соответственно (p<0,001). К концу исследования оценка переносимости в группах сравнения повысилась в одинаковой степени — на 7 и 11% (p=0,189) и составила 7,4±2,0 и 9,1±1,3 балла соответственно.
Таблица 7. Обращения за медицинской помощью за период проведения исследования.
Таблица 8. Нежелательные реакции, зарегистрированные на протяжении всего исследования.
Обсуждение
Результаты, полученные в исследовании КОНТРОЛЬ, свидетельствуют о том, что в обычной клинической практике коррекция основных факторов риска у пациентов со стабильной стенокардией проводится недостаточно хорошо. У многих из них, несмотря на проводимую терапию, остается повышенным АД, отмечаются гиперлипидемия и гипергликемия. Это не позволяет надеяться на получение хороших результатов лечения. Вместе с тем известно, что снижение АД приводит к существенному уменьшению частоты приступов стенокардии [14], равно как и не вызывает сомнений
положительная роль статинов в предупреждении прогрессирования ИБС и развития осложнений этого заболевания [15]. Однако вызывает удивление, что уровень общего холестерина <5,0 ммоль/л был достигнут менее чем у 1/3 из числа включенных в исследование, и это при том, что статины получали более 55% больных. Возможно, данный факт связан с применением статинов в недостаточных дозах или обусловлен низкой приверженностью больных к проводимому лечению (более 50% которых, по свидетельству врачей, допускали перерывы в лечении).

В успешном устранении приступов стенокардии несомненна роль снижения повышенной ЧСС, что
сопровождается уменьшением потребности миокарда в кислороде и устраняет несоответствие между потребностью и доставкой крови к сердцу. Более того, имеются данные в пользу того, что снижение ЧСС
позволяет предупреждать прогрессирование атеросклероза [8, 9], а также снижает вероятность разрыва атеросклеротической бляшки [10]. Тем не менее у пациентов, включенных в исследование КОНТРОЛЬ и имеющих более 3 приступов стенокардии в неделю, даже на фоне приема β-адреноблокаторов ЧСС часто была выше 80 уд/мин, что находит подтверждение и в результатах других отечественных исследований [4]. Причины, по которым β-адреноблокаторы часто назначаются в половинных от рекомендованных доз, неясны, но эта тенденция прослеживается не только в российских, но и в зарубежных исследованиях [4, 5]. Не исключено, что этот факт может быть связан с плохой переносимостью высокодозовой терапии с применением β-адреноблокаторов или опасениями побочных эффектов [4]. Последнее находит подтверждение и в настоящем исследовании: врачи чаще назначали ивабрадин больным с более низким АД, атеросклерозом артерий нижних конечностей, ХОБЛ. Не исключено, что повышение дозы β-адреноблокаторов у таких больных может быть сопряжено с ухудшением течения заболевания и, как результат, отменой β-адреноблокаторов.
В исследовании КОНТРОЛЬ была оценена возможность усиления с помощью ивабрадина отрицательного хронотропного эффекта β-адреноблокаторов и улучшения клинического течения ИБС. Показано, что эта тактика позволяет не только снизить ЧСС и частоту приступов стенокардии, но и частоту возникновения НС, а также частоту обращений за медицинской помощью по экстренным показаниям, частоту получения листков нетрудоспособности. Важно, что при добавлении ивабрадина к терапии, включавшей β-адреноблокаторы, число пациентов с 3 и более приступами стенокардии
в неделю стало существенно меньшим (на 56%), чем в группе произвольной терапии. По данным исследования TIBBS, выживаемость у пациентов с большим числом приступов значительно ниже, чем у тех, кто отмечает менее 2 приступов стенокардии в неделю [16].
Следует подчеркнуть некоторые отличия действия ивабрадина от эффектов β-адреноблокаторов.
Во-первых, ивабрадин не влияет на центральную гемодинамику, т.е. не изменяет АД, сердечный выброс и периферическое сопротивление. В связи с этим он может быть с успехом использован в тех ситуациях, когда назначение β-адреноблокаторов и антагонистов кальция невозможно, например, у пациентов с гипотонией или с перемежающейся хромотой. Кроме того, при сравнительном изучении действия ивабрадина и пропранолола на коронарную гемодинамику при нагрузке было показано, что ивабрадин не препятствует увеличению скорости коронарного кровотока и диаметра коронарных артерий, а также снижению их сопротивления во время физической нагрузки в отличие от пропранолола [17]. Полагают, что подобное действие β-адреноблокаторов на коронарный кровоток отчасти обусловлено их относительным стимулирующим влиянием на α2-рецепторы сосудов [18]. Таким образом, антиангинальный эффект ивабрадина, с одной стороны, обусловлен снижением ЧСС, а с другой, в отличие от β-адреноблокаторов, — поддержанием адекватного коронарного кровотока во время нагрузки. Установлено, что разница в скорости коронарного кровотока во время нагрузки при применении ивабрадина и атенолола может достигать 40%, что, несомненно, важно для пациентов со сниженным коронарным резервом [19].
Заключение
Проведенное исследование показало, что в клинической практике у пациентов со стабильной стенокардией коррекция основных факторов риска проводится недостаточно активно. Гипергликемия отмечается у каждого пятого больного, ожирение — у каждого третьего, высокое артериальное давление и гиперлипидемия — более чем у 70% больных ишемической болезнью сердца. И это при том, что больные, включенные в исследование, получали достаточно активную антиангинальную и антигипертензивную терапию, более 50% из них принимали липидснижающие препараты.
Вместе с тем врачи часто оценивали эффективность проводимой терапии как среднюю, а «отличной» ее считали только в единичных случаях. Комбинированное лечение, включавшее β-адреноблокаторы и ивабрадин (кораксан), по сравнению с терапией без ивабрадина позволило добиться существенного снижения частоты сердечных сокращений, частоты приступов стенокардии, а также риска развития нестабильной стенокардии, обращений за медицинской помощью по экстренным показаниям и получения листков нетрудоспособности. Все это указывает на целесообразность добавления ивабрадина к терапии больных со стабильной стенокардией в отсутствие достаточного отрицательного хронотропного эффекта от лечения с применением β-адреноблокаторов.



