В настоящее время хроническая обструктивная болезнь легких (ХОБЛ) является глобальной проблемой, что связано с постоянно высоким уровнем заболеваемости, а также длительными периодами временной нетрудоспособности, частотой развития инвалидности и высоким уровнем смертности пациентов. Как показано в ряде работ, сердечно-сосудистые заболевания (ССЗ) служат одной из основных причин смерти больных ХОБЛ [1—5].
По современным представлениям, артериальная ригидность является независимым предиктором смерти как от всех причин, так и от ССЗ, прогностически даже более значимым, чем некоторые другие «классические» факторы риска развития ССЗ, например, среднесуточное артериальное давление (АД) или уровень холестерина в крови [6].
Ухудшение эластичности аорты — одно из проявлений естественного процесса старения организма, а уровень жесткости аорты соответствует биологическому возрасту человека. Определение жесткости артериальной стенки и центрального давления предложены в качестве тестов для оценки риска развития ССЗ [6—8]. Основными показателями для оценки эластических свойств артерий и аорты являются скорость распространения пульсовой волны (СРПВ) и индекс аугментации (ИА).
Наиболее полно изучены особенности формирования и клиническое значение артериальной ригидности при атеросклерозе, артериальной гипертензии (АГ), ишемической болезни сердца (ИБС). В то же время очень небольшое число работ посвящено изучению жесткости артериальной стенки при ХОБЛ, хотя, как известно, при ней складываются «благоприятные» условия для формирования сосудистых нарушений [9—11]. Возможные патогенетические механизмы включают дисфункцию эндотелия, повреждение сосудистой стенки, формирующиеся под влиянием гипоксемии, сигаретного дыма, оксидантного стресса, системного воспаления низкой градации [9—11]. Под влиянием данных факторов также может развиваться повышение жесткости артериальной стенки, усугубляющее сосудистые нарушения и способствующее формированию дисфункции сосудов. Избыточная ригидность, с одной стороны, отражает далеко зашедшие изменения геометрии и функции артерий, а с другой — существенно влияет на гемодинамику, увеличивая посленагрузку на миокард и ухудшая коронарную перфузию.
Целью исследования явилось определение артериальной ригидности у больных ХОБЛ с ИБС и в ее отсутствие.
Материал и методы
В открытое исследование были включены 130 больных ХОБЛ вне обострения в возрасте старше 40 лет, подписавших добровольное информированное согласие на участие в исследовании. Все пациенты были мужского пола, средний возраст составил 60,2±8,3 года. Диагноз ХОБЛ устанавливали в соответствии с критериями ATS/ERS (2004 г.) [12] после спирографического исследования. Критерием исключения являлось наличие других тяжелых хронических заболеваний в стадии обострения. По степени тяжести ХОБЛ пациенты были распределены следующим образом: с I стадией — 7,9%, со II стадией — 27,8% пациентов, с III стадией — 38,1% больных и с IV стадией — 26,2%. Средняя длительность заболевания составила 9,1±6,5 года. Контрольную группу составили 18 практически здоровых добровольцев в возрасте старше 50 лет, средний возраст 56,9±7,2 года. Лица группы контроля были сопоставимы с основной группой по возрасту, полу, индексу массы тела, уровню АД.
Все обследованные пациенты были разделены на 2 группы: без ИБС и с проявлениями ИБС (стабильная стенокардия, инфаркт миокарда — ИМ в анамнезе). Из 2-й группы пациентов были отдельно выделены лица, перенесшие ИМ. Диагностика сопутствующей ИБС основывалась на свидетельствах о перенесенном ранее ИМ (типичные изменения на электрокардиограмме — ЭКГ, повышение активности кардиоспецифичных ферментов), а также на типичных клинических проявлениях стенокардии, подтвержденных инструментальными методами исследования (коронарография, суточное мониторирование ЭКГ, нагрузочные тесты с физической нагрузкой).
Все пациенты с ХОБЛ получали стандартную терапию, которая включала бронхолитики короткого и/или длительного действия (м-холинолитики, β2-агонисты), пациенты с ХОБЛ III—IV стадии при наличии показаний принимали ингаляционные кортикостероиды в средних дозах. Больные с ИБС получали по показаниям антиагреганты (100%), ингибиторы ангиотензинпревращающего фермента (80%), пролонгированные нитраты (20%).
Жесткость артериальной стенки определяли с использованием артериографа Tensioclinic. Анализ пульсовой волны выполняли с помощью оригинальной компьютерной программы «Tensiomed». Определяли систолическое АД (САД) и диастолическое АД (ДАД), пульсовое АД, частоту сердечных сокращений (ЧСС), брахиальный и аортальный ИА, СРПВ в аорте, центральное давление в аорте (SBPao), площадь систолического и диастолического компонента пульсовой волны.
Разницу между САД, определенным в аорте и в плечевой артерии (DСАД), определяли по формуле: DСАД=САД в аорте (SBPao) – САД в плечевой артерии [13]. Вычисляли индекс соответствия центрального САД периферическому по формуле: ИС=(SBPao/САД в плечевой артерии)×100.
Статистическую обработку полученных данных проводили с использованием пакета программ Statistica 6.0. Для сравнения двух независимых групп использовали параметрический t-критерий Стьюдента и непараметрический критерий Манна—Уитни. При сравнении групп по частоте выявления признаков использовали критерий c2. Анализ связи двух признаков проводили с помощью коэффициента корреляции Спирмена. Описание признаков, имеющих нормальное распределение, приведено в виде M±s, где М — среднее значение, s — стандартное отклонение. Для признаков с распределением, отличным от нормального, результаты представлены в виде Me [Q1; Q3], где Me — медиана, Q1 — первый квартиль, Q3 — третий квартиль. Результаты считали статистически значимыми при р<0,05.
Результаты и обсуждение
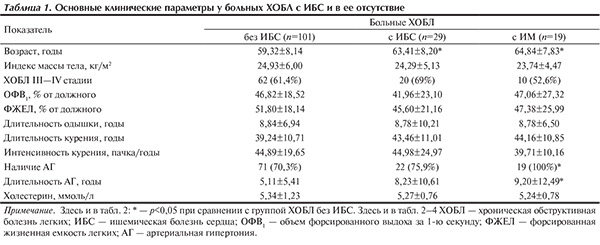
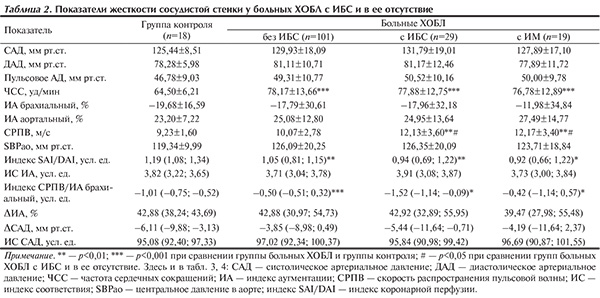
Как представлено в табл. 1, пациенты с ИБС и в ее отсутствие были сопоставимы между собой по основным клиническим параметрам. В то же время пациенты с ИБС были достоверно старше и чаще отмечали в анамнезе АГ, чем пациенты без ИБС, хотя по уровню АД группы были сопоставимы (табл. 2). Необходимо отметить, что доли пациентов в возрасте старше 60 лет с наличием и отсутствием ИБС были также сопоставимы Анализ пульсовой волны показал, что ригидность артериальной стенки в группе больных ХОБЛ, прежде всего у пациентов с ИБС, была достоверно больше, чем у здоровых лиц (см. табл. 2). Причем эти изменения наиболее значимо касались такого показателя, как СРПВ — показателя, интегрирующего в себе геометрию и эластические свойства артерий. С увеличением жесткости артериальной стенки СРПВ возрастает. Нами установлено достоверное повышение СРПВ у пациентов с ХОБЛ и ИБС по сравнению как с лицами группы контроля, так и с пациентами без ИБС (p<0,01 и p<0,05 соответственно), что свидетельствует о повышении ригидности сосудов у больных ХОБЛ с ИБС. В норме СРПВ в аорте составляет 4—6 м/с, в менее эластичных артериях мышечного типа, в частности, лучевой — 8—12 м/с. Повышение СРПВ более 10 м/с отмечено нами лишь у 27,8% лиц контрольной группы, у 45,5% больных ХОБЛ без ИБС, у 69,1% пациентов с ХОБЛ и ИБС (p<0,05 при сравнении с группой контроля), у 68,4% больных ХОБЛ с перенесенным ИМ (p<0,05 при сравнении с группой контроля). Патологическое повышение СРПВ в аорте более 12 м/с не выявлено ни у одного здорового человека, в то же время оно отмечено у 20,8% пациентов с ХОБЛ без ИБС, у 41,4% больных ХОБЛ с ИБС (p<0,001 при сравнении с группой контроля), в том числе у 42,1% пациентов с перенесенным ИМ (p<0,001 при сравнении с группой контроля). Таким образом, патологическое повышение СРПВ выявлено нами у каждого пятого пациента без ИБС и практически у каждого второго больного с ИБС. Повышение СРПВ при ХОБЛ, в том числе при сочетании с ИБС, отмечали и другие авторы [14–18]. Необходимо отметить, что нами не выявлено взаимосвязи между СРПВ и возрастом пациентов.
ИА отражает сопротивление мелких артерий потоку крови: чем он больше, тем выше сопротивление артериол. Это имеет особое значение, так как самая ранняя фаза атеросклероза, дисфункция эндотелия, сопровождается повышением сосудистого сопротивления. Некоторые авторы связывают риск развития ССЗ с повышением именно ИА [19], однако до настоящего времени не сложилось единого мнения в отношении роли ИА в прогнозировании развития ССЗ. Считается, что ИА отражает информацию о функциональной активности сосудистого эндотелия.

При сравнении групп по показателям жесткости не выявлено повышения средних значений ИА как в аорте, так и на периферии, у больных ХОБЛ с ИБС или в ее отсутствие (см. табл. 2). Однако необходимо отметить тенденцию к повышению брахиального ИА у пациентов, перенесших ИМ, по сравнению с больными без ИБС. Повышение брахиального ИА более –10% выявлено у 41,6% больных ХОБЛ без ИБС, у 48,3% пациентов с ИБС, в том числе у 57,9% больных, перенесших ИМ, и лишь у 4 здоровых лиц. Увеличение брахиального ИА более 10% выявлено у 18,8% пациентов с ХОБЛ без ИБС, у 13,8% больных с ХОБЛ и ИБС (все пациенты были с перенесенным ИМ) и ни у одного в контрольной группе. В литературе имеются указания на повышение аортального ИА у больных ХОБЛ [20].
Для получения более полной информации об изменении периферических и центральных отделов сосудистого русла нами предложены дополнительные индексы. Вычисляли индекс соответствия ИА аортального ИА брахиальному по формуле: ИС ИА = (ИА брахиальный +100)/ИА аортальный. Разницу между ИА, определенным в аорте и в плечевой артерии (DИА), вычисляли по формуле: DИА=ИА аортальный — ИА брахиальный. Кроме того, вычисляли индекс соотношения СРПВ и брахиального ИА. Отмечены достоверные изменения индексов реактивности сосудов, свидетельствующие о более выраженном изменении периферических сосудов у больных ХОБЛ (см. табл. 2). При этом не выявлено значимых различий в изучаемых параметрах у пациентов с ИБС и в ее отсутствие.
В настоящее время известно, что САД на уровне плечевой артерии выше, чем в аорте, в то время как различия ДАД или среднего АД минимальны [13, 21]. Центральное АД отражает взаимодействие левого желудочка и сосудистого русла лучше, чем периферическое АД. Получены данные о тесной взаимосвязи между центральным АД и ССЗ и смертностью [13, 21]. Нами не отмечено значимых различий как периферического, так и центрального АД у больных ХОБЛ с ИБС и в ее отсутствие (см. табл. 2).
У молодых людей различия между центральным и периферическим САД могут достигать 20 мм рт.ст. и более.
У лиц старше 60 лет градиент жесткости между центральными и периферическими артериями уменьшается за счет снижения эластичности центральных артерий. По нашим данным, у здоровых людей различие между центральным и периферическим САД (DСАД) составляет 6,11 (9,88; –3,13) мм рт.ст., у пациентов с ХОБЛ без ИБС — 3,85 (–8,98; 0,49) мм рт.ст., с ИБС — 5,44 (–11,64; –0,71).
У 27,7% больных ХОБЛ без ИБС (p<0,05 при сравнении с контролем), 36,8% пациентов с перенесенным ИМ (p<0,05 при сравнении с контролем) и ни у одного лица в контрольной группе периферическое САД не превышало центральное АД (DСАД >0). Полученные данные свидетельствуют о диспропорции соотношений центрального и периферического АД, вплоть до полного нивелирования физиологических различий между ними (см. табл. 2).
В общей группе пациентов выявлены корреляции между ИА брахиальным и аортальным и длительностью курения (r=0,22; p<0,05 и r=0,22; p<0,05 соответственно), возрастом (r=0,19; p<0,05 и r=0,15; p<0,05 соответственно), индексом массы тела (r=–0,29; p<0,05 и r=–0,28; p<0,05 соответственно). Необходимо отметить, что данные взаимосвязи характерны, прежде всего, для больных без ИБС и не выявляются у пациентов с ИБС. У больных с ИБС выявлены взаимосвязи между ИА брахиальным, аортальным и длительностью одышки (r=–0,50; p<0,05 и r=–0,50; p<0,05 соответственно).
Таким образом, у больных ХОБЛ как с ИБС, так и в ее отсутствие, нами определены признаки повышения артериальной ригидности, снижение различий в уровнях центрального и периферического АД, что может играть определенную роль в развитии ССЗ у больных ХОБЛ.
Проведен анализ взаимосвязей между риском развития коронарных осложнений (индекс SCORE) и параметрами жесткости артериальной стенки: выявлены взаимосвязи между индексом SCORE и ИА брахиальным (r=0,39; p<0,05), аортальным ИА (r=0,38; p<0,05), СРПВ (r=0,30; p<0,05), SBPao (r=0,63; p<0,01), DИА (r=–0,39; p<0,05), индексом коронарной перфузии — SAI/DAI (r=0,22; p<0,05), DСАД (r=0,29; p<0,05), ИС САД (r=0,27; p<0,05).
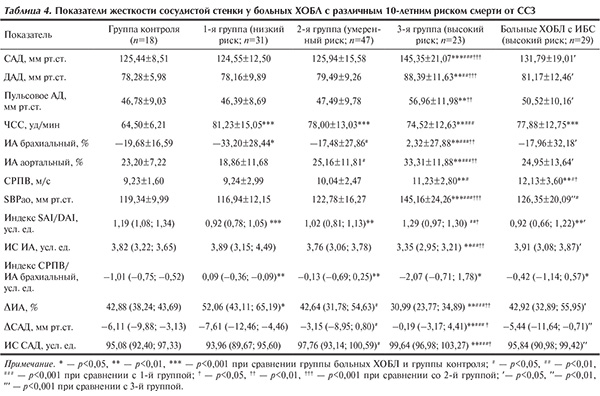
Мы разделили всех обследованных больных ХОБЛ без ИБС в зависимости от категории риска развития фатальных осложнений ССЗ в ближайшие 10 лет по шкале SCORE на 3 группы: 1-я группа — 1-я категория (высокий риск), 2-я группа — 2-я категория (умеренный риск) и 3-я группа — 3-я категория (низкий риск). Категории риска развития фатальных осложнений были предложены Европейскими рекомендациями по профилактике ССЗ [22]. Риск развития фатальных осложнений по шкале SCORE считается низким, если он <5%, высоким — при значении в диапазоне от 5 до 10%, и очень высоким, если превышает 10%. В 1-ю группу вошел 31 больной ХОБЛ, во 2-ю — 47 и в 3-ю группу — 23 пациента с ХОБЛ. Отдельную группу составили больные ХОБЛ с установленной ИБС — группа высокого риска (n=29) (табл. 3, 4). Согласно представленным в табл. 3 данным, пациенты были сопоставимы по таким параметрам, как индекс массы тела, тяжесть ХОБЛ, выраженность бронхообструкции, длительность одышки, длительность АГ, уровень холестерина. В то же время пациенты с низким риском фатальных осложнений были моложе остальных больных, имели несколько меньшую длительность и интенсивность курения. Эта группа пациентов была сопоставима с группой контроля по основным клиническим параметрам. Обследованные лица группы контроля имели преимущественно низкий риск фатальных осложнений, были сопоставимы по возрасту и основным антропометрическим данным с больными ХОБЛ 1-й группы.
Как следует из данных табл. 4, по мере нарастания категории риска отмечается повышение брахиального и аортального ИА, СРПВ, достигающих степени значимости у пациентов с высоким риском фатальных осложнений ССЗ. Повышение брахиального ИА более –10% выявлено у 19,4% больных ХОБЛ с низким риском фатальных осложнений, у 47% пациентов с умеренным риском и у 78,3% пациентов с высоким риском фатальных осложнений (p<0,001 при сравнении с показателями у больных 1-й группы). Увеличение брахиального ИА более 10% выявлено у 9,7% пациентов с низким риском, у 19,2% больных с умеренным риском фатальных осложнений и у 30,4% пациентов с высоким риском (p<0,05 при сравнении с показателями у больных 1-й группы). Необходимо отметить, что у пациентов с ХОБЛ и ИБС повышение брахиального ИА более –10% отмечалось в 1,6 раза реже, чем у больных с высоким риском без ИБС (48,3 и 78,3% соответственно). При этом повышение брахиального ИА более 10% в группе пациентов с ИБС отмечалось в 2,2 раза реже, чем у больных с высоким риском без ИБС (13,9 и 30,4% соответственно). Данные различия могут быть связаны с использованием в группе пациентов с ИБС (стенокардия и ИМ) вазоактивных препаратов, влияющих на функцию эндотелия, которую, в основном, и отражает ИА.
Обращает внимание прогрессирующее снижение индекса соответствия ИА у пациентов с низким, умеренным и высоким риском фатальных осложнений. При этом у пациентов с ИБС данный показатель не отличается от такового у пациентов с низким риском и достоверно превышает аналогичный параметр у больных с высоким риском без ИБС (p<0,05).
Повышение СРПВ более 10 м/с отмечено нами у 35,5% больных ХОБЛ с низким риском фатальных осложнений (p<0,05 при сравнении с группой контроля), у 44,7% пациентов с умеренным риском, у 60,9% больных с высоким риском фатальных осложнений и у 69% пациентов с ИБС. Патологическое увеличение СРПВ более 12 м/с не выявлено ни у одного здорового человека, в то же время отмечено у 12,9% пациентов 1-й группы, у 21,3% лиц 2-й группы, у 21,7% больных с высоким риском фатальных осложнений и у 41,4% пациентов с ХОБЛ и ИБС. Обращает внимание повышение средних значений и частоты выявления патологического уровня СРПВ у пациентов с ИБС по сравнению с больными без ИБС и высоким риском фатальных осложнений.
Необходимо отметить повышение индекса SAI/DAI у пациентов с высоким риском фатальных осложнений (p<0,01 при сравнении c больными 1-й группы и p<0,05 при сравнении с показателями 2-й группы), в то время как у пациентов с ИБС индекс коронарной перфузии достоверно ниже, чем у этой группы больных (p<0,05).
Отмечено снижение различий между центральным и периферическим САД по мере нарастания риска фатальных осложнений ССЗ (см. табл. 4), до практически полного нивелирования различий между ними у пациентов с высоким риском фатальных осложнений.
Таким образом, повышение СРПВ, ассоциированное с повышением ИА, свидетельствует о развитии нарушений свойств артериального русла у больных ХОБЛ с ИБС и в ее отсутствие, а также у пациентов с разной степенью 10-летнего риска смерти от ССЗ. Выявленные изменения можно рассматривать как системные проявления ХОБЛ, лежащие, возможно, в основе взаимоотношений ХОБЛ и ССЗ. Артериальная ригидность проявляется уже у пациентов среднего возраста с низким риском смерти от ССЗ и усугубляется по мере нарастания 10-летнего риска смерти. Обращает внимание нивелирование физиологических различий центрального и периферического САД, преимущественно у пациентов с высоким 10-летним риском смерти от ССЗ. При этом нарушения артериальной ригидности (прежде всего, ИА), различия в центральном и периферическом САД у пациентов с установленной ИБС выражены меньше, чем у больных без ИБС с высоким риском смерти от ССЗ. Данные различия могут быть связаны с использованием в группе пациентов с ИБС вазоактивных препаратов. Разработанные нами индексы могут быть использованы в клинической практике, так как позволяют дополнить информацию о нарушениях артериальной ригидности у пациентов с ХОБЛ.



