Последние клинические и эпидемиологические исследования показали, что у пациентов с хронической обструктивной болезнью легких (ХОБЛ) чаще, чем в остальной популяции, развиваются сердечно-сосудистые заболевания (ССЗ), которые почти в 30% случаев являются причиной летального исхода [1, 2].
В большинстве регионов в настоящее время создаются условия, при которых реализуется сразу несколько факторов риска, общих для бронхолегочной патологии и ССЗ — преобладание лиц старших возрастных групп, неблагоприятная экологическая обстановка, высокая распространенность курения [3, 4]. Результатом этого является увеличение числа пациентов с коморбидной патологией, в частности с сочетанием хронической обструктивной болезни легких (ХОБЛ) и ишемической болезнью сердца (ИБС).
Так, в исследованиях, проведенных в 2008—2012 гг. в Кузбассе, показано, что среди больных инфарктом миокарда с подъемом сегмента ST (ИМпST) распространенность ХОБЛ, только по данным медицинской документации пациентов, составила 12,3%, а при проведении спирометрического исследования у 20% пациентов впервые была диагностирована ХОБЛ. Пациенты с сочетанной патологией имели более длительный стационарный этап лечения инфаркта миокарда (ИМ), у них чаще регистрировалось осложненное течение, была выше летальность, а также менее благоприятный годовой прогноз, чем у больных ИМпST без сопутствующей ХОБЛ [5].
 В большом числе работ показано, что у больных ХОБЛ причиной атеросклеротических поражений и ассоциированных с ними заболеваний является системный воспалительный ответ [6—10]. В свою очередь усиление локального воспаления в бронхах, легочной паренхиме и сосудах приводит не только к прогрессированию ремоделирования бронхиального дерева и снижению функции легких, но и оказывает системное воздействие, способствуя развитию атеросклероза и кардиальной патологии. Так, в ряде исследований было показано, что снижение показателей функции внешнего дыхания находится в обратной зависимости от уровня маркеров воспаления [9, 10]. Другие исследователи придерживаются мнения, что у больных бронхолегочными заболеваниями атеросклеротическое поражение сосудов, особенно коронарных, встречается реже и выражено меньше, чем в общей популяции [11]. Следует признать, что распространенность атеросклероза у пациентов с сочетанием ХОБЛ и ИБС, а также взаимосвязь тяжести атеросклеротического поражения и функции легких в настоящее время изучена недостаточно.
В большом числе работ показано, что у больных ХОБЛ причиной атеросклеротических поражений и ассоциированных с ними заболеваний является системный воспалительный ответ [6—10]. В свою очередь усиление локального воспаления в бронхах, легочной паренхиме и сосудах приводит не только к прогрессированию ремоделирования бронхиального дерева и снижению функции легких, но и оказывает системное воздействие, способствуя развитию атеросклероза и кардиальной патологии. Так, в ряде исследований было показано, что снижение показателей функции внешнего дыхания находится в обратной зависимости от уровня маркеров воспаления [9, 10]. Другие исследователи придерживаются мнения, что у больных бронхолегочными заболеваниями атеросклеротическое поражение сосудов, особенно коронарных, встречается реже и выражено меньше, чем в общей популяции [11]. Следует признать, что распространенность атеросклероза у пациентов с сочетанием ХОБЛ и ИБС, а также взаимосвязь тяжести атеросклеротического поражения и функции легких в настоящее время изучена недостаточно.
Целью нашего исследования явилось изучение частоты выявления мультифокального атеросклероза, его связи с функцией легких и уровнем С-реактивного белка (СРБ) у пациентов с ИМпST и сопутствующей ХОБЛ легкой и средней степеней тяжести.
Материал и методы
Исследование выполнено на базе МБУЗ «Кемеровский кардиологический диспансер» и НИИ Комплексных проблем ССЗ СО РАМН. Протокол исследования одобрен локальным этическим комитетом. Обязательным условием включения пациента в исследование явилось подписанное им информированное согласие на участие в исследовании.
Критерий включения: наличие ИМпST и ХОБЛ легкой и средней степеней тяжести, подтвержденных результатами спирометрии с бронходилатационной пробой на 10—14-е сутки течения ИМ.
В исследование были включены 154 пациента с диагнозом ИМпST, госпитализированных в Кемеровский кардиологический диспансер за период 2010—2012 гг. Диагноз ИМ устанавливали в соответствии с рекомендациями ВНОК (версия 2007 г.). На 10—14-е сутки ИМ на основании результатов спирометрии с бронходилатационной пробой формировали изучаемые группы: 1-ю группу составили 58 (37,7%) пациентов с ИМпST и сопутствующей ХОБЛ легкой и средней степеней тяжести; 2-ю группу — 96 (62,3%) больных ИМпST без ХОБЛ.
Критерии исключения: возраст старше 75 лет, ХОБЛ III и IV степеней тяжести, клинически значимые нарушения ритма и проводимости, наличие клинически значимых сопутствующих заболеваний, способных изменять уровень биохимических маркеров, включая онкологическую и системную ревматическую патологию, неспособность выполнить протокол спирометрического исследования. В исследование также не включали пациентов с ИМ, который явился осложнением чрескожного коронарного вмешательства или коронарного шунтирования.
Больные 1-й и 2-й групп были сопоставимы по возрасту, половому составу, факту курения на момент обследования, характеристикам ИМ, систолической функции левого желудочка, а также классу острой сердечной недостатчности.
 Проведены стандартные исследования, включая сбор демографических, анамнестических, клинических данных, электрокардиографию. Функцию внешнего дыхания с бронходилатационным тестом оценивали у всех пациентов на 10—14-й сутки развития ИМпST по стандартному протоколу на аппарате Medgraphics ELIT DL. Результаты представлены в виде процентов от должных величин, рассчитанных по формулам Европейского сообщества угля и стали. Оценивали следующие показатели: FEV1 — объем форсированного выдоха за 1-ю секунду, FVC — форсированная жизненная емкость легких, отношение FEV1/FVC, %. Диагноз и степень тяжести ХОБЛ верифицировали в соответствии с критериями Глобальной стратегии диагностики, лечения и профилактики ХОБЛ [12]: постбронходилатационный показатель FEV1/FVC<0,70 у пациентов с одышкой, хроническим кашлем или выделением мокроты и/или с воздействием характерных для этой болезни факторов риска в анамнезе. Степень тяжести ХОБЛ определяли на основании постбронходилатационного значения FEV1, оцененного в процентах от должных величин: легкая степень (GOLD 1) — FEV1≥80%, средней тяжести (GOLD 2) — 50% ≤FEV1<80%, тяжелая (GOLD 3) — 30%≤FEV1 <50% от должного, крайне тяжелая (GOLD 4) — FEV1<30% от должного.
Проведены стандартные исследования, включая сбор демографических, анамнестических, клинических данных, электрокардиографию. Функцию внешнего дыхания с бронходилатационным тестом оценивали у всех пациентов на 10—14-й сутки развития ИМпST по стандартному протоколу на аппарате Medgraphics ELIT DL. Результаты представлены в виде процентов от должных величин, рассчитанных по формулам Европейского сообщества угля и стали. Оценивали следующие показатели: FEV1 — объем форсированного выдоха за 1-ю секунду, FVC — форсированная жизненная емкость легких, отношение FEV1/FVC, %. Диагноз и степень тяжести ХОБЛ верифицировали в соответствии с критериями Глобальной стратегии диагностики, лечения и профилактики ХОБЛ [12]: постбронходилатационный показатель FEV1/FVC<0,70 у пациентов с одышкой, хроническим кашлем или выделением мокроты и/или с воздействием характерных для этой болезни факторов риска в анамнезе. Степень тяжести ХОБЛ определяли на основании постбронходилатационного значения FEV1, оцененного в процентах от должных величин: легкая степень (GOLD 1) — FEV1≥80%, средней тяжести (GOLD 2) — 50% ≤FEV1<80%, тяжелая (GOLD 3) — 30%≤FEV1 <50% от должного, крайне тяжелая (GOLD 4) — FEV1<30% от должного.
Цветовое дуплексное сканирование брахиоцефальных артерий (БЦА) и артерий нижних конечностей (АНК) выполняли на ультразвуковом диагностическом комплексе ALOKA α-10 (Япония). Основным ультразвуковым признаком, свидетельствующим об атеросклеротическом поражении некоронарных магистральных артерий, считали толщину интимы—медии (ТИМ) более 1,0 мм [13].
Коронарография (АГ) проведена у всех пациентов в 1-е сутки поступления в стационар, по результатам которой чрескожное коронарное вмешательство (ЧКВ) выполнено в 1-й группе у 54 (93,1%) пациентов, во 2-й — у 90 (93,7%; р=0,87). Поражение коронарного русла более 50% в 1-й группе имелось у всех 58 пациентов, а во 2-й группе — у 96,9% (р=0,17).
Уровень высокочувствительного СРБ определяли твердофазным методом иммуноферментного анализа на 10—14-е сутки ИМ.
Статистическую обработку данных проводили с использованием программы Statistica 6.0. Для проверки характера распределения количественных показателей использовали критерий Шапиро—Уилка. Так как распределение исследуемых количественных признаков отличалось
от нормального, результаты представлены в виде медианы и межквартильного размаха — Ме [Q1; Q3]). Для сравнения количественных признаков между двумя независимыми группами применяли непараметрический U-критерий Манна—Уитни. Для сравнения соотношения частот признаков в независимых группах использовали χ2-критерий Пирсона с поправкой Йетса. Оценку связи признаков проводили с использованием коэффициента ранговой корреляции Спирмена. Различия считали статистически значимыми при р<0,05.
Результаты
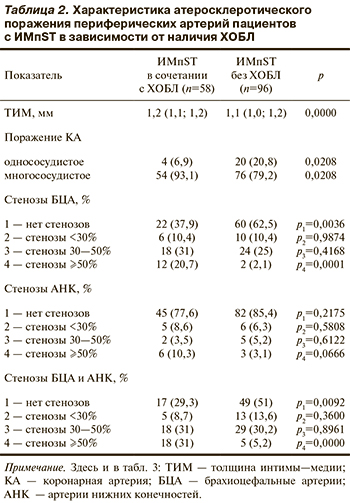
По результатам КГ у всех пациентов выявлено поражение коронарных артерий (КА). Поражение одной КА чаще выявлялось в группе пациентов с ИМпST без ХОБЛ, а поражение 2 КА и более преобладало в группе пациентов с ИМпST и сопутствующей ХОБЛ (табл. 2)
Соответственно, в 1-й группе пациентов было установлено большее число стентов: в группе с сопутствующей ХОБЛ 2 стента и более установлено в 57,4% случаев, в группе без ХОБЛ — только в 18,9% (р=0,0000). Кроме того, в 1-й группе чаще выявлялось поражение ствола левой КА — у 11 (19%) пациентов и 4 (4,2%) – во 2-й группе (р=0,0026).
 При исследовании периферических артерий увеличение ТИМ у пациентов 1-й группы выявлено в 96,5% случаев, во 2-й группе — в 84,4% (р=0,0194). Увеличение ТИМ регистрировалось у пациентов 1-й группы (см. табл. 2).
При исследовании периферических артерий увеличение ТИМ у пациентов 1-й группы выявлено в 96,5% случаев, во 2-й группе — в 84,4% (р=0,0194). Увеличение ТИМ регистрировалось у пациентов 1-й группы (см. табл. 2).
Результаты исследования БЦА выявили следующие различия между группами: в группе больных ИМпST без ХОБЛ отсутствие стенотических изменений сосудов регистрировалось статистически значимо чаще — у 62,5% пациентов против 37,9% (р=0,0036). Стенозы БЦА более 50% чаще выявлялись у пациентов с сопутствующей ХОБЛ — у 20,7 и 2,1% (р=0,0001).
Ультразвуковое исследование артерий нижних конечностей не выявило различий по частоте стенозов между изучаемыми группами. Однако в 1-й группе несколько чаще регистрировались стенозы АНК более 50% — у 10,3 и 3,1% пациентов соответственно (р=0,066; см. табл. 2).
Анализ состояния двух периферических артериальных бассейнов — каротидного и АНК — показал распространенность стенозов более 50% среди больных ИМпST с сопутствующей ХОБЛ — 31 и 5,2% у пациентов 2-й группы (р=0,0000). Число пациентов без стенотических поражений периферических артерий преобладало во 2-й группе — 51 и 29,3% (р=0,009).
Поражение только коронарного бассейна чаще регистрировалось у пациентов с ИМпST без сопутствующей ХОБЛ — у 22 (22,9%) и 4 (6,9%), (р=0,011). Частота поражения двух сосудистых бассейнов (коронарного и каротидного/АНК) не различалась между группами (р=0,51). Поражение трех сосудистых бассейнов (коронарного, каротидного и АНК) статистически значимо чаще выявлялось у пациентов с сопутствующей ХОБЛ — у 9 (15,5%) против 4 (4,2%; р=0,015). Поражение двух сосудистых бассейнов (коронарного и каротидного/АНК)со стенозами периферического русла более 50% статистически значимо чаще выявлялось в 1-й группе — в 18 (31%) случаях против 5 (5,2%; р=0,0000).
Средние уровни СРБ были выше в группе пациентов с ИМпST и сопутствующей ХОБЛ — 4,77 (3,53—12,80) мг/л против 3,60 (2,33—4,72) мг/л в группе без ХОБЛ (р=0,001).
При проведении корреляционного анализа обнаружены отрицательные связи между экспираторными показателями легочной функции, распространенностью атеросклероза и степенью атеросклеротического изменения артерий. Аналогичные взаимосвязи выявлены между значениями FEV1, FVC, FEV1/FVС и уровнем СРБ (табл. 3).
Таким образом, у больных ИМпST и сопутствующей ХОБЛ чаще выявлялись многососудистое поражение КА, а также стеноз ствола левой КА. В этой же группе статистически значимо преобладали стенозы периферического русла с поражением более 50% и чаще регистрировалось поражение трех сосудистых бассейнов. У пациентов с ИМпST и сопутствующей ХОБЛ выявлены более высокие уровни CРБ, отражающие активность воспаления — одного из механизмов развития атеросклероза.
Обсуждение
Высокая распространенность сочетания хронических заболеваний органов дыхания и сердечно-сосудистой системы, включая различные проявления атеросклероза, показана в ранее проведенных исследованиях [1, 4, 14]. Чаще других с ХОБЛ ассоциируются метаболический синдром и ИБС — у 61 и 24% больных соответственно. Такое сочетание обусловлено наличием общих факторов риска и звеньев патогенеза этих заболеваний [3, 6].
Известно, что атмосферное загрязнение воздуха ухудшает легочную функцию, способствует развитию ХОБЛ, а степень воздействия этого фактора на патогенез заболевания зависит от географического положения места проживания [4]. Регион Западной Сибири является одним из самых неблагоприятных по распространенности ХОБЛ, а Кузбасс, с учетом развитой угледобывающей промышленности — особенно [15]. В Кемеровской области число лиц, страдающих ХОБЛ, за последние 10 лет увеличилось в 1,8 раза, а болезни органов кровообращения остаются ведущей причиной смертности населения и составляют 46,1% [16]. В связи с этим распространенность сочетанной патологии — ИБС и ХОБЛ среди жителей Кузбасса приобретает особую медико-социальную значимость.
До настоящего времени вопрос о частоте развития и особенностях атеросклероза у больных бронхолегочными заболеваниями окончательно не решен. Как показывают патологоанатомические исследования, в одних случаях не выявляются признаки атеросклероза при патологии органов дыхания, в других обнаруживаются проявления распространенного атеросклеротического поражения артерий различных бассейнов. Это заставляет внимательно рассмотреть все факторы, как способствующие атерогенезу, так и оказывающие вазопротективное действие у больных хроническими заболеваниями аппарата дыхания.
Полученные нами данные свидетельствуют о более высокой распространенности мультифокального атеросклероза и большей распространенности гемодинамически значимых стенозов у пациентов с сочетанной патологией — ИБС и ХОБЛ. В этой же группе преобладает многососудистое поражение КА. Это согласуется с данными J. Enriquez и соавт., которые выявили особенности коронарного атеросклероза у больных ХОБЛ в виде многососудистого поражения, имеющего большую распространенность, чем у больных без ХОБЛ [17]. В последние годы появляется все больше доказательств того, что общим механизмом, лежащим в основе развития нескольких хронических заболеваний у одного пациента, является системный воспалительный ответ [6—10]. Характерным лабораторным признаком воспаления является увеличение синтеза белков острой фазы, к наиболее значимым представителям которых относится СРБ. Установлено, что даже небольшое увеличение уровня СРБ ассоциируется с субклиническим воспалением сосудистой стенки, повышает риск развития атеротромбоза и служит прогностическим фактором летальных исходов, связанных с развитием коронарных осложнений [18, 19]. Кроме того, выявлена прямая связь между уровнем СРБ и прогрессированием каротидного атеросклероза [20]. Однако до настоящего времени окончательно не решен вопрос о том, является ли повышение уровня СРБ просто маркером атеросклероза или прямым участником его развития.
Полученные нами данные свидетельствуют о более высоких уровнях СРБ у больных ИМпST в сочетании с ХОБЛ, что согласуется с данными ряда других исследователей [21, 22].
Важно отметить и то, что ХОБЛ в нашем исследовании была представлена I (17,2%) и II (82,8%) стадиями. Тем не менее уровень СРБ в этой группе был статистически значимо выше, чем у пациентов с ИМ без сопутствующей патологии органов дыхания.
Об этом же свидетельствуют данные W. Zeng-li и соавт., которые показали, что больные ХОБЛ имеют повышенный системный воспалительный ответ независимо от стадии заболевания, что в свою очередь существенно увеличивает риск развития ССЗ и смертность от них [9].
Факты, указывающие на то, что системная воспалительная реакция влияет на развитие атеросклероза и ассоциированных с ним заболеваний, могут объяснять высокую частоту развития атеросклеротических поражений у больных ХОБЛ.
Среди факторов, способствующих развитию острых сердечно-сосудистых осложнений (ССО) у больных ХОБЛ, важное место занимает снижение легочной функции. Ранее проведенные исследования показали, что снижение показателей FVC и FEV1 ассоциируется с повышенной распространенностью ССЗ и числом летальных исходов [24]. Кроме того, снижение FVC было утверждено во Фрамингемском исследовании в качестве независимого предиктора развития ССО и смерти, а также в качестве клинически значимого маркера развития хронической сердечной недостаточности у пациентов с ИБС [23].
G. Engström и соавт. также показали наличие сильной обратной связи между значением FVC, уровнем СРБ и фибриногена, которая, по мнению исследователей, повышает риск развития ССО у лиц со сниженной функцией легких [10].
R. Hancox и соавт., исследуя 1000 некурящих новозеландцев в возрасте 26—32 лет, выявили, что повышение уровня СРБ ассоциировалось с более низкими показателями функции легких [24].
G. Donaldson и соавт. представили данные о том, что пациенты с низким FEV1 имеют высокий уровень маркеров воспаления, таких как СРБ и фибриноген, которые в свою очередь могут являться ключевыми маркерами развития атеросклероза и ССО [25].
Наши данные показали, что у больных ИМпST и сопутствующей ХОБЛ чаще выявляется многососудистое поражение коронарного русла, а также отмечается более высокая распространенность мультифокального атеросклероза с гемодинамически значимыми поражениями артерий, что ассоциируется со снижением экспираторной функции легких и повышенным уровнем СРБ. Таким образом, можно предполагать, что существует связь между показателями легочной функции, распространенностью периферического атеросклероза и степенью атеросклеротического поражения артерий.
Данный факт диктует необходимость включения в диагностические алгоритмы исследования основных сосудистых бассейнов пациентов с сочетанной сердечно-легочной патологией.



