Терапия сердечной недостаточности остается одной из наиболее сложных проблем кардиологии. В последние годы укрепляется тенденция использования в качестве терапевтических средств естественных молекул — регуляторов и модуляторов функции. Одним из наиболее мощных естественных регуляторов сократимости миокарда является апелин [1—3]. Естественный апелин состоит из 77 аминокислотных остатков, но в организме он подвергается дальнейшему протеолизу до более коротких фрагментов, сохраняющих его биологическую активность, — апелин-36, 19, 17, 13 и 12. Фрагмент молекулы апелин-12 (H-Arg-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Met-Pro-Phe-OH), отличающийся от апелина-13 отсутствием глутамина в N-конце, наименее изучен. На изолированных кардиомиоцитах данный пептид увеличивал силу сокращений и уровень Са2+ в систоле [2], а также улучшал восстановление функции миокарда после ишемии и реперфузии, сопровождавшейся активацией NO-синтазы и антиоксидантных ферментов [4, 5]. Однако высокая активность пептидаз в крови снижает эффективность использования этого пептида в эксперименте и клинике [6]. Кроме того, в состав апелина-12 входит метионин, который чрезвычайно легко окисляется кислородом воздуха до соответствующего сульфоксида, что ухудшает стабильность вещества при хранении [7].
В лаборатории синтеза пептидов РКНПК был синтезирован ряд аналогов апелина-12. Предварительные испытания [8], проведенные на изолированных кардиомиоцитах, показали, что наиболее эффективным по воздействию на внутриклеточный транспорт Са2+ является аналог II, в котором метионин, легко окисляемый кислородом, был заменен норлейцином — аминокислотой небелкового происхождения, устойчивой к окислению, а остаток аргинина в положении 1 заменен остатком Nα-метиларгинина (H-(Nα-Me)Arg-Pro-Arg-Leu-Ser-His-Lys-Gly-Pro-Nle-Pro-Phe-OH). Этот аналог также отличался от других меньшим влиянием на артериальное давление [8]. В данной работе было изучено действие этого аналога, а также апелина-12 на сократительную функцию миокарда крыс с хроническим ишемическим поражением, вызванным синтетическим катехоламином, — изопротеренолом. Предварительные результаты работы представлены ранее [9].
Материал и методы
Опыты выполняли на наркотизированных кетамином (100 мг/кг) самцах крыс Вистар массой 400—450 г. Одна группа крыс получала изопротеренол в дозировках 150—180 мг/кг дважды с суточным интервалом, смертность в этих сериях колебалась от 32 до 40%. Контрольная группа получала изотонический раствор натрия хлорида. Выжившие животные и контрольные были исследованы с применением различных неинвазивных и инвазивных методов.
Эхокардиография. Исследование функции сердца наркотизированных крыс выполняли на аппарате iE33 («Philips Ultrasound», «Bothell WA», США) с использованием датчика S12-4 (12—4 MГц). Конечный диастолический и конечный систолический размеры левого желудочка (ЛЖ), а также толщину задней стенки ЛЖ измеряли в М-режиме из пара-стернального доступа в проекции длинной оси сердца; площадь поперечного сечения ЛЖ в конце диастолы (Sd, см2) и в конце систолы (Ss, см2) определяли из парастернального доступа в проекции по короткой оси сердца на уровне папиллярных мышц, рассчитывая процент изменения площади поперечного сечения ЛЖ в систолу по следующей формуле: ΔS%= (Sd – Ss)/Sd · 100. Объемы ЛЖ (конечный диастолический объем — КДО, конечный систолический объем — КСО) и фракцию выброса (ФВ) определяли с использованием модифицированного алгоритма Симпсона из апикального доступа в 3 проекциях (4- и 2-камерных и по длинной оси ЛЖ). Интеграл линейной скорости кровотока (VTI, см) — эквивалент ударного объема, а также ударный объем ЛЖ (УО, мл) и минутный объем (МО, мл/мин) определяли с помощью допплеровского исследования в импульсном режиме на уровне выходного тракта ЛЖ.
Инвазивное исследование. У животных непрерывно регистрировали электрокардиограмму (ЭКГ) во II стандартном отведении, среднее артериальное давление (АД), давление в ЛЖ и тетраполярную импедансную кардиограмму (ТИКГ). В яремную вену вставляли катетер для введения веществ. Действие исходного пептида, а также его аналога изучали при последовательной инфузии с нарастающей скоростью от 0,5 до 50 мкг/мин/кг, каждую дозу вводили в течение 8 мин.
Для регистрации давления в ЛЖ и аорте использовали милларовский прецизионный микроманометр на конце тонкого (диаметр 0,53 мм) катетера («SciSense Instruments», Канада), введенный через сонную артерию, и тензометрический усилитель Hugo Sachs Elektronik (США). АД через катетер в бедренной артерии измеряли с помощью электроманометра Gould Statham P23 Db (CША). Для регистрации ТИКГ вводили подкожно электроды-иглы в области нижней челюсти и одной из нижних конечностей, а сигнальные — по верхней и нижней границе грудины. Сигнал ТИКГ (ΔZ) регистрировали с помощью модифицированного для работы с мелкими лабораторными животными реоплетизмографа РПКА-2-01 («Медасс», Россия) с расширенной полосой пропускания (от 0,1 до 150 Гц при несущей частоте 40 кГц и амплитуде импульсов тока 3,5 мА).
Сигналы ЭКГ и АД подавали на Biograph-4 (Cанкт-Петербургский государственный университет аэрокосмического приборостроения). Все сигналы оцифровывали с частотой 1 кГц с помощью аналого-цифрового преобразователя NI-USB-6210 («National Instruments», США) и записывали на жесткий диск компьютера. Для записи и обработки физиологических сигналов были разработаны собственные программы. Расчет параметров выполняли на основе анализа записей первичных сигналов с предварительным их пульс-синхронным усреднением по 40 кардиоциклам каждые 5 с. Для этого сначала производили интерполяцию и переоцифровку сегментов сигнала ЭКГ, содержащих QRS-комплекс, с шагом 0,2 мс, что необходимо для точного определения положения вершины R зубца в каждом кардиоцикле. Затем все фрагменты пульсовых волн исследуемых сигналов синхронизовали по вершине зубцов R и подвергали медианной фильтрации для удаления помех и сильно отличающихся по форме или амплитуде волн. Вычисляли традиционные показатели сократимости ЛЖ — максимальную скорость развития давления (dP/dtmax) и индекс сократимости (dP/dtmax/P), нормированный на давление в момент достижения максимума dP/dt и экспоненциальную константу расслабления [10]. По сигналу импедансной кардиограммы рассчитывали длительность периода предызгнания (ДПП, в мс) по методу В.М. Хаютина [11] — от вершины зубца R до максимума второй производной импедансного сигнала (d2Z/dt2)max.

Изолированные кардиомиоциты. Свежевыделенные кардио-миоциты, нагруженные Са2+ индикатором Fluo-4, помещали в проточную камеру с прозрачным дном из покровного стекла. Камеру устанавливали на столике инвертированного флуоресцентного микроскопа. Интенсивность флуоресценции Fluo-4 регистрировали в базальных условиях, а также при стимуляции клеток электрическими импульсами с частотой 1 Гц в течение 10 с. Пептиды добавляли в камеру за 30 мин до измерения флуоресценции. Детальное изложение методики дано ранее [12].
Результаты
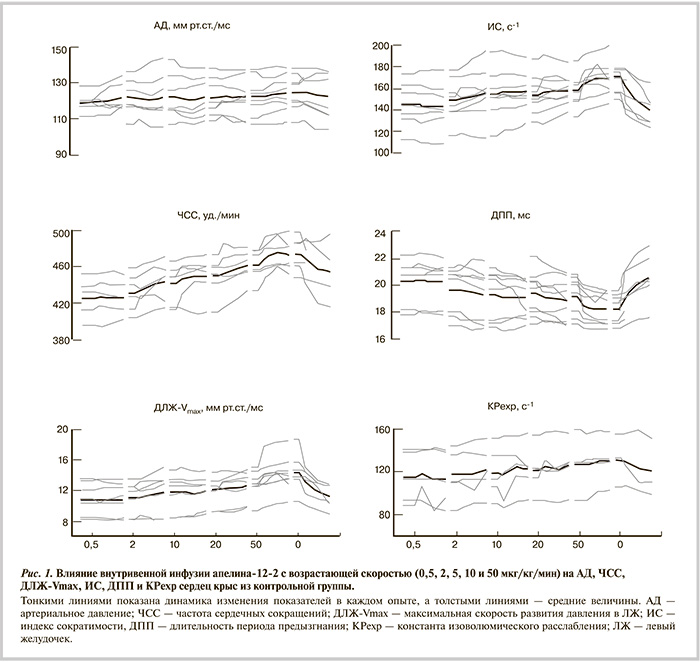
Катетеризация ЛЖ. Инфузию апелина-12 и апелина-12-2 выполняли в разных сериях опытов, в которых функциональные параметры практически не отличались, за исключением систолического давления в ЛЖ (табл. 1). Инфузия апелинов в возрастающих дозах сопровождалась неуклонным, хотя и небольшим, повышением частоты сердечных сокращений (ЧСС) и систолического давления в ЛЖ, а также показателей сократимости и расслабимости (рис. 1). Средние величины по группам приведены на рис. 2. Видно, что эффект обоих апелинов нарастал с увеличением дозировки, при этом эффект апелина-12-2 был более отчетливым. В связи с наличием кумулятивного эффекта точно определить дозозависимость не удалось, поэтому сравнительный эффект апелина-12 и его аналога оценивали в диапазоне малых и высоких доз. Преимущество апелина-12-2 перед нативным пептидом проявилось уже при сравнении эффекта малых доз 0,5—2 мкг/кг/мин — он достоверно повышал индекс сократимости и укорачивал длительность изгнания (рис. 3, а).
Более отчетливо это преимущество апелина-12-2 проявлялось при повышенной скорости введения — 10—50 мкг/кг/мин. Результаты такого сопоставления, представленные на рис. 3, б, показывают, что нативный апелин-12 незначительно улучшал функциональные показатели сердца — все изменения не превышали 6%. Аналогичные изменения были характерны и для действия апелина-12-2, но степень их изменения была гораздо выше, они достоверно повышались на 7—14%. Таким образом, у контрольных крыс апелин-12-2 более эффективен по сравнению с апелином-12.
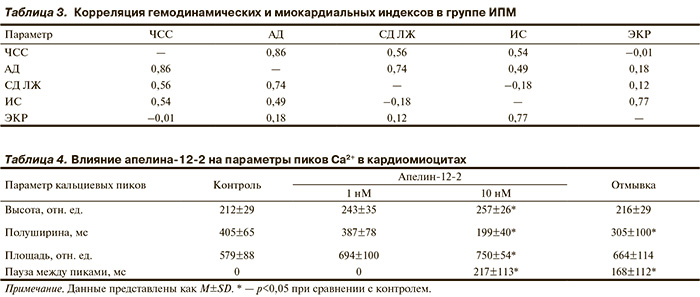
Аналогичный протокол опыта был применен у крыс с изопротереноловым поражением миокарда (ИПМ). У этих животных исходные данные в группах не различались между собой (табл. 2), но по сравнению с исходным состоянием в контрольной группе (см. табл. 1) отмечено значительное повышение диастолического давления в ЛЖ, а также снижение индекса сократимости и особенно константы расслабления. При объединении этих групп стало возможным определить степень корреляции между гемодинамическими и миокардиальными показателями (табл. 3). Из материалов таблицы видно, что в этих группах тесно коррелируют между собой гемодинамические показатели — АД, систолическое давление в ЛЖ и ЧСС. Кроме того, тесно коррелируют между собой миокардиальные показатели — индекс сократимости и константа расслабления. Но связь между миокардиальными и гемодинамическими показателями выражена слабее.
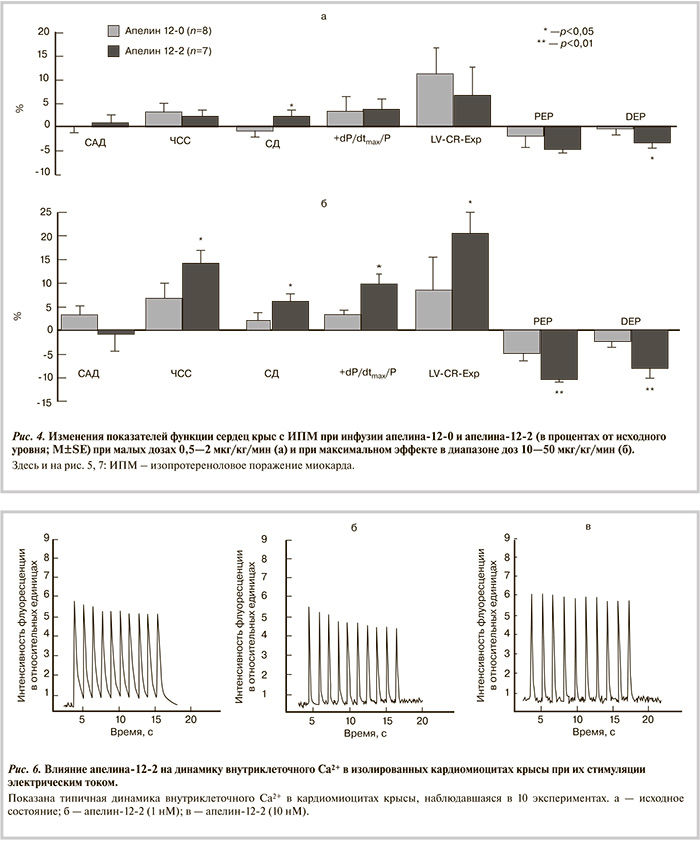
Введение апелина-12 в разных дозировках не повлияло на гемодинамические или показатели крыс с ИПМ. Миокардиальные показатели изменялись более заметно, но изменения индексов в ходе опыта были статистически недостоверны. В отличие от этого, введение апелина-12-2 отчетливо повлияло на функцию миокарда. Уже при минимальных дозировках отмечено повышение систолического давления в ЛЖ и укорочение длительности периода изгнания, а при высоких дозировках к этим изменениям присоединились ЧСС, систолическое давление в ЛЖ, индекс сократимости, константа расслабления и длительность периода предызгнания (рис. 4). Эти изменения были достоверны по парному критерию Стьюдента. Отмечено снижение диастолического давления в ЛЖ с 10,3 до 8,5 мм рт.ст. После прекращения введения апелина-12-2 повышенный уровень сократимости и расслабимости миокарда сохранялся еще 10—15 мин.
Полученные результаты свидетельствуют, что апелин-12-2 оказывает более выраженное положительное действие на показатели функции миокарда как у животных с ИПМ, так и в контрольной группе. При этом у животных с ИПМ улучшались и гемодинамические показатели. Положительный эффект пептида сохранялся некоторое время и после прекращения его введения.
Эхокардиография. Часть крыс с ИПМ (n=5) и 15 контрольных к ним были исследованы методом эхокардио-графии. В контрольной группе КДО был равен в среднем 0,85±0,06 мл, а ФВ 0,82±0,02%. У крыс с ИПМ до введения апелина КДО был равен 1,39±0,28 мл, а ФВ — 56±5%. Последовательное введение возрастающих доз апелина-12-2 (2, 10 и 50 мкг/кг/мин) увеличивало ФВ и диастолический объем. Частично эти положительные изменения сохранялись и через 10 мин после удаления пептида из раствора. Наиболее эффективной была дозировка 10 мкг/кг/мин (рис. 5, см. цв.вклейку), под влиянием которой во всех опытах возрастали и КДО, и ударный объем. В среднем КДО увеличился на 17%, а ударный объем — на 38%. Одновременно возросла и фракция выброса с 56±5 до 65±6% (p<0,05), приближаясь к уровню в контрольной группе. Таким образом, наблюдалось полное соответствие с результатами опытов с катетеризацией ЛЖ.
Изолированные кардиомиоциты. В контроле каждому электрическому стимулу соответствовал один пик подъема концентрации свободного Са2+ в саркоплазме и последующего ее снижения. Запись типичного опыта представлена на рис. 6. Видно, что при выбранных условиях стимуляции в контроле не происходит полного снижения свободного Са2+ в саркоплазме до базального уровня, который восстанавливается в клетках лишь по окончании пакета импульсов. В присутствии апелина-12-2 в концентрации 1 нМ и 10 нМ форма Са2+ пиков изменяется. Они становятся более узкими, послепиковая концентрация Са2+ снижается до базального уровня, и между пиками возникают паузы. В случае 10 нМ апелина-12-2 амплитуда Са2+ пика, его полуширина и площадь, а также величина межпиковых пауз достоверно отличаются от соответствующих значений в контроле (табл. 4). Частично эти изменения сохранялись и через 10 мин после удаления пептида из раствора.
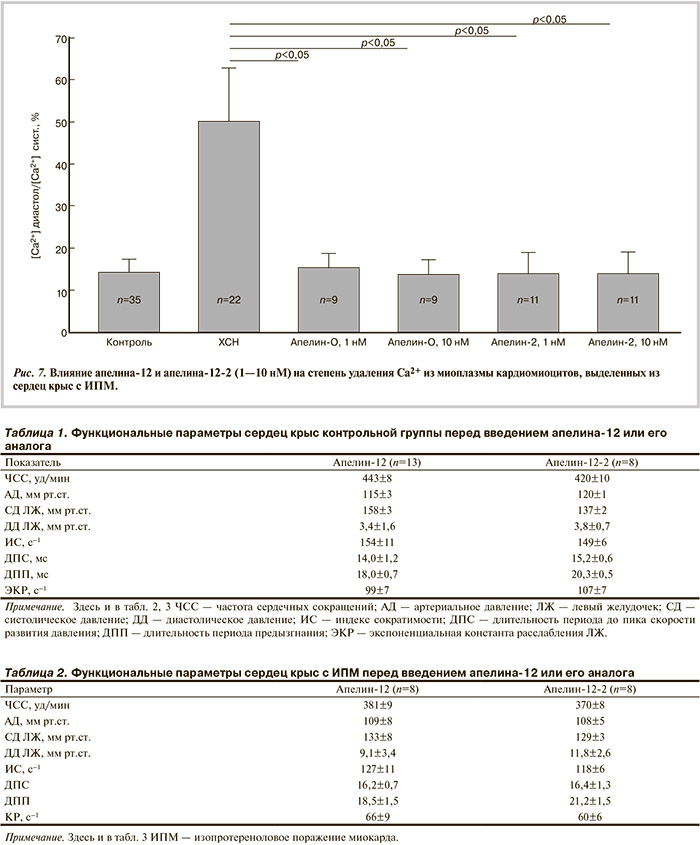
На рис. 7 представлены результаты опытов, в которых измеряли действие пептидов на способность убирать Са2+ из саркоплазмы кардиомиоцитов из группы ИПМ. Степень удаления Са2+ высчитывали посредством отношения уровня Са2+ в диастоле к его систолическому уровню. Видно, что этот показатель в кардиомиоцитах из группы ИПМ был примерно в 3 раза выше, чем в контрольных нормальных кардиомиоцитах, т.е. удаление Са2+ из саркоплазмы было нарушено. Оба пептида в концентрациях 1—10 нМ успешно устраняли этот дефект. Таким образом, апелин-12-2 в наномолярных концентрациях улучшал удаление Са2+ из саркоплазмы кардиомиоцитов из группы ИПМ, приводя его диастолический уровень к контрольным значениям.
Морфологическое исследование. Проведенное светооптическое исследование показало очаговый характер поражения миокарда — погибшие кардиомиоциты соседствовали с нормальными (рис. 8, а, см. цветную вклейку). Отмечены участки заместительного склероза (рис. 8, б, см. цветную вклейку), значительная активизация соединительнотканных элементов, очаги новообразования капилляров в рубцовых зонах. Практически у всех изученных животных эндокард был утолщен, склерозирован, в подлежащем миокарде отмечался склероз интерстициальной ткани.
Обсуждение
Использованный в работе апелин-12 является фрагментом нативного апелина и, как и апелин-13, обладает повышенной функциональной активностью по сравнению с фрагментом апелина-36 и самим апелином [13]. При этом апелин-12 в дозе 10 нМ/кг снижал АД на 26%, в то время как апелин-13 и апелин-36 в той же дозе снижали АД на 11 и 5% соответственно [14]. Болюсное введение апелина бодрствующим овцам вызывало двухфазную гемодинамическую реакцию, в первой фазе которой быстрое снижение АД сопровождалось компенсаторным повышением ЧСС, а во второй фазе повышение АД сочеталось со снижением МО [15]. При этом в плазме отмечали повышение уровня вазопрессина, адренокортикотропина, альдостерона, кортизола и натрийуретического пептида. В наших опытах болюсное введение апелина-12 в дозах 0,05—0,3 мг/кг также оказывало гипотензивное действие [16]. Однако при инфузионном способе введения, примененном в настоящей работе, АД изменялось незначительно из-за уменьшения действующей концентрации пептида по сравнению с болюсным введением. Это позволило более отчетливо наблюдать за инотропным действием апелина-12 на сердце.
Впервые положительное инотропное действие апелина-16 на изолированное сердце наблюдали I. Szokodi и соавт. в 2001 г. [1]. В концентрациях 0,01—10 нМ он оказывал дозозависимое положительное инотропное действие. Позднее было установлено [2], что примерно в тех же концентрациях (10—70 нМ) апелин-12 повышал сократимость изолированных кардиомиоцитов, причем клетки, выделенные из сердец крыс с ИПМ, реагировали сильнее, чем клетки из контрольных сердец. Авторы установили, что основной причиной увеличения сократимости является повышение уровня свободного Са2+. Степень увеличения обоих параметров была сопоставима (+57 и 43% соответственно). Недавно было установлено, что в реализации инотропного эффекта принимает участие протеинкиназа С [17, 18]. В наших опытах аналогичный эффект апелина-12-2 проявлялся в концентрациях, меньших в 7—10 раз, при этом впервые было установлено отчетливое действие пептида на диастолический уровень Са2+.
В опытах in vivo инфузия апелина увеличивала скорость развития и снижения давления в ЛЖ как в норме, так и при сердечной недостаточности [19, 20]. В нашей работе инфузия апелина-12 слабо влияла на гемодинамические показатели сердца контрольных животных, но отчетливо увеличивала индекс сократимости у животных, получавших изопротеренол, причем этот эффект нарастал по мере увеличения дозы. Положительное действие апелина-12-2 было более выраженным по сравнению с исходным апелином-12, особенно у животных с ИПМ. Так, в контрольной группе апелин-12 слабо влиял на функциональные параметры, в то время как апелин-12-2 повышал показатели сократимости и расслабимости. Еще более заметной стала разница в группе ИПМ, в которой апелин-12-2 не только значительно улучшал показатели сократимости и расслабимости, но и отчетливо повышал и ЧСС, и АД (см. рис. 3). Эхокардиография показала, что повышение сократимости сопровождалось увеличением степени сокращения задней стенки ЛЖ и ФВ. Преимущество аналога перед апелином-12 обусловлено, по-видимому, не только заменой метионина на норлейцин, что повышает устойчивость пептида к действию пептидаз, но и метилированием аргинина в N-конце. Ранее было показано, что синтезированный непептидный агонист апелина отличается полиметилированием молекулы [21].
Новым для изучения действия апелина фактом оказалось увеличение константы расслабления. Ранее было показано, что апелин не влияет на диастолические свойства сердца [19, 22], в частности, на константу расслабления. В наших опытах эффект апелина-12 на константу расслабления в контрольных опытах действительно был невелик, а при ИПМ ее увеличение под влиянием апелина-12 наблюдали только при дозировке 2 мкг/мин/кг. Но апелин-12-2 устойчиво повышал константу расслабления как в контроле, так и при ИПМ, причем максимальный эффект достигался также при 2—10 мкг/мин/кг, т.е. при меньших дозировках, чем влияние на показатели сократимости.
Способность апелина-12-2 ускорять расслабление, вероятно, обусловлена более быстрым и более полным удалением Са2+ из саркоплазмы. Даже на миоцитах из контрольных сердец апелин-12-2 в 2 раза сокращал время полувыведения Са2+ из саркоплазмы, а на кардиомиоцитах из группы ИПМ он приблизительно втрое снижал диастолический уровень Са2+. Эти данные хорошо согласуются со снижением диастолического давления в ЛЖ, а также с увеличением наполнения ЛЖ. Они позволяют предполагать, что причиной повышенного диастолического давления наряду с наличием склерозированных участков миокарда могут быть как замедленное расслабление, так и ухудшение растяжимости ЛЖ. Способность апелина-12-2 улучшать извлечение Са2+ из саркоплазмы кардиомиоцитов и, таким образом, ускорять их расслабление, возможно, и представляет собой тот первичный молекулярный механизм, который лежит в основе апелин-зависимого повышения сократимости миокарда.
Заключение
Резюмируя полученные данные, можно заключить, что апелин-12-2 оказывал более выраженный положительный эффект, чем апелин-12, на сократительную функцию миокарда как у животных с изопротереноловым поражением миокарда, так и в контрольной группе. При этом у животных с изопротереноловым поражением миокарда улучшались и гемодинамические показатели, причем положительный эффект пептида сохранялся некоторое время и после прекращения его введения. Таким образом, данный аналог представляется перспективным в качестве кандидата для дальнейшей разработки как терапевтического средства при сердечной недостаточности.



